Konference: 2010 XXXIV. Brněnské onkologické dny a XXIV. Konference pro sestry a laboranty
Kategorie: zhoubné nádory mozku a CNS
Téma: Pokroky v biologii nádorů
Číslo abstraktu: 088
Autoři: MVDr. Jan Hraběta; MUDr. Šimon Cipro; RNDr. Jitka Poljaková; MUDr. Jana Hřebačková; prof. RNDr. Marie Stiborová, DrSc.; prof. MUDr. Tomáš Eckschlager, CSc.
Úvod
Mozkové nádory a neuroblastomy jsou nejčastější solidní nádory
dětského věku. Tumory CNS tvoří 20% všech dětských nádorů a jsou
nejčastějšími solidními nádory dětí. Neuroblastom se podílí na
8-10% nádorových onemocnění dětského věku a v průběhu prvního roku
života je nejčastějším dětským nádorem. Přestože, úspěšnost léčby
zhoubných nádorů dětského věku se výrazně zvýšila - pediatrická
onkologie je v posledních dvaceti letech považována za obor, který
dosáhl největších léčbných úspěchů - bylo u mozkových nádorů a
neuroblastomu vysokého rizika zvýšení vyléčitelnosti jedno z
nejmenších. Na častém vzniku recidiv u těchto nádorů se významně
podílí vznik chemorezistence.
Na chemorezistenci a agresivnějším chování nádorů se podílí i
jejich hypoxie. Prakticky ve všech solidních nádorech jsou v
důsledku neadekvátní angiogeneze přítomny hypoxické oblasti. Změny
exprese genů indukovaných hypoxií, které se podílejí na jejich
vzniku a progresi byly prokázány u řady nádorů. Hypoxií indukovaný
transkripční faktor (HIF) je hlavní transkripční faktor aktivovaný
hypoxií. Je tvořen dvěmi podjednotkami ARNT/HIF-1α a hypoxií
indukovanou HIF-1α s homology HIF-2α a HIF-3α. HIF-2α se podílí na
dediferenciaci a agresivnějším fenotypu buněk neuroblastomu.
Hypoxie je jednou z příčin snížení cytostatiky indukované apoptózy
a zvýšení klonogenní rezistence a genetické nestability [1].
HIF-1α a HIF-2α jsou homologní proteiny, ale mají četné odlišnosti
ve svých biologických účincích [2,3]. Z našich experimentů vyplývá,
že hypoxie (1% kyslíku) u buněčných linií neuroblastomů a
glioblastomu významně inhibuje apoptózu a přispívá tak k jejich
rezistenci. Domníváme se, že antiapoptotické působení hypoxií
indukovaných transkripčních faktorů je závislé přinejmenším na typu
nádoru a použitém protinádorovém léčivu. Selektivní inhibicí těchto
transkripčních faktorů pomocí specifických inhibitorů a siRNA
můžeme lépe porozumět jejich úloze v indukci rezistence a inhibici
programované buněčné smrti. Výsledky projektu přispějí k poznání
biologie neuroektodermálních nádorů a podílu hypoxie na jejich
biologických vlastnostech zvláště pak hypoxií navozené rezistence
vůči cytostatikům. Průkaz některých proteinů nám může poskytnout
významné prognostické či prediktivní znaky umožňující následnou
individualizaci protinádorové léčby. Ovlivněním exprese konkrétních
proteinů v podmínkách in vitro je možné navrhnout specifické
terapeutické cíle.
Cíle
Stanovit citlivost buněčných liní neuroblastomu a od nich
odvozených rezistentních linií k cisplatině, doxorubicinu a
ellipticinu a buněčných linií mozkových nádorů (meduloblastom,
glioblastom) v hypoxických a normoxických podmínkách in vitro a
pokusit se zjistit mechanismy, které se podílí na vzniku hypoxií
indukované rezistence.
Metody
Buněčné linie: neuroblastom N typu: IMR-32, UKF-NB-3; S typu:
UKF-NB-4 a SK-NA-AS a od nich odvozené rezistentní linie; mozkových
nádorů - meduloblastom: ATCC HTB 185 D 283, ATCC HTB 186 Daoy P
861, glioblastom: U87 a U373. Pro indukci hypoxického fenotypu
buněk in vitro jsme použili hypoxickou komůrku (Billups-Rothenberg
Inc.) naplněnou definovanou směsí plynů O2 1%,
CO2 5%, N2 94%. Hypoxický fenotyp testovaných
buněk jsme verifikovali stanovením exprese HIF proteinů a carbon
anhydrasy IX, glut-1 a VEGF (Western blot, RT PCR). Citlivost k
cytostatikům jsme stanovili MTT testem. Apoptozu jsme hodnotili
morfologicky, aktivací kaspáz, obsahem buněčné DNA, vazbou Anexinu
V a metodou TUNEL.
Výsledky a diskuze
U neuroblastomových linií byla největší hypoxií indukovaná
rezistence k cisplatině, nižší byl ke karboplatině a doxorubicinu,
nejnižší byla pro nově testované inhibitory histondeacetylázy
valproát a trichostatin A, mezi jednotlivými buněčnými liniemi však
byly značné rozdíly. Přehled IC50 (inhibiční koncentrace
50 - udává při jaké koncentraci je počet buněk snížen o 1/2 oproti
kontrole bez testované látky) v normoxii a v hypoxii (1%
O2) a faktor rezistence, který udává poměr
IC50 v hypoxii / IC50 v normoxii uvádí
TABULKA 1.
Inhibitor vazby HIF-1α na cílové geny - chetomin nesnižoval v
neuroblastomových buňkách apoptozu indukovanou cisplatinou v
hypoxii, ale zvyšoval jejich viabilitu. Dosud nedořešenou otázkou
zůstává možnost potenciace účinku chemoterapie na hypoxické
nádorové buňky inhibicí HIF v terapii. Dalším pravděpodobným
mechanismem, který se podílí na hypoxií indukované chemorezistenci
je snížení proliferační frakce. Všechny testované buněčné linie
měly v hypoxii zvýšené zastoupení G0/G1 fáze, která je k působení
většiny cytostatik méně citlivá než fáze S a G2/M. Proto je do
terapie nádorů s rozsáhlými hypoxickými okrsky vhodné zařadit léky,
které jsou účinné i na klidové buňky (busulfan, deriváty
nitrosurey). Snížení protinádorového efektu elipticinu v hypoxii je
podmíněno tvorbou menšího množství DNA adduktů v hypoxii než v
normoxii [4]. Tato snížená tvorba adduktů je dalším mechanizmem,
který způsobuje snížení účinku cytostatik vytvářejících addukty s
DNA v hypoxii. Tvorba adduktů s DNA se uplatňuje na účinku nejen
elipticinu, ale i antracyklinů, mitomycinu a derivátů
platiny.
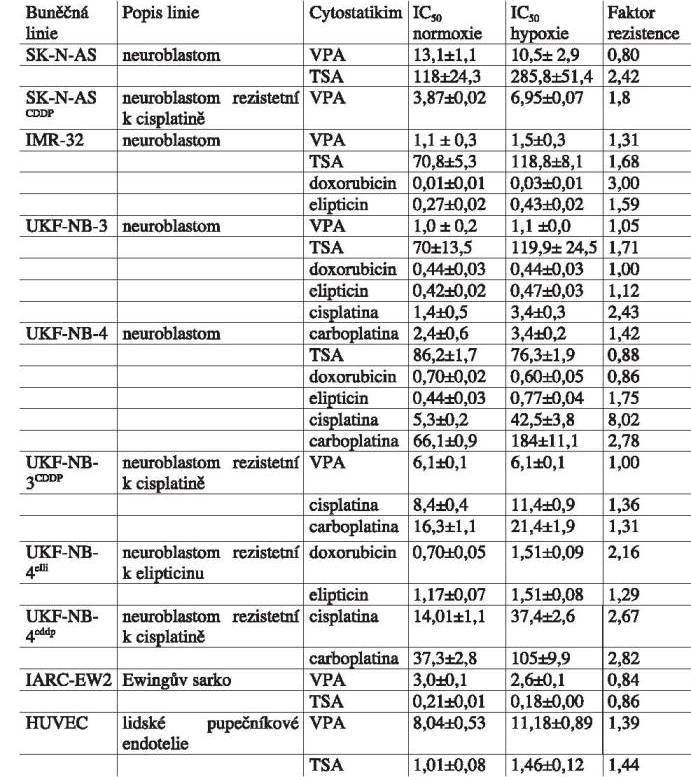
TABULKA 1.
Účinek různých cytostatik na nádorové buňky in vitro.
IC50 zjišťována MTT testem.
TSA - trichostatin A, VPA - kyselina valproová.
Závěry
Hypoxie významným způsobem snižuje citlivost neuroblastomových
buněk a buněk mozkových nádorů k řadě cytostatik. Tuto rezistenci
lze částečně zrušit inhibitorem funkce HIF-1α.
Práce byla finančně podporovaná Ligou proti rakovině Praha,
MSMT (MSM0021620813) a GAUK 72208/2008.
Literatura:
- Moeller BJ and Dewhirst MW. Br J Cancer. 2006;95(1):1-5.
- Song X et al. Cancer Chemother Pharmacol. 2006;58(6):776-84.
- Holmquist-Mengelbier L et al. Cancer Cell. 2006;10(5):413-23.
- Poljakova J et al. Biochemical Pharmacology 2009;77(9) 14661479
Datum přednesení příspěvku: 23. 4. 2010





