Konference: 2010 15. ročník odborného sympózia na téma Onkologie v gynekologii a mammologii
Kategorie: Zhoubné nádory prsu
Téma: Systémová léčba, panelová diskuse
Číslo abstraktu: 019
Autoři: MUDr. Dagmar Brančíková, Ph.D.; MUDr. Renata Neumanová, Ph.D., MBA; doc. MUDr. Zdeněk Pačovský, CSc.; MUDr. Karel Dvořák, CSc.; MUDr. Eva Jandáková
Důležitost systémového přístupu ke karcinomu
prsu byla akceptována již Hippokratem (400 l př.n.l.), který
pozoroval, velké množství úmrtí pacientů po té, co byl odstraněn
primární tumor. V 18. století sváděla míra medicínského poznání
lékaře k myšlence, že karcinomy jsou v řadě případů onemocněním
lokálním a radikalizovala se léčba chirurgická. Teprve až od roku
1940 Haagenson a Stout popisují kritéria operability a snaží se
predikovat význam radikality chirurgických výkonů ve vztahu k
pacientově prognóze.
Primárním cílem neoadjuvantní systémové
léčby je downstaging, umožňující provedení prs záchovného
výkonu u většího podílu pacientek, aniž by bylo kompromitováno
jejich přežití nebo čas do progrese nemoci a zvýšení míry
patologické kompletní regrese (pCR), která je kriteriem pro
prodloužené přežití (OS).
Sekundárně můžeme hodnotit in vivo
chemosenzitivitu na prováděnou léčbu a srovnávat v rámci studií
účinnost jednotlivých chemoterapeutických režimů. Potenciální
výhodou neoadjuvantní léčby je také inhibice nádorového růstu,
který je popisován po chirurgických výkonech, a současně též
existují údaje o tom, že neoadjuvantní chemoterapie redukuje
velikost a počet pozitivních uzlin v axille.
Rizikem neoadjuvantního konceptu terapie je
možnost nadbytečné léčby u pacientek, které nemají přesně odečtený
výsledek primární biopsie, možnost progrese nemoci, která znemožní
následný chirurgický výkon, nebo ztráta prognostického významu
postižení axilárních uzlin, pakliže v nich dojde k regresi
nádorového postižení.
Stěžejní studií pro podávání této léčby byla
studie NSABP B18 (4x AC, operace vs operace, 4xAC). Obě
ramena měla stejné OS i DFS, avšak ve skupině léčené neoadjuvantně
podstoupilo více pacientek prs šetřící výkon (68% vs 60%).
Při analýze podskupin se ukázalo, že u
pacientek, u kterých bylo neoadjuvantní léčbou dosaženo patologické
CR, došlo i k prodloužení OS. Proto základním cílem všech nově
designovaných neoadjuvantních studií je tvorba takových léčebných
schémat, které by vedla k nejvyšší četnosti pCR.
Další studie
Studie Royal Marsden Hospital et al. (Makris et al.)
prezentovala trial s použitím primární CHT, operace a adj. CHT
versus operace a adjuvantní CHT.
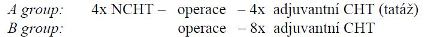
Byla prokázána významná redukce radikálních
modifikovaných mastektomií u žen po neoadjuvantní chemoterapii, ve
srovnání s ženami, které obdržely chemoterapii adjuvantní.
Kompletní klinická regrese (cCR) byla
zaznamenána u 22% žen, částečná klinická odpověď u 29% pacientek a
patologická kompletní regrese (pCR) byla zaznamenána u 33% žen, tj.
celkově v rameni s neoadjuvancí byl RR 84%, stav beze změny byl
registrován u 15% žen a jen 2 pacientky měly evidentní progresi
základního onemocnění.
Medián follow byl cca 48 měsíců, v obou
skupinách však nebyly zaznamenány statisticky významné rozdíly v
době do lokální recidivy či vzdálené diseminace, ani v době
celkového přežívání.
Trial NSABP 17 (Fischer et al.) u pacientek s operabilním
karcinomem prsu ke srovnání předoperačně a pooperačně podané
chemoterapie.
Group A: podstoupila nejprve chirurgický výkon a následně
dostala 4 cykly AC nebo
group B: měla 4x AC neoadjuvantně a následně operační
výkon
Pacientky, které měly parcielní mastektomii se
dále podrobily adjuvantní radioterapii a to v obou skupinách, v
průběhu 5 ti let bylo zrandomizováno 1523 pacientek (760 a
763).
Výsledky: kompletní klinické odpovědi
dosáhlo 36% pacientek a 44% dosáhlo parcielní klinické odpovědi,
tj. celková klinická odpověď je 80%. Beze změny zůstalo 17 %
pacientek, ve 3% případů došlo k progresi. Dle multivarietní
analýzy byl rozměr tumoru a stav uzlin významným prediktorem
klinické odpovědi tumoru.
Z pacientek, které dosáhly kompletní klinické
odpovědi mělo 26% patologickou kompletní odpověď, u 11% byla
nalezena jen ložiska mikroinvazivního ca .
Downstaging v oblasti axillárních uzlin: Byla
prokázána jasná souvislost s podáním neoadjuvantní chemoterapie a
downstagingem axillárních uzlin. 57% pacientek, které měly
adjuvantní CHT měly patologicky postižené axillární uzliny, 41%
pacientek, po obdržení neoadjuvantní chemoterapii byly N0 (P<
0,001). Přibližně 1/3 patologicky positivních uzlin byla
konvertována na patologicky negativní.
Též byla zaznamenána korelace mezi odpovědí
tumoru a uzlin na CHT. Pacientky, které podstoupily předoperační
CHT mohly ve větší míře podstoupit i prs záchovný výkon, zvláště
markantní byly rozdíly u žen s primárním tumorem nad 5 cm rozměru.
(22% versus 8%).
Lokální recidiva na stejné straně se v průběhu
let u pacientek po parcielní mastektomii objevila v pooperační
skupině v 5,8%, ve skupině předoperační v 7,9%, přičemž tento
rozdíl nebyl signifikantně významný.
Celkové výsledky – po srovnání obou
skupin nebyly nalezeny signifikantně významné rozdíly v DFS,
distant DFS a OS mezi oběma skupinami. Pro obě skupiny po 5 ti
letém sledování byl DFS 67%, distant DFS 73% a OS 80%.
Byly však zaznamenány signifikantně významné
vztahy mezi kompletní klinickou a patologickou odpovědí u skupiny s
předoperační chemoterapií v závislosti na celkových výsledcích.
Pacientky, které kromě cCR měly i pCR, měly prokázané významně
delší DFS a OS ve srovnání s těmi, u kterých bylo prokázáno
residuum invazivního karcinomu.
Z toho plyne, že pCR indikuje lepší prognozu
!
Klinické trialy s taxany:
Taxany vykazují vysokou účinnost zejména u
pacientů antracyklin resistentních, jsou velice účinné v první
linii MBC, celková odpověď je 30-60%. Z nežádoucích účinků je
výrazná především neuropatie, která u cca 14% pacientů dosahuje
G3-4.
Studie NSABP B27: 4 x AC následovaná operací versus 4 x AC
následovaná 4x docetaxelem v monoterapii (design) následně operace,
nebo 4x AC – operace – 4x docetaxel. Kombinací AC a Docetaxelu lze
docílit 25,6% pCR (pro srovnání – 4xAC vede k 13,7% pCR).
Studie Greenova: aplikace 12x paklitaxel týdně následovaný
4x FAC s 28,8% pCR.
Studie ECTO: 8x AC – operace versus 4xAC následovaná 4x
Taxol – operace versus operace a následně 4xAC následovaná 4x
Taxol. V rameni s Taxolem bylo při neoadjuvantním použití dosaženo
65% BCS (Brest conserving surgery) oproti kontrolní skupině, kde
byl prs šetřící výkon proveden u 34% nemocných (p<0,01), v této
studii byl též prokázán signifikantní downstaging v oblasti
axillárních uzlin, např. ypN 60% po primární chemoterapii versus
pN0 39% ve skupině bez neoadjuvance (p<0,01).
Studie Munich: řešila otázku efektivity podání denzního
režimu versus standardní dávkování. Podávala buď Epirubicin 150
mg/mě 3x, sekvenčně Taxol 250 mg/m2 3x následovala
operace a adjuvantně CMF 3x versus Epirubicin 90 mg/m2 a
Taxol 150 mg/m2 současně 4x následovala operace a CMF
3x. Denzní režim vykazoval signifikantně vyšší procento pCR.
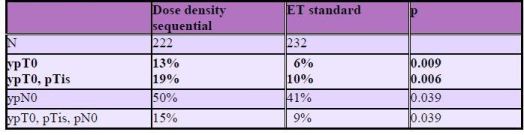
Untch et al. (AGO study), randomizoval 475 pacientek s
pokročilým karcinomem prsu větším než 3 cm nebo inflamatorním do
dvou skupin. První obdržela epirubicin 3x a následně paclitaxel
taky 3x s podporou G-CSF v 2 týdenním režimu nebo kombinaci EPI a
PAC každé 3 týdny 4x .
Předběžná data uvádějí zvýšení počtu prs
záchovných operací v rameni A ve srovnání s ramenem B (66% vs.55%)
a pCR jsou 18% v dose-dense sekvenčním rameni versus 10% ve
standardním. Adjuvantně obdržely všechny pacientky CMF a RT.
Tato studie prokázala, že dose-dense režim se
sekvenčním podáním EPI a PAC vede ke zvýšení frekvence
konzervativních chirurgických výkonů a vyšší míře pCR v primárním
tumoru i axillárních uzlinách.
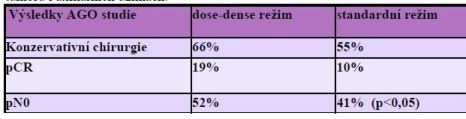
Studie Greenové, měla prověřit efekt standardně podávaného
paclitaxelu v třítýdenním režimu ve srovnání s režimem
týdenním.
Pacientky s negativními uzlinami (N-) obdržely
80 mg/m2 paclitaxelu 1x týdně 12x, pacientky s
pozitivními uzlinami (N+) 150 mg/m2 1x týdně vždy 3x s
jedním týdnem pauzy, to vše 4x + 4x FAC. Srovnávací skupina
obdržela u pacientek (N+ i N-) 225 mg paclitaxelu v 3 týdenním
podání 4x + 4x FAC.

Týdenní podání paclitaxelu následované aplikací
FAC zdvojnásobilo pCR ve srovnání s 3týdenním podáním Taxolu
následovaného podáním FAC.
U pacientek N+ byla pCR (mamma i uzliny)
prokázána u 28% pacientů v týdenním režimu, ve srovnání s 13,7% u
pacientek v režimu standardním.
U pacientek s N- byla pCR prokázána ve 29,4% ve
weekly podání, ve srovnání s 13,4% v podání třítýdenním.
Výsledky trialu demonstrují, že standardní dávky
samotného paclitaxelu (PAC) v neoadjuvantním podání mají výraznou
antitumorózní aktivitu, která je srovnatelná s FAC režimem. Avšak
použití dose denze režimu poukazuje i na výrazné zvýšení pCR, a to
v případě pacientek s pozitivními i negativními uzlinami. Týdenní
podání mělo přitom zaznamenánu nižší nebo srovnatelnou toxicitu při
podstatně lepší účinnosti.

Dalších 15 studií probíhá a budou ukončovány do roku 2015
Studie s hormonoterapií v neoadjuvanci
2 separátní randomizované trialy
IMPACT (Immediate Preoperative Anastrozole Tamoxifen or
Combined with Tamoxifen ) z r. 2005, kdy prokázal vyšší efekt léčby
anastrozol oproti Tamoxifenu v 3 měsíční léčbě 46% po anastrozolu
vhodných pro prs záchovný výkon proti 22,2% pacientek s tamoxifenem
n (P = 0.03). Podobné výsledky měla studie PROACT z r. 2006.
PO24 Letrozol proti tamoxifenu po kdy po 4 měsících
neoadjuvantní hormonoterapie prokázal vyšší efekt letrozol před
tamoxifenem 45% prs záchovných výkonů versus 35% u tamoxifenu,
na hladině (P = 0.022).
Po provedených subanalýzách byl jednoznačnější rozdíl v expresi
faktorů rezistence na Tamoxifen.
Již u pacientek s expresí HER 2 neu byla při subanalýze rozdíl
jednoznačně vyšší
Letrozol oproti tamoxifenu OR 88% vs 21%; P = 0.0004.
U Studií s exemestanem byly rozdíly obdobné.
Skupina pacientek ER+ HER 2 neu + : Triplet target therapy
Nejsou zkušenosti, zatím však existují slibná data ze studie
TANDEM (TrAstuzumab in Dual HER2 ER-Positive Metastatic breast
cancer [TAnDEM trial]) pro metastatický karcinom triplet
pozitivní.
Před nasazením neoadjuvantní systémové léčby je
nutné se zamyslet nad otázkou, které ženy budou pravděpodobně
nejvíce z primárního podání chemoterapie profitovat.
Studie ECTO
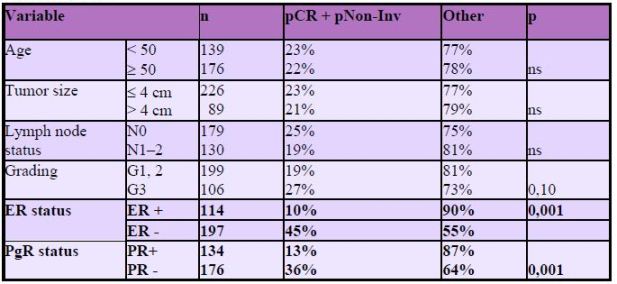
Ve studii ECTO byla dále provedena subanalýza
efektu neoadjuvantní chemoterapie u výše uvedených podskupin
nemocných a z výsledku vyplývá, že největší efekt z tohoto podání
mají pacientky s hormonálně independentním karcinomem.
Nutné je i zvážit ostatní prediktivní faktory s
ohledem na možnost podání neoadjuvantní hormonální léčby. U
postmenopauzálních žen, zejména vyššího věku (nad 70 a více), s
nádory s vysokou pozitivitou hormonálních receptorů, s G 1-2, s
nízkými hodnotami Ki 67 a HER 2 negativitou lze uvažovat o
hormonální neoadjuvantní léčbě. Účinnější je nasazení letrozolu než
tamoxifenu (RR 55% vs 36%, p<0,001; četnost prs záchovných
výkonů, 45% vs 35%, p<0,022). Medián času do dosažení odpovědi
činil 66-70 dní)
chirurgická léčba
Chirurgická léčba po provedení neoadjuvantní
léčby se řídí stejnými pravidly, jako léčba primárně chirurgická.
Vzhledem k častému výskytu CR je nutné před zahájením léčby označit
tuší nebo jiným způsobem rozsah a umístnění primárního nádoru, aby
operatér toto místo rozpoznal. Přístup k rozsahu provedeného výkonu
po výrazné regresi tumoru může být na řadě pracovišť rozdílný. Na
některých pracovištích je upřednostňována resekce v rozsahu
původního rozměru nádoru včetně bezpečnostního lemu, jinde se
chirurgové řídí rozměrem nálezu těsně před operací tedy aktuálním.
Existuje však jednoznačná shoda v tom, že je nutné odstranění
tumoru in sano s dostatečným lemem (v tomto případě minimálně 5
mm)
systémová pooperační léčba
Druhou důležitou otázkou, kterou musí klinik
vyřešit, je otázka nasazení adjuvantní léčby u pacientky po
neoadjuvantní léčbě a operaci. S výjimkou výše zmíněné studie NSABP
B18 byla v dalších více než 12 randomizovaných klinických studií
adjuvantní léčba podávána. Mimo rámec klinické studie tedy nelze
standardní adjuvantní systémovou léčbu opomenout.
Otázkou však zůstává optimální složení
adjuvantní a neoadjuvantní terapie.
Trail GEPARTRIO /Studie f III z r. 2008 na 2090
pacientkách. Neoadjuvantně byly podány 3 serie režimu TAC a pokud
dle UZV nebylo zmenšení alespoň 50%, bylo po randomizaci
pokračováno 4 cykly TAC nebo režimem NX (Navelbin/Capecitabin také
celkem 4 cykly). Nebyl prokázán rozdíl ani v provedení BCS. (184
[57.3%] v rameni TAC versus 180 [59.8%] v rameni NX ) ani v
patologických kompletních odpovědích (5.3% vs 6.0%).
pooperační radioterapie
Pooperační radioterapie na oblast prsu po
neoadjuvantní léčbě a prs šetřícím výkonu nemá žádné specifikum,
které by bylo nutné zohlednit. Otázkou zůstává indikace k ozáření
stěny hrudní po provedené RMME a event. uzlinové oblasti (v případě
konzervativních i radikálních operací), v situaci, kdy výsledná
pooperační histologie prokáže skutečně výrazný downstaging, tj.
pooperační klasifikace sama o sobě by již indikaci k RT nedávala.
Jakou klasifikací by se tedy radioterapeut měl při svém rozhodování
řídit, primární nebo pooperační???
Bucholz et al. na základě retrospektivní analýzy
pacientek po neoadjuvantní chemoterapii a následné mastektomii bez
následně provedené radioterapie udává 5-leté riziko lokoregionální
recidivy 7-13% u pacientek s nálezem reziduálního tumoru v
histopatologickém preparátu do 2 cm a 1-3 pozitivními uzlinami
(nenachází signifikantní rozdíl proti skupině s podanou adjuvantní
CHT), zatímco u reziduálních tumorů 2-5 cm a 1-3 pozitivními
uzlinami toto riziko stoupá na 32% a u 4 a více pozitivních uzlin
53%.
U žen, u kterých došlo po neoadjuvantní terapii
k velice významné regresi původního nálezu na ypT0-1 po mastektomii
a je-li adekvátně provedena exenterace axilly tj. je odstraněno a
vyšetřeno minimálně 10 uzlin a všechny jsou negativní, existuje
možnost stěnu hrudní, axilu a nadklíček neozařovat. V případě
pozitivity jakékoliv uzliny či neadekvátní exenteraci je adjuvantní
RT po primární systémové léčbě indikována.
Role neoadjuvantní CHT v léčbě operabilního
karcinomu prsu je tedy následující, může v některých případech
nahradit chemoterapii podávanou adjuvantně, zejména u pacinek,
které si přejí provedení prs záchovného výkonu tam, kde by původní
rozměr tumoru byl pro primární chirurgický výkon nevhodný a
současně po operaci dojde k výraznému downstagingu, který
adjuvantní chemoterapii nevyžaduje (ani další biologické
charakteristiky nádoru). Předoperační podání je výhodné i z důvodu
neporušeného cévního zásobení.
Výhodou neoadjuvantní chemoterapie je navození
klinické či i patologické regrese tumoru, což může být použito
nejen jako prognostický faktor, ale i jako vodítko pro výběr
následné adjuvantní systémové terapie.
Protože odpověď tumoru na předoperační
chemoterapii je prakticky ihned hodnotitelná, je možné
neoadjuvantní chemoterapii využít k testování účinnosti
jednotlivých léků a režimů. Studie prokázaly i korelaci mezi
biomarkery a odpovědí tumoru na neoadjuvantní chemoterapii.
Prognostické tumor markery: ER, PgR, ploidita, S fáze,
erbB2, p53, growth factor korelují (samostatně nebo v kombinacích)
s odpovědí tumoru na léčbu, tudíž tyto markery mohou mít
prognostickou hodnotu pro DFS a OS. Nadějné se do budoucna jeví
využití těchto biomarkerů k predikci pacientek, u kterých se dá –
po dosažení cCR - vysoce pravděpodobně očekávat i pCR a u kterých
je vhodné dále pokračovat chirurgií nebo RT.
Uvedení nových tříd chemoterapeutických a
biologických agens do praxe, dává možnost podpořit další trialy,
které se budou neoadjuvantní chemoterapií zabývat. Testovány jsou i
nové varianty podání včetně dose dense režimů, sekvenčního podání
apod., v kombinacích jsou využívány další látky jako např.
vinorelbin, gemcitabin, trastuzumab, avastin aj.
Závěry:
Randomizované klinické studie prokázaly, že NCHT
vede ve velkém procentu případů ke zmenšení primárního tumoru i
axillárních uzlin, čímž výrazně zvyšuje šanci žen na provedení
konzervativního prs šetřícího výkonu. DFS a celkové přežívání je
stejné.
Trendem jsou zejména taxany, užití weekly a
dose-dense režimů event. jejich sekvenční podání. U žen s
potvrzenou HER2 pozitivitou je velice účinné zařazení trastuzumabu
do primárního předoperačního podání. Optimální režim nebyl zcela
jasně definován. Je potřeba zvažovat všechny biologické
charakteristiky tumoru a další prognostické a prediktivní faktory,
které mohou v rozhodování o vhodném režimu být nápomocny.
Datum přednesení příspěvku: 15. 4. 2011





