Konference: 2008 XVI. Západočeské pneumoonkologické dny
Kategorie: Zhoubné nádory plic a průdušek
Téma: Konference bez tematických celků
Číslo abstraktu: 2008_06
Autoři: prof. MUDr. Petr Zatloukal (1955-2012), CSc.
Česká republika patří mezi země s vysokou incidencí i mortalitou na karcinom plic. Ročně umírá na karcinom plic v České republice více než 5 600 nemocných (4 346 mužů a 1 343 žen za rok 2004) (ÚZIS, 2007). Mortalita na karcinom plic se sice u mužů mírně snižuje, za posledních 25 let klesla asi o 15 %, ale stále je velmi vysoká a u žen dochází k trvalému vzestupu. Výsledky léčby jsou i přes nesporný pokrok stále neuspokojivé a většina nemocných na toto onemocnění zemře. Nepříznivé ukazatele dlouhodobého přežívání jsou způsobeny také tím, že většina onemocnění je už v době zjištění v pokročilém stadiu, kdy již není proveditelné radikální odstranění nádoru chirurgicky. Většina onemocnění je tak odkázána na konzervativní způsob léčby – chemoterapii, v indikovaných případech v kombinaci s radioterapií.
Klinický obraz
Rakovina plic je onemocněním vyššího věku, většina onemocnění se vyskytuje ve věkové skupině 60–70 let. I když je v poslední době určitá tendence posunu do nižších věkových kategorií, je u mladých lidí do 30 let zcela výjimečné. Poměr mužů a žen je 4:1 a postupně se snižuje.
Většina pacientů, asi 75 %, má v době diagnózy příznaky. Jen u menší části nemocných je však onemocnění diagnostikováno v časném stadiu. Malé, zvláště periferní nádory jsou obvykle asymptomatické.
Charakter projevů bronchogenního karcinomu závisí na lokoregionálním šíření (invaze do okolních struktur, postižení regionálních uzlin), lokalizaci vzdálených metastáz a paraneoplastických projevech.
Kašel je nejčastějším příznakem rakoviny plic. Je obvykle suchý, dráždivý. Vykašlávání velkého množství mukoidního sputa se ojediněle vyskytuje u pokročilých forem bronchioloalveolárního karcinomu. Změna charakteru kašle u nemocného s chronickou bronchitidou v neproduktivní záchvatovitý kašel nesmí být ponechána bez povšimnutí.
Hemoptýza je vždy alarmujícím příznakem, a to i v případech, kdy je příměs krve ve sputu minimální. Rakovina plic je jednou z nejčastějších příčin hemoptýzy. Zhruba 20 % hemoptýz je způsobeno maligním nádorem.
Úbytek na váze se vyskytuje u pokročilejších forem onemocnění a spolehlivě signalizuje horší prognózu. S postupnou progresí nemoci vede v mnoha případech ke kachexii. Není vysvětlitelný jen snížením příjmu potravy při nechutenství, které onemocnění často provází, ale je multifaktoriální a komplexní povahy. Uplatňuje se zde systémový efekt různých cirkulujících cytokinů, TNF-α (tumor necrosis factor-α), IL-1β (interleukin-1β) a řada dalších faktorů.
Dušnost má řadu příčin. Vzniká obturací bronchu intraluminálním růstem tumoru nebo extramurálním tlakem se vznikem atelektázy nebo pneumonie za stenózou, pleurálním nebo perikardiálním výpotkem, karcinomatosní lymfangiopathií, provází syndrom komprese horní duté žíly nebo tromboembolie, které jsou u rakoviny plic běžné. Další možnou příčinou dušnosti je unilaterální paréza bránice z postižení n. phrenicus.
Bolest na hrudi bývá lokalizována na postižené straně, je obvykle intermitentní, tupá, někdy s charakteristickou lokalizací pod lopatkou. Ostrá, trvalá bolest bývá projevem prorůstání do mediastina nebo hrudní stěny. Při postižení pleury mívá pleurální charakter (ostrá, bodavá, závislá na dýchání a kašli).
Chrapot bývá často způsoben postižením nervus laryngeus recurrens v mediastinu. V takových případech se zjistí při laryngoskopickém vyšetření (nebo při bronchoskopii) paresa hlasivky na postižené straně a pokládá se při vyloučení jiné příčiny chrapotu za známku inoperability i v případech, kde zobrazovacími metodami se postižení mediastina neprokáže.
Dysfagie budí podezření na útlak jícnu prorůstáním nádoru nebo nádorem postiženými uzlinami.
Pancoastův syndrom je příznakový soubor způsobený Pancoastovým tumorem. Tak je označován bronchogenní karcinom (zpravidla epidermoidní) lokalizovaný v plicním vrcholu s lokální extrapulmonální invazí. Postihuje plexus brachialis a působí bolesti lokalizované často do ramene a do oblasti horní končetiny inervované n. ulnaris. Postižení krčního sympatiku se projevuje Hornerovým syndromem, který zahrnuje příznakovou triádu – ptóza víčka (paresa mm. tarsales), mióza (paresa m. dilatator pupillae) a enopthalmus (paresa m. orbitalis). Běžným nálezem u Pancoastova tumoru je osteolýza 1. nebo 2. žebra, případně prorůstání do obratlů.
Syndrom komprese horní duté žíly vzniká prorůstáním nádoru nebo útlakem, často v kombinaci s nasedajícím trombem. Iniciální příznaky, otoky víček a mírné prosáknutí krku mohou uniknout pozornosti. Rozvinutý obraz s výrazným otokem krku a obličeje, plethorickým vzhledem, zvýšenou náplní žil a rozvojem kolaterálního oběhu umožní stanovení diagnózy již z fyzikálního vyšetření. Projevy vzdálených metastáz závisí na jejich lokalizaci. Bronchogenní karcinom může metastázovat prakticky do všech orgánů. Nejčastější lokalizace je skelet, mozek, játra, lymfatické uzliny, nadledviny a plíce.
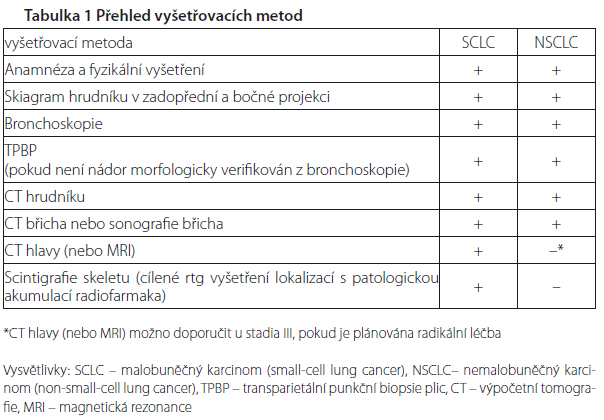
Paraneoplastické syndromy lze očekávat u 10–20 % nemocných rakovinou plic. Jsou tak označovány vzdálené projevy, které nejsou způsobeny přímou invazí primárního tumoru nebo metastáz. Tvoří velmi heterogenní skupinu několika desítek klinickopatologických jednotek, jejichž patogeneze je u velké části hypotetická nebo ne zcela jasná. Obecně však zřejmě jde o reakci organismu na produkci biologicky aktivních proteinů nebo polypeptidů, včetně peptidických hormonů nebo jejich prekurzorů, růstových faktorů, interleukinů, citokinů a řady dalších substancí, někdy jde o projevy autoimunity. Proto je jejich třídění jen popisné, podle orgánu nebo systému s klinicky evidentním postižením. Nejčastěji jsou sdruženy s malobuněčným karcinomem, ale vyskytují se i u ostatních morfologických typů. Vyšetřovací postup Při vyslovení podezření na možnost rakoviny plic je nutné brzy podezření potvrdit, nebo vyloučit. Odkládání vyšetření nebo zdlouhavý vyšetřovací proces může zhoršit šanci na úspěch léčby.
Vyšetřovací postup je zaměřen na tyto na tyto oblasti:
- nádorový proces morfologicky verifikovat a určit histologický typ,
- zjistit lokální rozsah nádoru v plíci a vztah k okolním strukturám,
- zjistit regionální rozsah nádoru, tzn. postižení regionálních lymfatických uzlin,
- zjistit výskyt vzdálených metastáz,
- identifikovat komplikace, které nádor svým šířením působí,
- identifikovat případné paraneoplastické projevy.
Pro zjištění lokálního rozsahu primární lokalizace je
nejdůležitější posoudit výskyt prorůstání do okolních struktur,
hrudní stěny, mediastina nebo bránice.
Regionální lymfatické uzliny pro bronchogenní karcinom jsou
intrapulmonální včetně hilových, mediastinální, supraklavikulární a
skalenové. Postižení lymfatických uzlin ve všech ostatních
lokalizacích je posuzováno jako vzdálené metastázy.
Bronchogenní karcinom může metastázovat prakticky do všech orgánů.
Nejčastější lokalizace vzdálených metastáz jsou mozek, játra,
skelet, nadledviny, plíce, ledviny, lymfatické uzliny mimo
regionální uzliny, kůže a podkoží. Za vzdálenou plicní metastázu se
podle současně platné TNM klasifikace z roku 1997 pokládá plicní
metastáza nejen v kontralaterální plíci, ale i výskyt v jiném
laloku ipsilaterální plíce.
Výběr vyšetřovacích metod závisí do určité míry na morfologickém typu, zda se jedná o malobuněčný, nebo nemalobuněčný karcinom a na plánované léčbě. Nepokládá se za účelné provádět kompletní vyšetřovací program u nemocných, u kterých nepřichází v úvahu žádná protinádorová léčba, například z důvodu neúnosnosti nebo odmítnutí léčby. Pacient se tak nezatěžuje vyšetřeními, která by bez ohledu na jejich výsledek nijak nezměnila další postup.
V pracovní anamnéze je nutno ptát se aktivně na rizikové profese
a pátrat po expozici rizikovým faktorům v pracovním prostředí,
které se uplatňovaly i s mnohaletým časovým odstupem. Je to
expozice ionizujícímu záření v uranových dolech, práci se zdroji
ionizujícího záření, chemickým kancerogenům, azbestu a
dalším.
V rodinné anamnéze bývá významný údaj o nakupení maligních nádorů v
příbuzenstvu naznačující genetickou zátěž.
V osobní anamnéze jsou významné údaje o prodělaných zhoubných
onemocněních. Nemocný s dříve prodělaným plicním nádorem je ve
vyšším riziku vzniku duplicitního tumoru.
U každého nemocného je nutno zjistit celkový počet vykouřených
cigaret. Jedinci s celkovým počtem vykouřených cigaret nad 150 000
jsou již ve vysokém riziku vzniku plicní rakoviny. Celková nálož
vykouřených cigaret se také v anglosaských zemích vyjadřuje
jednotkou „pack/year“, což je počet denně vykouřených balíčků
cigaret vynásobený počtem let kouření. Pokud někdo kouří dva
balíčky cigaret denně po dobu 20 let, má hodnotu 40 pack/year.
Podle lokalizace se rozlišuje centrální forma (v plicním hilu nebo těsně související s hilem) a periferní forma.
U centrálních forem je při rentgenovém vyšetření patrné zvětšení stínu plicního hilu vybíhající pruhovitými stíny do periferie. V některých případech nádor široce prorůstá do mediastina – pulmomediastinální forma. V ojedinělých případech, při převažujícím endobronchiálním růstu a u nádorů vycházejících z hlavních bronchů, může být rentgenový nález negativní i při pokročilém onemocnění. Při lokalizaci i poměrně velkého nádoru v dolním laloku levé plíce nebo v dorzobazální lokalizaci může být nález na zadopředním skiagramu hrudníku normální, protože stín retrokardiálně uloženého nádoru se sumuje se srdečním stínem a dorzobazálně lokalizovaný nález se sumuje se stínem bránice, která je ventrálně uložena výše. Proto je doporučováno provádění i bočných skiagramů hrudníku.
Při obturaci bronchu nádorem je při rentgenovém vyšetření patrná
segmentální, lobární nebo alární atelektáza. Někdy dochází v nádoru
k rozpadu tkáně a tato dutina se nazývá Joresova (čti: joresova)
kaverna.
CT vyšetření je citlivější metodou, lépe odliší prorůstání do
okolních struktur a hlavně je nezastupitelné při hodnocení
postižení mediastinálních uzlin. Pro hodnocení postižení
lymfatických uzlin se posuzuje jejich velikost.
Další základní vyšetřovací metodou je bronchoskopie, která vedle
posouzení endobronchiálního rozsahu nemoci umožňuje u centrálních
forem odběr vzorku tkáně k mikromorfologickému vyšetření.
U periferně lokalizovaných lézí, nedostupných při bronchoskopickém
vyšetření, je další možností k odběru vzorku tkáně transparietální
punkční biopsie plic. Je prováděna cíleně pod rentgenovou nebo CT
kontrolou.
Další možnosti k morfologické verifikaci jsou thorakoskopie (resp.
videothorakoskopie), mediastinoskopie, popř. parasternální
mediastinotomie.
Volba léčebné strategie závisí na histologickém typu, rozsahu
onemocnění v době diagnózy (stadiu), stavu výkonnosti (performance
status) a přidružených chorobách.
Stanovení histologického typu je standardní součást diagnostiky
plicního karcinomu a je vždy vyžadováno před rozhodnutím o léčbě.
Výjimku tvoří nemocní s operabilním nádorem, který se nepodařilo
morfologicky verifikovat z bronchoskopie. Tito nemocní jsou
indikováni k operaci a nádor je histologicky ověřen při operaci z
peroperační biopsie.
Třetí revize histologické klasifikace z roku 1999 (Travis et al.,
1999) rozeznává devět hlavních typů epitelových maligních plicních
nádorů, viz tabulka 2. Z hlediska léčby se v klinické praxi používá
zjednodušené dělení na malobuněčný a nemalobuněčný typ. Označení
nemalobuněčný plicní karcinom zahrnuje všechny typy kromě
malobuněčného karcinomu a karcinoidu. Toto dělení bylo zavedeno z
praktického hlediska, neboť u nemalobuněčného karcinomu se
používají stejné léčebné postupy bez ohledu na histologický typ,
zatímco pro malobuněčný karcinom je léčebná strategie jiná.
Tabulka 2 Histologická klasifikace maligních epitelových nádorů plic dle WHO (Travis et al., 1999).
- spinocelulární karcinom (epidermoidní karcinom)
- malobuněčný karcinom
- adenokarcinom
- velkobuněčný karcinom
- adenoskvamózní karcinom
- karcinomy s pleomorfními, sarkomatoidními nebo sarkomatózními elementy
- karcinoid
- karcinom typu slinných žláz
- nespecifikovaný karcinom
Nejvýznamnějším kritériem pro volbu léčby je stadium v době diagnózy. V současnosti je používána pátá revize TNM klasifikace a dělení do stadií z roku 1997 (Mountain, 1997). Podle této klasifi kace jsou onemocnění podle pokročilosti dělena do čtyř stadií, z nichž stadium I, II a III mají dvě podstadia.
Hlavní zásady pro určení stadia:
Stadium I zahrnuje T1 (nádor do 3 cm v nejdelším průměru) a T2
(nádor větší než 3 cm, nádor postihující hlavní bronchus ve
vzdálenosti větší než 2 cm od kariny, nádor působící atelektázu
menší, než je celá plíce), bez postižení lymfatických uzlin;
stadium IA – T1N0, stadium IB – T2N0.
Stadium II zahrnuje nemocné s postižením regionálních mízních uzlin, nejvýše však do úrovně uzlin hilových homolaterálně (N1), stadium IIA – T1N1, stadium IIB – T2N1. Dále se do stadia IIB ještě zahrnují nemocní s T3 (T3 – tumor jakékoliv velikosti s přímým šířením do hrudní stěny nebo bránice, mediastinální pleury, parietálního perikardu nebo tumor postihující hlavní bronchus ve vzdálenosti < 2 cm distálně od kariny, ale bez postižení kariny; nebo je sdružen s atelektázou nebo s pneumonií za stenosou postihující celou plíci) bez postižení uzlin – T3N0.
Většina nemocných klinického stadia III A má metastaticky postižené homolaterální mediastinální nebo bifurkační uzliny (N2). Dále jsou do stadia IIIA zahrnováni nemocní s T3N1.
Stadium IIIB zahrnuje nemocné s T4 (nádor jakékoli velikosti s invazí do: mediastina, srdce, velkých cév, průdušnice, jícnu, těl obratlů nebo kariny; nebo tumor s maligním pleurálním nebo perikardiálním výpotkem, nebo se satelitním nádorovým uzlem ve stejném laloku ipsilaterální plíce) nebo N3 (metastáza v kontralaterální mediastinální uzlině, kontralaterální hilové, ipsilaterální nebo kontralaterální skalenové nebo supraklavikulární uzlině).
Stadium IV zahrnuje nemocné se vzdálenými metastázami. Za vzdálené metastázy se však podle této klasifikace pokládají metastázy nejen do jiných orgánů, ale i do jiného laloku homolaterální plíce a samozřejmě i metastázy v kontralaterální plíci. Vedle klasifikace stadií podle TNM, která se používá pro všechny histologické typy bronchogenního karcinomu, existuje jen pro malobuněčný karcinom další klasifikace rozlišující dvě stadia, (tabulka 3, Stahel et al., 1989). Tato klasifikace rozděluje malobuněčný karcinom plic na limitované (LD – limited disease) a extenzivní (ED – extensive disease) stadium.

Posouzení stavu výkonnosti (Performance status, PS) je dalším důležitým faktorem při indikaci způsobu léčby. Nemocní s nedobrým stavem výkonnosti mají obecně podstatně horší prognózu. Špatný stav výkonnosti bývá kontraindikací protinádorové léčby, protože je u těchto nemocných sdružena s vyšším rizikem komplikací a zpravidla prognózu nemocného nezlepší.
Dalším faktorem ovlivňujícím volbu léčebného postupu jsou
přidružené nemoci. Nemocní s nedostatečnou funkcí ledvin, jater,
srdce nebo pokročilou kachexií jsou kontraindikováni k
chemoterapii.
Veškerá vyšetření k určení typu nádoru, lokálního rozsahu,
postižení regionálních mízních uzlin i vzdálených metastáz musí být
provedeny před zahájením protinádorové terapie. Výjimku z tohoto
pravidla představují jen neodkladné stavy a hrozící riziko z
prodlení. Stanovení léčebné strategie je velmi závažným rozhodnutím
a má být prováděno na klinických indikačních seminářích za účasti
hrudního chirurga, klinického onkologa a pneumologa, kteří mají
dostatečné zkušenosti s léčbou plicních nádorů. Optimální je
odeslat nemocného už v době vyslovení podezření na možnost plicního
nádoru do specializovaného pneumoonkologického centra, kde je
provedeno i kompletní vyšetření. Je prokázáno, že léčebné výsledky
na specializovaných pracovištích, kde je soustředěn větší počet
těchto nemocných, jsou lepší než na pracovištích, kde jsou
zkušenosti s diagnostikou a léčbou plicních nádorů menší.
Léčba malobuněčného karcinomu
Malobuněčný karcinom plic tvoří asi 20 % všech primárních zhoubných nádorů plic, u žen je o něco častější. Jeho procentuální zastoupení v posledních desetiletích celosvětově klesá. Příčina tohoto poklesu není zcela jasná, možná souvisí s poklesem prevalence kouření, protože asociace tohoto histologického typu s kouřením je velmi vysoká. Vyznačuje se rychlým a agresivním typem růstu, medián přežívání neléčených nemocných ve stadiu limitovaného onemocnění je 12 týdnů a 5–6 týdnů u extenzivního stadia (Zelen, 1973). Vyznačuje se však chemosenzitivitou a radiosenzitivitou.
Základní léčebnou modalitou je v současné době kombinovaná chemoterapie, kterou se dosáhne významného prodloužení přežívání nemocných s LD i ED. Indikace monoterapie jsou zcela výjimečné a v běžné klinické praxi se v první linii léčby nepoužívá. Vzhledem k časnému metastazování malobuněčného karcinomu je i u lokalizovaného onemocnění nutno předpokládat klinicky nedetekované vzdálené mikrometastázy a u všech stadií vždy použít systémovou léčbu. Standardní chemoterapeutické režimy u malobuněčného karcinomu:
- CAV – cyklofosfamid + doxorubicin (adriamycin) + vinkristin
- CDE (CAE) – cyklofosfamid + doxorubicin (adriamycin) + etopozid
- PE – cisplatina + etopozid
- CbPt + E – karboplatina + etopozid
- VIP – cisplatina + etopozid + ifosfamid
- ICE – karboplatina + etopozid + ifosfamid
Výběr chemoterapie
V současné době je nejvíce užívaná kombinace cisplatiny a etopozidu, která vzhledem k mechanismu účinku jeví určitý aditivní efekt obou léků. Tato kombinace je účinná i u nemocných, u nichž došlo k selhání léčby kombinacemi CAV a CAE. Její výhodou je i možnost použití v konkomitantní radiochemoterapii. protože je méně myelotoxická, její toxicita na sliznice je menší, stejně jako riziko vzniku intersticiální pneumonitidy. Při srovnávání účinnosti CAV a PE nebylo prokázáno významněji delší přežívání nemocných s ED (Fukuoka et al., 1991, Roth et al., 1992). Kombinace PE však má lepší terapeutický index. Při stejné protinádorové účinnosti je méně myelotoxická. Karboplatina v kombinaci s etopozidem má srovnatelnou protinádorovou účinnost s cisplatinou.Ve srovnání s cisplatinou má výhodu v menší nefrotoxicitě, ototoxicitě a neurotoxicitě, je méně emetogenní a její aplikace je snadnější. Je však více myelotoxická. Přidání ifosfamidu ke kombinaci platinového derivátu s etopozidem sice zvyšuje účinnost, ale za cenu výraznější toxicity U malobuněčného karcinomu byly zkoušeny léky 3. generace – gemcitabin, vinorelbin, paklitaxel a docetaxel, ale výsledky léčby těmito léky nebyly lepší než u starších léků, a tak jejich podávání v první linii chemoterapie není vhodné (Murray a Turrisi, 2006).
Operace a radioterapie
Vedle systémové chemoterapie hrají důležitou roli i další dvě klasické léčebné modality, radioterapie a chirurgická léčba. Operace prodlužuje přežívání u nemocných s periferní formou malobuněčného karcinomu plic v případě, že nejsou postiženy regionální lymfatické uzliny (stadium I), ale vždy musí být samozřejmě i v případě radikální resekce kombinována s chemoterapií. V tomto iniciálním stadiu se však zjistí malobuněčný karcinom jen vzácně. Při kombinaci operace a chemoterapie u stadia I je preferováno provedení resekce před zahájením cytostatické léčby. Zda u operovaných nemocných s následnou chemoterapií zlepší prognózu přidání radioterapie, není jasné.
V ostatních případech limitovaného onemocnění se chemoterapie kombinuje s radioterapií sekvenčně nebo konkomitantně. Konkomitantní radiochemoterapie – současné podávání chemoterapie i radioterapie – má sice vyšší toxicitu, hlavním typem toxicity je ezofagitida a hematologická toxicita, ale je účinnější a u malobuněčného karcinomu je dnes pokládána v kombinaci s režimem cisplatina + etopozid za standardní postup. Nejvhodnější je zahájení radioterapie při prvním nebo druhém chemoterapeutickém cyklu.
U nemocných vyššího věku nebo u nemocných, u kterých lze předpokládat sníženou toleranci léčby, je bezpečnější sekvenční podání chemoterapie s následnou radioterapií. U nemocných, u nichž se dosáhlo léčbou kompletní remise, je vhodné profylaktické ozáření mozku. Mozek je totiž nejčastějším místem relapsu a profylaktické ozáření snižuje frekvenci mozkových metastáz a mírně prodlužuje i celkové přežívání nemocných.

Léčba relapsu
I když citlivost dříve neléčených nemocných na chemoterapii je velmi dobrá, u většiny nemocných dojde k relapsu. Ty bývají terapeutickým problémem a příčinou úmrtí většiny nemocných během dvou let od stanovení diagnózy.
Úspěch 2. linie chemoterapie závisí na intervalu mezi ukončením léčby a relapsem a citlivostí na primární léčbu. U nemocných, u kterých bylo dosaženo objektivní léčebné odpovědi na první linii léčby a léčebná odpověď trvala nejméně tři měsíce, je možno očekávat u více než poloviny nemocných dosažení léčebné odpovědi i při použití stejného režimu, který byl podán v indukční léčbě. U nemocných, u kterých nebylo dosaženo léčebné odpovědi na první linii nebo k relapsu došlo dříve než za tři měsíce, je nutno podat jiný chemoterapeutický režim, ale i při změně složení chemoterapie bývají výsledky léčby druhé linie velmi skromné.
Příklady chemoterapeutických režimů pro refrakterní typ relapsu malobuněčného karcinomu
- PP – cisplatina + paklitaxel
- CbPt + P – karboplatina + paklitaxel
- topotekan v monoterapii
Léčba nemalobuněčného karcinomu
Nemalobuněčný karcinom je mnohem častější než malobuněčný typ,
jeho podíl představuje zhruba 80 %. Hlavní léčebnou modalitou,
která poskytuje nejvyšší šanci na dlouhodobější přežívání u
nemalobuněčného karcinomu plic, je chirurgická léčba. Většina
onemocnění je však diagnostikována až v pokročilém stadiu, kdy je
radikální chirurgická resekce nemožná. Dalším důvodem nízkého počtu
operovaných jsou přidružené nemoci. Za radikální operační výkon je
pokládána lobectomie a pneumonectomie, popřípadě vpravo
bilobectomie. Z menších „parenchym šetřících“ výkonů
(segmentectomie, klínovitá excize) mají nemocní v indikovaných
případech rovněž profit, ale vzhledem k vysokému počtu lokálních
recidiv se tyto výkony nepokládají za radikální léčebný
postup.
Radikální radioterapie prodlužuje přežívání nemocných bez
vzdálených metastáz a v paliativních indikacích zlepšuje kvalitu
života.
Chemoterapie má v komplexní léčbě nemalobuněčného karcinomu významné postavení, i když chemosenzitivita tohoto typu je podstatně nižší než u malobuněčného karcinomu. Všeobecně se v současnosti uznává, že by chemoterapeutický režim pro první linii měl obsahovat platinový derivát (cisplatinu nebo karboplatinu) v kombinaci s lékem 3. generace.
Přidání bevacizumabu k režimu karboplatina + paklitaxel zlepšuje léčebné výsledky chemoterapie prodloužením doby do progrese i celkovou dobu přežívání (Sandler A., 2006) a byl v srpnu 2007 pro tuto indikaci registrován v EU. U režimu cisplatina + gemcitabin, který je v Evropě více používán, přidání bevacizumabu rovněž zlepšuje léčebné výsledky prodloužením doby do progrese nemoci i zvyšuje pravděpodobnost dosažení objektivní léčebné odpovědi (Reck M. et al., 2007).
Některé chemoterapeutické režimy používané u nemalobuněčného karcinomu v první linii léčby:
- karboplatina + paklitaxel
- cisplatina + paklitaxel
- karboplatina + docetaxel
- cisplatina – docetaxel
- cisplatina + vinorelbin
- karboplatina + vinorelbin
- karboplatina + gemcitabin
- cisplatina + gemcitabin
Cytostatická léčba II. linie je podávána především s cílem symptomatické úlevy, i když je prokázáno u vhodně k chemoterapii indikovaných nemocných prodloužení přežití. Doporučená je monoterapie, vhodné léky v této indikaci jsou docetaxel nebo pemetrexed. V druhé nebo třetí linii je účinná cílená biologické léčba erlotinibem.
Základní zásady výběru vhodné léčebné strategie jsou uvedeny dále podle stadií: Stadium I
Chirurgická resekce je modalitou první volby pro nemocné s nemalobuněčným karcinomem plic v prvním klinickém stadiu. Standardní rozsah výkonu je lobectomie. Radioterapie je používána u nemocných nevhodných k chirurgickému výkonu. Výsledky radikální radioterapie, resp. délka přežívání, je u malých nádorů (T1) jen o málo horší než výsledky resekční léčby. Po radikální resekci u stadia IA není nutná žádná další terapie, u stadia IB mají nemocní mírně lepší prognózu při aplikaci adjuvantní chemoterapie.
Stadium II
Stejně jako v prvním klinickém stadiu je radikální operace modalitou první volby. Inoperabilní nemocní s dostatečnou dechovou rezervou jsou indikováni k radioterapii s kurativním záměrem. Stejně jako u stadia IB mají nemocní s adjuvantní chemoterapií mírně, ale statisticky signifi kantně, delší přežívání. Je proto nutné nemocným předpokládatelné výhody i očekávatelná rizika vysvětlit a podávat adjuvantní chemoterapii jen u nemocných, kde riziko léčby není zvýšené.
Stadium III A
Pokud je postižení mediastinálních uzlin stanoveno předoperačně jsou výsledky samostatné chirurgické léčby nedobré s pětiletým přežitím mezi 10–15 %. Pokud je postižení mediastinálních uzlin zjištěno až operací, je prognóza lepší, ale celkově je i u kompletně resekovaných nádorů stadia IIIA bez další terapie pětileté přežívání menší než 25 %. Většina relapsů je vzdálených, takže se dá předpokládat diseminaci již v době chirurgického výkonu.
U stadia IIIA bylo opakovaně prokázáno, že kombinace léčebných modalit přináší lepší léčebné výsledky než použití jediné léčebné modality. I v případech, kdy je kompletní resekce nádoru proveditelná, lze považovat samostatný chirurgický výkon při stadiu IIIA (N2) za neadekvátní (Bunn, 1999). Operace je kombinována s chemoterapií nebo chemoradioterapií. Samostatná pooperační radioterapie u kompletně resekovaného nádoru nemá pro nemocné prokázaný benefit. Lze o ní uvažovat v případech nekompletně resekovaného nádoru, ale i zde se nyní dává přednost chemoradioterapii.
Neoadjuvantní léčba
Aplikace neoadjuvantní léčby, tzn. podání chemoterapie před chirurgickým výkonem, ve studiích II etapy klinického zkoušení prokázala možnost prodloužení přežití při tomto postupu (Martini et al., 1988, Martini, 1993). Účinnost této strategie se zkoumala ve čtyřech studiích III etapy klinického zkoušení, ve kterých byla provedena randomizace nemocných mezi chirurgickým výkonem bez předoperační chemoterapie nebo s ní režimy obsahujícími cisplatinu. Ve třech studiích bylo zaznamenáno u nemocných s neoadjuvantní chemoterapií delší přežití v rameni s chemoterapií (Rosell et al., 1994, Roth et al., 1994), ačkoliv v jedné z nich rozdíl nedosáhnul statistické významnosti (Pass et al., 1992). Tato studie byla totiž předčasně ukončena po zařazení 28 nemocných pro nedostatečný nábor pacientů. I zbývající dvě studie byly kritizovány pro malé počty nemocných, protože byly z etických důvodů předčasně ukončeny, když průběžná analýza ukazovala jasnou výhodu neoadjuvantní chemoterapie. Nicméně se koncept neoadjuvantní chemoterapie v druhé polovině 90. let začal pokládat za standardní postup u nemocných ve stadiu IIIA. Zpochybnění výhodnosti neoadjuvantní léčby přinesly v později výsledky poslední studie fáze III. Tato francouzská studie randomizovala nemocné ve stadiu IB, II a IIIA k předoperační chemoterapii dvěma cykly kombinace MIP (mitomycin C + ifosfamid + cisplatina) nebo rovnou k operaci. V obou větvích byla použita pooperační radioterapie. Mediány doby přežívání (37 a 26 měsíců) ani tříleté přežívání nebyly statisticky významné (Depierre et al., 2002). I když vhodnost neoadjuvantní chemoterapie především u stadia IIIA nebyla zatím vyvrácena, je v současné praxi postupně opouštěna.
Další možný postup u klinického stadia IIIA je kombinace
chemoterapie a radioterapie před vlastním chirurgickým výkonem. U
tohoto trimodálního postupu je však nutno počítat s vyšší
morbiditou i mortalitou.
U nemocných s rozsáhlým postižením mediastinálních uzlin nebo
postižením nejvyšších mediastinálních uzlin nevhodných k
chirurgickému řešení se používá kombinace chemoterapie a
radioterapie.
Předoperační radioterapie se v současnosti používá jen u
Pancoastova nádoru, i zde je však účinnější chemoradioterapie.
Adjuvantní léčba
Postupný odklon od neoadjuvantní (předoperační) chemoterapie byl podmíněn v posledních letech publikovanými studiemi, prokazujícími přínos adjuvantní chemoterapie u kompletně resekovaného nádoru. Nejvýznamnější z publikovaných studií je zřejmě IALT (International Adjuvant Lung Cancer Trial) (Arriagada et al., 2004). Studie začala v roce 1995 a původně bylo plánováno zařazení 3 300 nemocných, ale pro pomalý nábor bylo rozhodnuto studii ukončit po randomizaci 1 867 nemocných. V této studii byli nemocní ve stadiu I, II nebo III randomizováni po kompletní resekci k observaci nebo k chemoterapii jedním ze čtyř chemoterapeutických režimů s cisplatinou (cisplatina + vindezin, cisplatina + vinblastin, cisplatina + etopozid nebo cisplatina + vinorelbin). Pooperační chemoterapie byla povolena podle institucionálních zvyklostí jednotlivých center. Primárním cílem studie byla doba přežívání. Pětileté přežívání bylo vyšší ve větvi s chemoterapií 44,5 % versus 40,4 % (p < 0,03), medián přežívání byl 50,8 versus 44,4 měsíce.
Stadium IIIB
Chirurgická léčba je indikována jen výjimečně, a pokud je indikována, je vždy kombinována s jinými léčebnými modalitami. O operaci lze uvažovat pokud se indukční chemoterapií nebo chemoradioterapií dosáhlo významného snížení stadia. Není však většími randomizovanými studiemi dostatečně doloženo, zda nemocní mají z tohoto postupu užitek, a tak je tento postup nutno pokládat za nestandardní nebo výzkumný.
Standardním postupem u stadia IIIB je kombinace chemoterapie a radioterapie. V současnosti nelze jednoznačně odpovědět na otázku, zda je z hlediska účinnosti a bezpečnosti léčby vhodnější sekvenční, nebo konkomitantní chemoradioterapie. V klinické praxi se používá sekvenční postup, chemoterapie s následnou radioterapií. Stále více studií ukazuje vyšší účinnost konkomitantní radiochemoterapie a lze předpokládat, že se brzy začne pokládat, podobně jako je tomu u malobuněčného karcinomu, konkomitantní radiochemoterapie za standardní postup.
Stadium IV
Chirurgická léčba se ve IV. stadiu neprovádí. Výjimku tvoří nemocní s radikálně resekabilní primární lokalizací nádoru (T1-2, N0-1) a s izolovanou metastázou v jediném orgánu – v mozku, nadledvině nebo plíci – a obě lokalizace (primární nádor a metastáza) je možno radikálně chirurgicky odstranit. Pokud je metastáza v jiných orgánech, chirurgická léčba není vhodná.
U nemocných s dobrým stavem výkonnosti (PS 0-1) je standardním postupem podání kombinované chemoterapie. U nemocných vyššího věku nebo u těch, u nichž by byla kombinovaná chemoterapie riziková, je možno podat monoterapii, případně zvážit léčbu cílenou biologickou léčbu erlotinibem. Hodnocení léčebné odpovědi se provádí po dvou cyklech a další pokračování se zvažuje podle efektu a tolerance.
Dlouhodobé přežívání nemocných se vzdálenými metastázami je zcela výjimečné. Léčebný záměr je vždy paliativní s individuálním léčebným přístupem. Vzhledem k tomu, že se jen u velmi malého počtu nemocných dosáhne léčbou dlouhodobého přežívání, je nutno při indikaci chemoterapie pečlivě zvažovat předpokládaný profit a rizika léčby, včetně vlivu léčby na kvalitu života. S nemocnými je nutno otázku léčby a její očekávatelné výsledky otevřeně prodiskutovat a respektovat jejich vztah k uvažované léčbě i individuální preference. U nemocných s generalizovaným nemalobuněčným karcinomem plic, u kterých by léčba byla sdružena se zvýšeným rizikem nebo u kterých není z různých důvodů předpoklad dobré spolupráce při léčbě, není v žádném případě neetické chemoterapii nepodávat. Literatura:
- ARRIAGADA, R., BERGMAN, B., DUNANT, A. et al. Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small cell lung cancer. N Engl J Med, 2004, 350, p. 351– 360
- Bunn P. A.: To treat or not to treat non-small-ell lung cancer patients? Current perspectives. Oncology, 13, 1999, dopl. 4, 9–15
- DEPIERRE, A., MILLERON, B., MORO-SIBILOT, D. et al. Preoperative chemotherapy followed by surgery compared with primary surgery in resectable stage I (except T1N0), II a IIIa non-small cell lung cancer. J Clin Oncol, 2002,20, p. 247–253
- Fukuoka M., Furuse K., Saijo N., Nishiwaki Y., Ikegami H., Tamura T., Shimoyama M., Suemasu K.: Randomized trial of Cyclophosphamide, Doxorubicin and Vincristine versus Cisplatin and Etoposide versus alternation of these regimens in small cell lung cancer. J. Natl. Cancer Inst., 83, 1991, 855–861
- Martini N., Kris M., Flehinger B. J., Gralla R. J., Bains M. S., Burt M. E., Heelan R., McCormack P. M., Pisters K. M., Rigas J. R.: Preoperative chemotherapy for stage IIIA (N2) lung cancer: Te Sloan Kettering expereince with 136 patients. Ann. Thorac. Surg., 35, 1993, 1365–374
- Martini N., Kris M.G., Gralla R.J.: The eff ect of pre-operative chemotherapy on the resectability of non-small-cell lung carcinoma with mediastinal node metastases. Ann. Thorac. Surg., 45, 1988, 370–379
- Mountain, C. F.: Revisions in the international system for staging lung cancer. Chest, 1997;111: 1710–17
- MURRAY, N., TURRISI, AT. A review of first-line treatment for small-cell lung cancer. J Thorac Oncol, 2006,1, p. 270–278
- Pass H. I., Pogrebniak H. W., Steinberg S. M., Mulshine J., Minna J.: Randomized trial of neoadjuvant therapy for lung cancer: Interim analysis. Ann. Thorac. Surg., 53, 1992, 992–998
- Rosell R., Gomez-Godina J., Comps J.: A randomized trial comparing preoperative chemotherapy plus surgery with surgery alone in patients with non-small cell lung cancer. N. Engl. J. Med., 330, 1994, 153–158
- Roth B. J., Johnson D. H., Einhorn L. H., Schacter L. P., Cherng N. C., Cohen H. J., Crawford J., Randolph J. A., Goodlow J. L., Broun G. O. et al.: Randomized study of Cyclophosphamide, Doxorubicin and Vincristine versus Etoposide and Cisplatin versus alternation of these two regimens in extensive small cell lung cancer: A phase III trial of the Southeastern Cancer Study Group. J. Clin. Oncol., 10, 1992, 282–291
- Roth J. A., Fossella F., Komaki R., Ryan M. B., Putnam J. B. Jr, Lee J. S., Dhingra H., De Caro L., Chasen M., McGavran M.: A andomized trial comparing preoperative chemotherapy and surgery with surgery alone in resectable non-small-cell-lung cancer. J. Natl. Canc. Inst., 86, 1994, 673–680
- Stahel R. A., Ginsberg R., Havemann K., Hirsch F. R., Ihde D. C., Jassem J., Karrer K., Maurer H., Osterlind K., Van Houtte P.: Staging and prognostic factors in small cell lung cancer: a consensus report. In: H. H. Hansen, Kristjansen P. E. G. (eds.).: Management of small cell lung cancer. Third IASLC Workshop on small cell lung cancer. Elsevier, Amsterdam, 1989, 1–8
- Travis W. D., Colby T. V., Corrin B., Shimosato Y., Brambilla E.: Histological typing of lung and pleural tumors. International histological classification of tumors. World Health Organisation, Third Edition, Springer, Berlin, Germany, 1999 ÚZIS. Novotvary 2004 ČR. Zdravotnická statistika, ÚZIS, Praha, 2007.
- Zelen M.: Keynote address on biostatistics and data retrival. Cancer Chemother. Rep., 4, 1973, část 3, 31–42
- Sandler A, Gray R, Perry MC et al: Paclitaxel-carboplatin alone or with bevacizumab for nonsmall- cell lung cancer. N Engl J Med 355: 2542–2550, 2006
- Reck M., von Pawel J., Zatloukal P., Ramlau R., Gorbounova V., Hirsh V., Leighl N., Mezger J., Archer V., Manegold C.: BO 17704: a phase III study of first-line cisplatin and gemcitabine with bevacizumab or placeboin patients with advanced or recurrent non-squamous nonsmall cell lung cancer (NSCLC). J. Thorac. Oncol., 2, 2007, No. 8, Suppl., S 360–361
Podpořeno výzkumným záměrem MZ00000064211
Datum přednesení příspěvku: 13. 11. 2008





