Konference: 2004 XXVIII. Brněnské onkologické dny a XVIII. Konference pro sestry a laboranty
Kategorie: Onkologická diagnostika
Téma: Molekulární a laboratorní diagnostika nádorů
Číslo abstraktu: 40
Autoři: prof. MUDr. Jindřich Fínek, Ph.D.; Doc. MUDr. Luboš Holubec (jr.), Ph.D., MBA; Prof. MUDr. Ondřej Topolčan, CSc.; MUDr. Sabina Svobodová; doc.MUDr. Ludmila Lipská, Ph.D.; M. Matoulek; Š. Svačina
Pro kontrolu efektu nádorové terapie využíváme nejrůznější zobrazovací metody (rentgenové ultrasonografické, izotopové či jejich kombinace. Tyto metody umožň ují posouzení léčebné odpovědi za předpokladu vhodné anatomické lokalizace nádoru. Změna nádorové masy musí být zároveň větší než je detekční limit metody. (1,7) Pomocí zobrazovacích metod však nelze zjistit přítomnost minimálního množství reziduální nádorové tkáně, a nelze jich tedy použít pro monitoraci efektu použité léčby. (2) Cílem naší studie bylo zjistit, jakým způsobem lze využít stanovení biologické aktivity nádoru k monitoraci účinku protinádorové terapie.
Metodika
Vyšetřili jsme nádorové markery před a po operaci u následujících souborů nemocných:
- soubor nemocných s kolorektálním karcinomem (n= 210) – CEA, CA 19-9, CA 72-4
- soubor nemocných s karcinomem prsu (n= 1184) – CA 15-3, CEA, TPA, TPS
- soubor nemocných s karcinomem ovárií (n=149) – CA 125, CA 72-4
U 30 nemocných s kolorektálním karcinomem, podstoupily chemoterapii (15 adjuvantních a 15 paliativních) jsme monitorovaly nádorové markery CEA, CA 19-9, TPA, TPS a TK před a po skončení cyklu chemoterapie.
Nádorové markery byly sledovány následujícími imunoanalytickými metodami: CEA– IRMA Immunotech, CA 72-4 a CA
19-9 Cis Biointernational, TPA– BykSangtec, TPS– Beki, TK– REA Immunotech, CA 15-3 MEIA Abbott, CA 15-3 IRMA. Statistické zpracování dat bylo provedeno pomocí programu SAS 6.12.
Výsledky
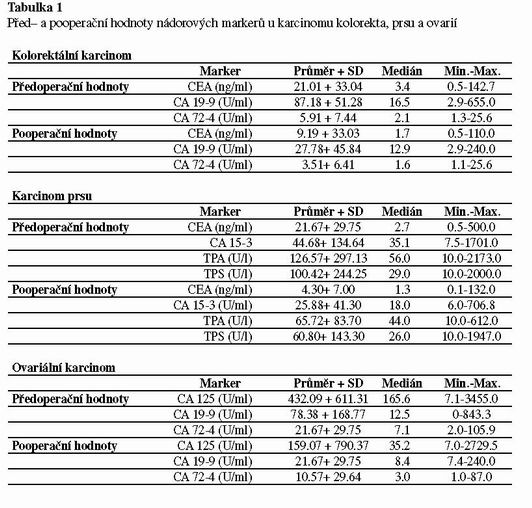
V tabulce 1 je vyhodnocení změn před– a pooperačních hodnot nádorových markerů u karcinomu kolorekta, prsu a ovaria. Z tabulky vyplývá, že po operaci dochází u všech tří lokalizací nádoru k poklesu hodnot nádorových markerů. Vzhledem k velkému rozptylu hodnot jsme se rozhodli v následujících tabulkách hodnotit pouze změny hladin nádorových markerů u nemocných, kteří měli předoperační hodnoty markerů vysoké. Při takto provedeném vyhodnocení byl rozdíl mezi před–a pooperačními hodnotami vysoce signifikantní (p<0.001), jak je ukázáno na příkladu kolorektálního karcinomu (viz tabulka 2). Senzitivita předoperačních hodnot výrazně stoupne, pokud je kalkulována pouze z hladin nádorových markerů, které byly před operací zvýšeny. Zde se senzitivita pro zhodnocení efektu operace blíží 90%.
Z tabulky 3 vyplývá vztah mezi výší předoperačních hodnot CEA a CA 19-9 a dva a půl letým přežitím u karcinomu kolorekta. Je zřejmé, že doba přežití závisela na výši předoperačních hodnot. Výraznější rozdíly byly pozorovány u CA 19-9 než u CEA.
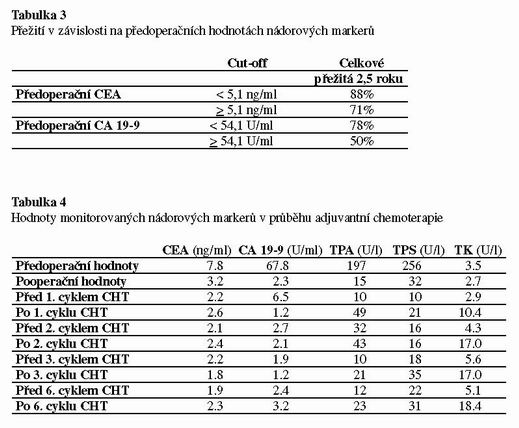
V klinické praxi je běžně prováděno sledování nádorových markerů v průběhu follow up, optimálně v tříměsíčních intervalech. Toto sledování je vhodné pro časný záchyt progrese onemocnění, ale není využíváno pro monitoraci účinku protinádorové léčby. EGTM doporučuje využívat nádorové markery pro hodnocení klnického průběhu onemocnění, tj. stanovení remise a progrese. Při terapii doporučuje stanovovat nádorové markery nejdříve za tři měsíce po jejím skončení a nikoliv v jejím průběhu. (3,8) V naší pilotní studii jsme sledovali nádorové markery v průběhu chemoterapie. Typické příklady chování jednotlivých nádorových markerů jsou v následujících tabulkách 4-6.
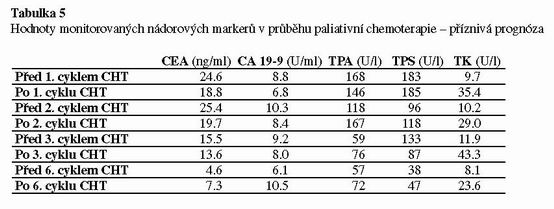
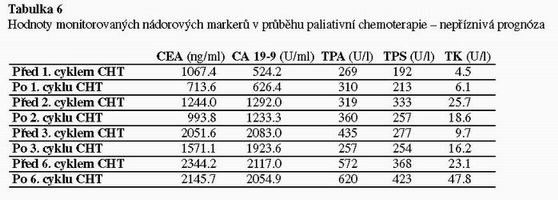
U adjuvantní léčby byla thymidinkináza jediným markerem, který vykazoval před– a po skončení cyklu chemoterapie signifikantní změny. Ostatní markery vykazovaly minimální variabilitu (viz. tabulka 4). Při paliativní léčbě změny nádorových markerů korelovaly s efektem léčby. Pokud byl efekt léčby příznivý, byly opět nejvýraznější změny u thymidinkinázy tak, jak tomu bylo u adjuvantní chemoterapie. Ostatní nádorové markery při úspěšné paliativní terapii pomalu klesaly (viz. tabulka 5). Signifikantní rozdíl byl prokazatelný mezi hodnotami před zahájením terapie a po posledním cyklu. Při nepříznivém průběhu paliativní terapie thymidinkináza postupně trvale stoupala. Hodnoty ostatních nádorových markerů zůstávaly vysoké a vykazovaly minimální variabilitu (viz tabulka 6).

Diskuse
Monitorace parametrů biologické aktivity nádoru je již delší používána v rutinní klinické praxi. Příkladem je stanovení aktivity estrogenních a progesteronových receptorů, které se nejprve stanovovaly v cytosolu nádorové buňky a nyní se rutinně stanovují pomocí imunohistochemických metod. (4) Znalost receptorové aktivity je u postmenopazálních i premenopauzálních pacientek s karcinomem prsu nezbytným předpokladem úspěšné hormonální terapie. Podobně se v posledních 5 letech ověřuje v praxi použitelnost imunoanalytického a imunohistochemického stanovení Her2– neu pro volbu a kontrolu terapie trastuzumabem. (5) Dále je možno posuzovat proliferační index pomocí proliferačních markerů (MIB-1, Ki 67 apod.). Tyto příklady demonstrují, že v rutinní praxi je imunohistochemických metod pro vyšetření biologické aktivity nádorové tkáně již několik let běžně používáno a je na nich závislá protinádorová léčba. Obdobnou využitelnost pro kontrolu efektu terapie lze v budoucnu očekávat i od vyšetření markerů biologické aktivity tumoru v biologických tekutinách. Z našich výsledků dynamiky nádorových markerů, které byly měřeny v průběhu chemoterapeutické léčby vyplývá, že již dnes je možno jejich monitorace využít k posouzení efektu chirurgické terapie a účinku podávané chemoterapie. Ke splnění tohoto cíle je však třeba dodržet několik základních podmínek:
- Standardizovat dobu a frekvenci odběru markerů
- Standardizovat preanalytiku, analytiku a způsob interpretace vybraných markerů biologické aktivity ve vztahu k cílené terapii
Další možnosti využití monitorace biologické aktivity nádoru spatřujeme především v korelaci změn dynamiky nádorových markerů ve vztahu k přesně definovaným změnám klinického stavu pacienta. Další perspektivou je využití parametrů biologické aktivity nádoru k monitoraci předpokládaného účinku protinádorové léčby. Příkladem může být monitorace VEGF u léků s antiagiogenním účinkem, sledování parametrů apoptózy u terapeutik, které apoptózu indukují, či sledování adhezivních molekul u léčby, která má buněčné adhezi zabránit. Tyto faktory bude možno sledovat v kombinaci s klasickými nádorovými markery, či tyto nové parametry nahradí v současné době používané markery. Stejně perpektivní se jeví využití metod molekulární biologie k posouzení rezistence a toxicity protinádorové léčby. Velké naděje jsou vkládány ve využití stanovení cirkulujících nádorových buněk pro posouzení klinického stavu a efektu terapie. (6)
Domníváme se, že naše výsledky přispějí k tomu, aby biologické aktivity nádoru bylo možno využít pro individualizaci a optimalizaci léčby – tzv. tailoring, což je termín charakterizující tzv.„šití terapie na míru“. (9)
Literatura
- De Vita VT., Vincent T., Hellman S., Rosenberg A: Cancer of the
Colon. In: Cancer: Principles Practise of Oncology. Lippincott –
Raven Publishers 1997, s. 1144-1182.
- Patz, EF: Principles of Imaging. In: Cancer Medicine, 6th ed.,
Kufe DW (ed.), BC Decker Inc. Hamilton. London, 2003,
pp.503-505.
- European Group on Tumor Markers: Consensus Recommendations.
Anticancer Research 19: 2785-2820, 1999.
- Jordan CV: Estrogens and Antiestrogens. In: Cancer Medicine,
6th ed., Kufe DW (ed.), BC Decker Inc. Hamilton. London,
2003, 939-947. - Penault-Llorca F, Cayre A, Bouchet Mishellany F, Amat S,
Feillel V, Le Bouedec G, Ferriere JP, De Latour M, Chollet P.
Induction chemotherapy for breast carcinoma: predictive markers and
relation with outcome. Int J Oncol 22(6):1319-25, 2003.
- Liu ET. Molecular oncodiagnostics: where we are and where we
need to go. J Clin Oncol. 21(11):2052-5, 2003.
- Bast, RC., Bates,S., Bredt,AB., et al.: Clinical practice
guidelines for the use of tunor markers in breast and colorectal
cancer. J Clin Oncol 14, 1996, s.2843-2877.
- Fleisher, M., et al. Practice Gudelines and Recomendations for
Use of Tumor Markers in the Clinic. Laboratory Medicine
Practice Guidelines 15: 5-56, 2002. - Beretta GD, Labianca R. Individual tailored chemotherapy. Suppl Tumori: 1(6):S25-7, 2002.
Práce byla podpořena grantem IGA MZ ČR NB/46635-3.
Datum přednesení příspěvku: 26. 5. 2004





