Konference: 2012 XXXVI. Brněnské onkologické dny a XXVI. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: 22. Základní a aplikovaný výzkum v onkologii
Číslo abstraktu: 202
Autoři: prof. MUDr. Zdeněk Kolář, CSc.; Mgr. Alena Tovaryšová; doc. Mgr. Jan Bouchal, Ph.D.; MUDr. Jana Chmelová; MUDr. Milan Král, Ph.D.; Prof. MUDr. Vladimír Študent, Ph.D.
Androgenový receptor (AR) je jaderným transkripčním faktorem, který zprostředkovává působení steroidních hormonů. Je nezbytný pro diferenciaci prostaty včetně exprese prostatických specifických genů jako jsou PSA a TMPRSS2, stejně jako pro udržení diferencovaného fenotypu prostatické žlázy. Většina karcinomů prostaty obsahuje fúzní geny s onkogenním potenciálem, které často zahrnují 5´ koncové elementy složené z androgeny regulovaných genů zfúzovaných s geny členů rodiny Ets transkripčních faktorů. Tato fúze vede k aberantní transkripci řízené androgeny. Mechanismy, kterými ke vzniku takových genových přestaveb dochází, byly doposud nejasné. Ukázalo se, že vlivem androgenové signalizace a s tím souvisejícím transkripčním stresem, mohou být indukovány zlomy DNA, které předurčují vznik přestavby typu TMPRSS2-ERG a to jak v nádorových tak i nenádorových buňkách prostaty (Bastus et al. 2010). Na spojení genů má pak přímý vliv přiblížení obnažených úseků DNA během „smyčkování“ (looping) chromatinu (Wu et al. 2011). Ke zlomům DNA přispívá enzym topoizomeráza 2B, která se účastní úprav DNA. Pro histopatologickou diagnostiku je velmi důležité to, že oproti normálnímu prostatickému epitelu byla v ložiscích PIN (prostatická intraepitelová neoplasie) zjištěna výrazně častější koexprese AR s topoizomerázou 2B (Haffner et al. 2010, Bartek et al. 2010). Nabízí se možnost tento fakt využít pro diagnostické i prediktivní účely. Fúzní gen TMPRSS2 bývá nalezen asi u 50 % CaP. ERG patří do skupiny ETS transkripčních faktorů, které se specificky váží ke genomu obsahujícím motiv GGA(A/T) a který je zvláště často obsažen ve vazebných místech pro AR. ERG přerušuje signální dráhu AR tím, že inhibuje jeho expresi, váže se na specifické genové lokusy inhibující jeho aktivitu a indukuje represivní epigenetické programy cestou přímé aktivace EZH2 (H3K27 metyltransferáza patřící do skupiny Polycomb proteinů). ERG také indukuje expresi metaloproteináz a genů zapojených do dráhy plasminogen aktivátoru. Fúzní gen TMPRSS2-ERG má zásadní význam pro nádorovou progresi tím, že narušuje v prostatě liniově specifickou buněčnou diferenciaci a potencuje dediferenciační program zprostředkovaný EZH2 (Yu et al. 2010). V nádorech s fúzním genem TMPRSS2-ERG bylo prokázáno zvýšené množství zlomů DNA v blízkosti otevřeného chromatinu, AR a ERG vazebných míst. Naopak snížení počtu zlomových míst bylo zjištěno v nádorech neobsahujících tento fúzní gen. Tato pozorování ukazují na vazbu mezi chromatinem nebo transkripční regulací a genezí genomových aberací (Berger et al. 2011). Existuje hypotéza, podle které přítomnost nebo absence fúzního genu rozděluje CaP na dvě molekulární skupiny, které mají jiný biologický potenciál a které mohou být léčeny rozdílným způsobem. V tomto směru se jeví jako velmi slibné použití anti-HDAC (trichostatinu), či antagonistů ERalfa a abirateronu acetátu (Fernandez-Serra et al. 2011).
Materiál a metody
Provedli jsme analýzu výskytu fúzního genu TMPRSS2-ERG, imunohistochemické exprese AR, TOPO2B a ERG v souboru 100 pacientů s diagnostikovaným karcinomem prostaty (CaP) ve vztahu k jejich klinicko-patologickým charakteristikám a stavu v ložiscích benigní prostatické hyperplasie (BPH).
Výsledky, diskuze a závěry
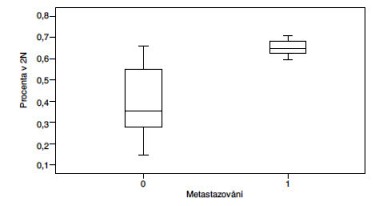
Prokázali jsme statisticky signifikantní přímou závislost mezi procentem buněk s přítomností fúzního genu TMPRSS2-ERG v CaP a metastazováním nádoru. Čím vyšší procento pozitivity, tím signifikantně častější výskyt metastáz (p=0,011) (Obr 1). Dále jsme prokázali sigifikantní přímou závislost mezi expresí AR, TOPO2B, ERG, výskytem fúzního genu TMPRSS2-ERG a prognostickými indikátory nádoru (Obr 2a-h). Naše výsledky částečně korelují s nálezy Minnera a spolupracovníků (2011), kteří u pacientů po prostatektomii a bez antihormonální terapie prokázali u pacientů expresi ERG u 52,4 % případů, souhlasný výsledek mezi expresí (IHC) a přestavbou (FISH) zjistili v 95 % případů. Neprokázali však signifikantní vztah mezi expresí ERG a klinickým průběhem či fenotypem nádoru.
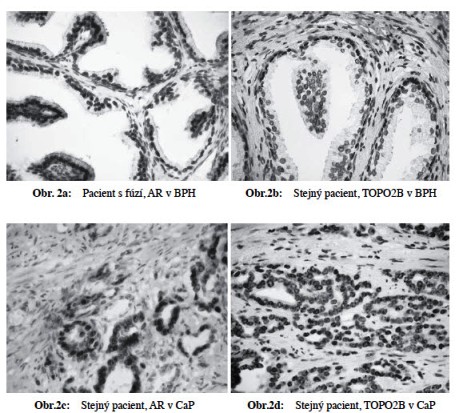
Naproti tomu v našem sledovaném souboru jsme nalezli signifikantní korelaci mezi procentem pozitivních buněk s přítomností fúze a metastatickým potenciálem nádoru. Dále citovaní autoři zjistili signifikantní rozdíly pro AMACR, anexin A3, Bcl-2, CD10, ALCAM, chromogranin A, EGFR, HER2, mTOR, p53 a synaptofysin. Největší signifikantní rozdíly byly zaznamenány pro AR, kde exprese AR byla výrazně vyšší v ERG pozitivních případech. Tento výsledek jsme v našem souboru potvrdili. Výrazné rozdíly v expresi AR mezi ERG+ a ERG- případy mohou znamenat, že oba typy nádoru budou rozdílně reagovat na hormonální blokádu. ERG je exprimován v buňkách CaP ve 20-100x vyšších koncentracích než v benigních tkáních a je schopen indukovat PIN. Ačkoliv nadměrná exprese tohoto genu je funkčně korelována s expresí AR, existuje řada AR negativních CaP, které tento gen exprimují. To může potvrdit domněnky, že při vzniku CaP je vznik fúzního genu časnou molekulární aberací.
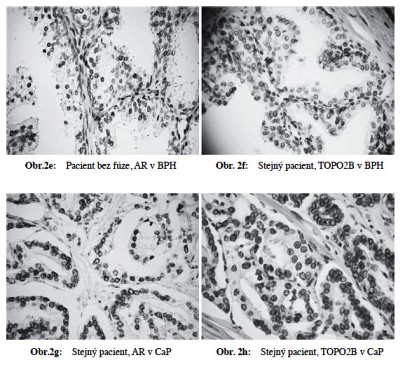
Detekce exprese tohoto genu se jeví jako velmi slibná diagnostická a prediktivní metoda. Poukazuje se také na možnou souvislost mezi schopností fúzního genu ovlivňovat zánět a funkčnost dráhy ovlivňované cyklooxygenázou-2 (COX-2), enzymu řídícího syntézu prostaglandinů. Existují práce, které prokazují schopnost prostaglandinů indukovat růst CaP, regulovat expresi urokinázového typu plasminogen aktivátoru (uPA) a přispívat tak k invazivitě nádorových buněk, angiogenezi a metastazování. V ERG pozitivních CaP byla zjištěna silně zvýšená exprese efektorů Wnt signální dráhy, kde zejména indukce FZD4 může vést ke vzniku fenotypu souvisejícího s vývojem EMT (epitelovo-mesenchymové transice) (Martin a Kyprianou 2011,Mohamed et al 2011). Výsledky potvrzují, že detekce fúzního genu, stejně jako současné imunohistochemické vyšetření exprese tří proteinů účastnících se androgeny regulované signální dráhy může být přínosné pro odhad biologického chování nádoru i určení nejvhodnějšího způsobu léčby.
Literatura
- Wu D, Zhang C, Shen Y, Nephew K, Wang Q: Androgen receptor-driven chromatin looping in prostate cancer. Trends in Endocrinology and Metabolism (2011): Epub ahead of print.
- Haffner MC, Aryee MJ, Toubaji A, Esopi DM, Albadine R, Gurel B, Isaacs WB, Bova GS, Liu W, Xu J, Meeker AK, Netto G, DeMarzo AM, Nelson WG, Yegnasubramanian S: Androgen-induced TOP2B-mediated double-strand breaks and prostate cancer rearrangements. Nat. Genet. (2010): 42, 668-675.
- Bartek J, Hamerlik P, Lukas J: On the origin of prostate fusion oncogenes. Nat. Genet. (2010): 42, 647-648.
- Bastus NC, Boyd LK, Mao X, Stankiewicz E, Kudahetti SC, Oliver RT, Berney DM, Lu YJ: Androgen-induced TMPRSS2:ERG fusion in nonmalignant prostate epithelial cells. Cancer Res. (2010):70, 9544-9548.
- Yu J,Yu J, Mani R-S, Cao Q, Brenner CJ, Cao X, Wang X, Wu L, Li J, Hu M, Gong Y, Cheng H, Laxman B, Vellaichamy A, Shankar S, Li Y, Dhanasekaran SM, Morey R, Barrette T, Lonigro RJ, Tomlins SA, Varamballa S, Qin ZS, Chinnaiyan AM:An integrated network of androgen receptor, polycomb, and TMPRSS2-ERG gene fusions in prostate cancer progression. Cancer Cell (2010): 17, 443-454.
- Berger MF, Lawrence MS, Demichelis F, Drier Y, Cibulskis K, Sivachenko AY, Sboner A, Esgueva R. Pflueger D, Sougnez C, Onofrio R, Carter SL, Park K, Habegger L, Ambrogio L, Fennell T, Parkin M, Saksena G, Voet D, Ramos AH, Pugh TJ, Wilkinson J, Fisher S, Winckler W, Mahan S, Ardlie K, Baldwin J, Simons JW, Kitabayashi N, MacDonald TY, Chin L, Gabriel SB, Gerstein MB, Golub TR, Meyerson M, Tewari A, Lander ES, Getz G, Rubin MA, Garraway LA: The genomic complexity of primary human prostate cancer. Nature (2011): 470, 214-220.
- Fernandez-Serra A, Rubio-Briones J, Garcia-Casado Z, Solsona E, Lopez-Guerrero JA: Prostate cancer: The revolution of the fusion genes. Actas Urol. Esp. (2011): 35, 420-42.
- Minner S, Enodien M, Sirma H, Luebke AM, Krohn A, Mayer PS, Simon R, Tennstedt P, Muller J, Scholz L, Brase JC, Liu AY, Schluter H, Pantel K, Schumacher U, Bokemeyer C, Steuber T, Graefen M, Sauter G, Schlomm T: ERG status is unrelated to PSA recurrence in radically operated prostate cancer in the absence of antihormonal therapy. Clin. Cancer Res. (2011):17, 5878-5888.
- Martin SK, Kyprianou N: Gene fusions find an ERG-way to tumor inflammation. Cancer Biol. Therap. (2011): 11, 418-420.
- Mohamed AA, Tan S-H, Sun C, Shaheduzzaman S, Hu Y, Petrovics G, Chen Y, Sesterhenn IA, Li H, Sreenath T, McLeod DG, Dobi A, Srivastava S: ERG oncogene modulates prostaglandin signaling in prostate cancer cells. Cancer Biol. Therap. (2011):11, 410-417.
Datum přednesení příspěvku: 20. 4. 2012





