Konference: 2004 XXVIII. Brněnské onkologické dny a XVIII. Konference pro sestry a laboranty
Kategorie: Kasuistiky; zhoubné nádory mozku a CNS
Téma: Kasuistiky
Číslo abstraktu: 210
Autoři: prof. MUDr. Zdeněk Novák, CSc.; MUDr. Jan Chrastina, Ph.D.; MUDr. Eva Lžičařová; J. Buček; MUDr. Marta Pažourková; prof. MUDr. Milan Brázdil, Ph.D.; Doc. MUDr. Robert Kuba, Ph.D.; Prof. MUDr. Radim Jančálek, Ph.D., MBA
Úvod
Komplexní histologická diagnostika je součástí programu operačního
řešení pacientů s farmakoresistentní epilepsií na neurochirurgické
klinice od r.1996 v rámci Centra pro epilepsii při I. neurologické
klinice FN U sv. Anny v Brně, vedeného prof. Rektorem. Výsledkem
tohoto detailního vyšetření je plejáda patologií kongenitálních i
získaných, změn cévních, gliotických, malformací kortexu, jeho
uspořádání a stratifikace, včetně nálezu tumorosních procesů.
Pokroky v zobrazovací technice, především pak vysokorozlišovací MRI
vyšetření, prokazují strukturální patologii až u 95% nemocných
(Elger). fMRI zabezpečuje identifikaci funkčně významného kortexu,
v budoucnosti pak MRI spektroskopie může přinést přímé
neurochemické informace, které snad umožní korelaci se specifickou
histopatologií. PET prokazuje regionální hypometabolismus nebo
hypermetabolismus u proliferujících tumorů. Ovšem pro další terapii
je rozhodující biologická povaha sledovaného verifikovaného
patologického procesu. Většina intrinsických tumorů mozku spojených
s farmakoresistentní epilepsií je indolentních a nízkého gradingu
(například pilocytický astrocytom, DNT, gangliogliom). Záchvaty
jsou primárním projevem u 90% pacientů s gangliogliomem, stejně
jako u DNT a pilocytického astrocytomu.
Ovšem i astrocytomy nebo oligodendrogliomy jsou spojeny s dlouhou
anamnesou farmakoresistentní epilepsie (50 – 75% nemocných), ale v
těchto případech mohou být přítomny změny spojené s
malignizací.Vlastní výkon je tedy determinován jednak požadavky
epileptochirurgickými – resekce epileptogenního ložiska, ale i
nutností řešení tumorosní lese, včetně eventuální komplexní
následné terapie (1). Dalším problémem zůstává duální patologie a
vztah k procesu epileptogenese u jednotlivých MRI verifikovaných
lézí.
V našem sdělení presentujeme soubor nemocných, operovaných v letech
1996 – 2004 pro farmakoresistentní epilepsii temporálního laloku
při histologicky verifikovaném low grade tumoru z pohledu
neurochirurga, epileptologa a onkologa.
Soubor pacientů a výsledky operační léčby
Všichni pacienti byli do programu chirurgické léčby
farmakoresistentní epilepsie zařazeni na základě rozhodnutí
indikační komise Centra po detailním došetření nejmodernějšímimi
zobrazovacími technikami, vyšetření elektroencefalografickém,
včetně invazivního EEG (hluboké nebo subdurální elektrody) a
neuropsychologické studii zahrnující v indikovaných případech i
Wada test (brietalová deprivace). Resekční výkon byl indikován a
naplánován na základě syntézy uvedených výsledku včetně
předoperačního navigačního plánování s maximálním respektováním
bezpečnosti nemocného. Rozsah resekce byl určen předoperačně a
upřesněn na základě peroperačního nálezu – makroskopická
konfigurace temporálního laloku, arteriální zásobení, žilní drenaž,
vztah organické léze k funkčním oblastem, verifikovaným Wada testem
a fMRI. Interiktální PET byl indikován jednak k analýze biologické
aktivity patologického procesu, ale i stanovení zony
hypometabolismu, korelující s epileptogenní oblastí. V průběhu
operační intervence byly odebírány vzorky z definovaných oblasti
temporálního neokortexu, hlubokých struktur temporálního laloku a
amygdalohippokampálního komplexu. Byla využívána předoperační frame
based navigace a obraz byl aktualizován operačním mikroskopem a
peroperační kortikografií. Přehled výsledků histologického
vyšetření, shrnutý neuropatologem do finální diagnozy, ukazuje
tabulka č.1.
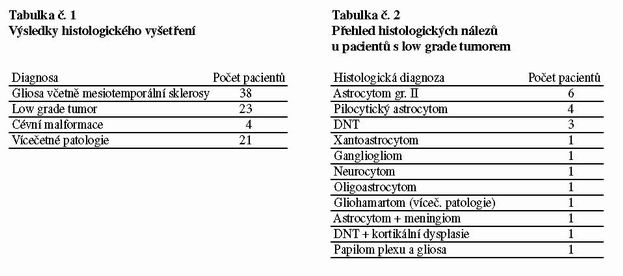
Jako izolované procesy i v rámci duálních, resp. vícečetných
patologií byly tumorosní lese identifikovány u 26 pacientů. Jejich
přehled shrnuje tabulka č. 2.
Z hlediska věkových parametrů byl průměrný věk v době operace u
pacientů s tumorosní lesí 28,3 let a délka trvání záchvatů do
operace 11,3 let, ve srovnání s celým souborem ostatních pacientů,
kde tyto parametry jsou 30,7 let jako průměrný věk v době řešení a
doba trvání záchvatů 18,0 let. U pacientů s histologicky
verifikovanými gliotickými změnami byl průměrný věk 27,5 let a doba
trvání záchvatů 17,2 let. Zajímavé je srovnání z hlediska
epileptochirurgického výsledku. V celém souboru nemocných
operovaných prop farmakoresistentní epilepsii temporálního laloku
bylo velmi dobrých výsledku dosaženo u 84,6% pacientů (stupně I a
II podle Engela – bez záchvatů nebo pouze aury), a v souboru
pacientů s tumorosními lesemi bylo dosaženo 90% úspěšných
výsledků.Přechodný neurologický deficit byl pozorován u 6%
pacientů. Jediný nemocný s histologicky verifikovaným fibrilárním
astrocytomem temporálního T laloku zemřel na progresi difusně
rostoucího tumoru i přes úplnou eliminaci záchvatů a absolvovanou
komplexní onkologickou léčbu. U jedné nemocné reoperované pro
progresi epileptických záchvatů byl i při negativním MRI vyšetření
z jiného pracoviště verifikovaný fibrilární astrocytom, stejně jako
při primární operaci, provedené mimo epileptochirurgický program
Epileptochirurgický zákrok přinesl velmi příznivý efekt z hlediska
redukce záchvatů. V dalším procesu je nemocný prezentován na
schůzce onkologické komise FN u sv. Anny (neurochirurg, onkolog,
neurolog, neuroradiolog, neuropatolog), kdy je s přihlédnutím k
histologickému nálezu a rozsahu resekce rozhodnuto o dalším
terapeutickém postupu. Nemocný zůstává ve sledování epileptologa,
ale i v trvalé onkologické dispenzarizaci.
Diskuse
Počátek záchvatového onemocnění je v souboru pacientů s low grade
gliomem dán přibližně 17 lety věku a doba trvání záchvatů od
diagnozy po operaci dosahuje v průměru 11 let. Ve srovnání s
epilepsií při gliotickém postižení je tento začátek v pozdějším
věku, navíc u pacientů s mesiotemporální epilepsií je anamnestický
průběh obvykle odlišný – je zde přítomna bezzáchvatová perioda po
iniciálních febrilních křečích. Z obecného hlediska doba přežití u
pacientů s histologicky verifikovaným gliomem závisí mimo jiné na
gradingu lese. Průměrná doba přežití je tak u pacientů s tumorem GI
– II 4,1 – 9,2 let (1). Faktory, positivně ovlivň ující dobu
přežití po operační intervenci jsou věk méně než 40 let, iniciální
manifestace epileptickým syndromem, Karnofsky skore vyšší než 70 a
nepřítomnost kontrastního enhancementu na CT nebo MRI (2). K
hodnocení biologické aktivity tumoru mimo výše zmiň ovaného
gradingu dle WHO lze použít například techniky SPECT (201
thallium),nebo BUdR index positivních buněk, lišící se významně dle
doby přežití Zvláště pak v indikacích reoperací přináší další
informaci k rozhodnutí výsledek PET, především u gliomů vyššího
gradingu, předpokládané maligní transformaci, a nebo diferenciální
diagnoze postiradiačních změn. Progrese iniciálně low grade gliomu
do vyššího gradingu je popisována u 9,2–45% pacientů (3). V
iniciální fázi růstu tumorozní uzel zůstává po dlouhou dobu omezen
na místo vlastního počátku růstu. Popisována je tendence gliomů
vznikat a růst v bílé hmotě pod homotypickým izokortexem, v
limbickém a paralimbickém systému, a dále pak v oblasti nucleus
caudatus, thalamu, hypothalamu a kmeni. Je možno upozornit na
skutečnost, že růst tumorosního procesu je omezen fylogeneticky
příbuznými strukturami než dosáhne velmi pokročilých fází.V případě
mesiotemporálních struktur tak zůstává limitace růstu v oblasti
fylogeneticky starších struktur, což jistě ovlivň uje biologické
chování lese (4). Způsob růstu je základem klasifikace dle Daumas
Duportové (I – solidní tumorosní uzel bez infiltrace okolního
parenchymu, II – tumorosní kompaktní uzel s infiltrací okolního
mozku, III není solidní tumorosní uzel, pouze funkční parenchym
infiltrovaný tumorosními buňkami).
Důležitá je lokalizace vlastní léze jak z hlediska výše uvedených
skutečností, tak i vzhledem ke faktu že léze v temporální krajině
jsou častěji spojeny s farmakoresistentní epilepsií než procesy
extratemporální.Na hranici tumorosních lézí a kongenitální
patologie zůstávají DNT, popsané rovněž skupinou Daumas Duportová,
které jsou častou příčinou farmakoresistentní epilepsie. Oproti
původním kasuistickým sdělením jejich záchyt narůstá s kvalitou
předoperačního vyšetření a počty chirurgicky řešených pacientů s
farmakoresistentní epilepsií, jak potvrzuje i náš soubor.
Exaktní mechanismus epileptogenicity tumoru je zatím neznámý,
ačkoliv bylo navržena řada elektrofysiologických a
patofysiologických teorií. Předpokládají se změny hladin
neurotransmitterů (zvláště GABA a somatostatin), dále pak tvorba
volných radikálů a porucha funkce na úrovni second messengeru.
Obecně je přijímáno, že záchvaty nevycházejí z vlastní léze, ale z
oblasti irritovaného kortexu v blízkosti ohraničené léze nebo z
přechodové infiltrativní zony růstu astrocytomu a
oligodendrogliomu. Dalšími změnami jsou vaskulární patologie,
ztráta neuronů, gliální proliferace a subkortikální dekonexe. Možná
je tudíž alternativa, že lese identifikovatelná pomocí
zobrazovacích technik může působit epileptickou aktivitu v jiných,
vzdálených oblastech kortexu s vytvořením epileptogenního ložiska.
Toto pak vede k nutnosti rozsáhlého došetření. roblematika rozsahu
nutného resekčního výkonu, tj. zdali postačuje lesionektomie, v
daném případě resekce tumoru, nebo zda je nutno resekci rozšířit k
dokonalému vyřazení epileptogenního ložiska, lokalizovaného v
neokortikálních nebo mesiotemporálních strukturách, je řešena
individuálně po zhodnocení dostupných výsledků v rámci indikační
komise centra. Literární údaje jsou z tohoto hlediska rozporné.
Někteří autoři poukazují na dostatečný efekt prosté lesionektomie
ke kontrole epileptických záchvatů (5) dokonce včetně průkazu
vymizení patologické EEG aktivity ve vzdálené vlastní epileptogenní
oblasti (6). Sdělení Cascina a kol. poukazuje na dobré výsledky
stereotaktické lesionectomie z hlediska kontroly záchvatů (7),
dokonce i pro extratemporální epilepsie.
Jiné práce poukazují na lepší efekt rozšířené lesionektomie ať již
s využitím stereoencefalografického vyšetření nebo peroperační
kortikografie (8). Koncept kindlingu (rozněcování) je popsán na
zvířecích modelech, ale méně v podmínkách klinické epileptologie.
Existuje shoda v názoru, že tvorba nezávislých epileptogenních
fokusů je méně pravděpodobná u malých ohraničených lézí než u
difusní patologie, ať již cévní, úrazové nebo tumorosní.(9) Díky
pokrokům v zobrazovací technice narůstá nejen záchyt kauzativní
léze u pacientů s farmakoresistentní epilepsií, ale nové
zobrazovací modality umožň ují neinvazivní sledování v období po
operaci. Je nutné podtrhnout úlohu PET v detekci recidiv maligních
tumorů, ale i malignizace iniciálně benigních lézí, stejně tak i
MRI spektroskopie s vyhlídkou zpřesnění diferenciální
diagnostiky.
Závěry
Farmakoresistentní epilepsie je poměrně častou manifestací
mozkového tumoru. Komplexní řešení vyžaduje spolupráci jak v
předoperační fázi, tak peroperačně a v následné pooperační péči a
sledování. Nezastupitelný je v tomto ohledu klinický onkolog. U
pacientů s farmakoresistentní epilepsií je možno dosáhnout
dlouhodobého příznivého výsledku z hlediska r kontroly záchvatů a
růstu tumoru. Především v mezních diferenciálně diagnostických
situacích je nutno zdůraznit úlohu zkušeného neuropatologa.
Sedmileté zkušenosti s neurochirurgickou léčbou farmakoresistentní
epilepsie ukazují na nutnost vyšetřování těchto nemocných
dosažitelnými neinvazivními metodami před operací. Upřesnění
patologického procesu histologickým vyšetřením se ukazuje jako
nezbytné pro komplexní léčbu. Interdisciplinární spolupráce
epileptologa, neurochirurga, neuropatologa, ale také neuroradiologa
přináší nový pohled na léčbu farmakoresistentní epilepsie.
Literatura
- Johansen TB, Langmark F., Lote K J. A progress in long term survival in adult patients with supratentorial low grade gliomas: a population based study of 973 patients. Neurosurg, 2003 Nov:99 (5):854-62
- Baumann G., Lote K, Larson D et al. Int J Radiat Oncol Biol Phys. Pretreatment factors predict overall survival for patients with low grade glioma: a recursive partitioning analysis. Int J Radiat Oncol Biol Phys. 1999 Nov 1:45(4):923-9
- Oriuchi N, Tamura M, Shibazaki T,et al. Clinical evaluation of thallium – 201 SPECT in supratentorial gliomas. relationship to histological grade, J Nucl Med.1993 Dec:34 (12) 2089-2090
- Goldring S, Rich KM, Picker S: Experience with gliomas in patients presenting with a chronic seizure disorder Clin. Neurosurg 1984:33:43-56
- Falconer MA, Serafenitides EA: A follow up study of surgery in temporal lobe epilepsy. J Neurol Neurosurg Psychiatry 1963:26:154-161
- Cascino GD, Kelly PJ, Hirchkorn KA, March WR., Sharbrough FW. Stereotactic resection of intraaxial cerebral lesions in partial epilepsy Mayo Clin Proc 1990:65:1053-1060
- Spencer DD, Spencer SS, Mattson RH et al.: Intracerebral masses in patients with intractable partial epilepsy. Neurology 1984:34:342-349
- Morrell F: Secondary epileptogenesis in man Arch.Neurol 1985:42:318-325
Datum přednesení příspěvku: 26. 5. 2004





