Konference: 2010 XXXIV. Brněnské onkologické dny a XXIV. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: Postery
Číslo abstraktu: 238p
Autoři: Doc. PharmDr. Petr Babula, Ph.D.; PharmDr. Ján Vančo, Ph.D.; RNDr. Veronika Kohoutková; prof. RNDr. Marie Stiborová, DrSc.; prof. MUDr. Tomáš Eckschlager, CSc.; MUDr. Lucia Trnková; doc.Ing. René Kizek, Ph.D.
Naftochinony představují v přírodě méně rozšířené sekundární metabolity, vznikající v několika různých biosyntetických cestách v závislosti na konkrétním naftochinonu. Nejčastěji se jedná o jednoduché deriváty 1,4-naftochinonu (juglon, lawson, plumbagin), jsou známy také formy dimerní a trimerní, stejně jako složitě substituované naftochinony. Naftochinony byly nalezeny u zástupců řady rostlinných čeledí, stejně jako u mikroorganismů a hub (Babula et al.; Babula et al.). V buňkách jsou deponovány ve vakuolách, kde jsou rozpuštěny (ve formě glykosidů) (Duroux et al.). Naftochinony představují látky s velmi zajímavým, a také širokým spektrem účinků. Mezi nejvýznamnější patří vlastnosti cytotoxické, antimikrobiální, antivirální, antifun-gální, antiparazitální a insekticidní. Některé naftochinony plní nezastupitelnou úlohu fyziologickou a biochemickou - jedná se o vitamíny skupiny K, strukturální analoga 1,4-naftochinonu substituované izoprenovým řetězcem různé délky (Damon et al.).
Významnou vlastností naftochinonů je jejich cytotoxicita. Ta je založena na několika paralelně probíhajících mechanizmech, mezi které patří generování reaktivních forem kyslíku poškozujících veškeré biomolekuly, aktivace proapoptických a down-regu-lace antiapoptických genů vedoucích v případě živočišných buněk k apoptóze, stejně jako interakce s biosyntézou nukleových kyselin, inhibice topoizomeráz i interakce s vlastní DNA, zejména interkalace (Babula et al.; Kiran Aithal et al.). Zajímavou možnost modifikace biologických účinků naftochinonů představuje příprava jejich derivátů a komplexů, jak již bylo prokázáno v případě dalších sekundárních metabolitů, ale také vlastních naftochinonů (Hashem et al.; Hernandez-Molina et al.; Chang et al.; Kelkar et al.; Kumbhar et al.). Zajímavou možnost obměny a vystupňování biologických účinků představuje příprava komplexů sekundárních metabolitů s ionty těžkých kovů. Jako zajímavé se jeví komplexy kvercetinu s mědnatými ionty, které vykazují schopnost přímé interakce s DNA a potažmo tedy výrazné cytotoxické vlastnosti (Tan et al.). Z tohoto důvodu byly tedy zcela nově připraveny různé komplexy naftochinonu lawsonu (2-hydroxy-1,4-naftochinon) s mědí, které byly dále charakterizovány z pohledu jejich biologických aktivit. Pro prescreeningové studie, stejně jako studie fytotoxicity, je velmi vhodná buněčná suspenzní kultura tabáku BY-2, přirovnávaná k HeLa buňkám (Nagata et al.). Výsledky získané pomocí této buněčné kultury vykazují v řadě ohledů korelaci s výsledky získanými na buňkách živočišných, nenádorových i nádorových (Babula et al.; Babula et al.; Smejkal et al.). Cílem předložené práce je tedy studium cytotoxicity jednoho z komplexů lawsonu a mědi (jako Cu2+) na modelové buněčné suspenzní kultuře BY-2.
EXPERIMENTÁLNÍ ČÁST
Materiál a metody
Chemikálie
Pro syntézu komplexů byl použit lawson (Law,
2-hydroxy-1,4-naftochinon), octan měďnatý, resp. jeho monohydrát
((CH3COO)2Cu.H2O), a další
chemikálie p. a. čistoty (Sigma-Aldrich, St. Louis, USA). Pro
vlastní experiment - testovaní cytotoxicity - byl vybrán
nejjednodušší komplex složení
Cu(Law)2(H2O)2.1/2H2O
(sumárně C20H15CuO85, Mr = 454,89,
rozpustnost H2O, ethanol, dimethysulfoxid - DMSO), který
byl připraven na ÚCHL FaF VFU Brno. Jeho složení a stabilita byla
ověřena elementární analýzou a metodami spektrálními. Příprava
tohoto komplexu, stejně jako komplexů dalších, bude popsána v jiné
publikaci.
Rostlinný materiál
Pro testování cytotoxicity byl použit rostlinný
buněčný model - buněčná suspenzní kultura Nicotiana tabacum cv.
Bright Yellow-2 (BY-2), kultivovaná v tekutém MS kultivačním médiu
(Murashige and Skoog) modifikovaném dle Nagaty (Nagata et al.).
Buněčná suspenzní kultura byla kultivována při 27 °C ve tmě na
třepačce (Kuhner Shaker LT-W, Adolf Kuhner AG, Švýcarsko) při 130
rpm. Testovaný komplex lawsonu ve formě zásobního roztoku (DMSO, 1
mg.ml-1), stejně jako měďnaté ionty (jako octan
-(CH3COO)2Cu.H2O; H20,
1 mg.ml-1) a lawson (DMSO, 1 mg.ml-1), byl
aplikován k buněčné kultuře v exponenciální fázi růstu, a to ve
finálních koncentracích 0, 50, 100, 250, 500, 750 a 1000 μM a
triplikátech. Jako další kontrola byl použit DMSO v koncentraci 0.5
% (v/v). Vzorky byly odebírány v časových intervalech 12, 24, 48 a
72 hodin.
Stanovení viability a další cytologická
vyhodnocení
Životnost - viabilita - byla stanovena
mikroskopicky za použití dvojitého fluorescenčního barvení pomocí
fluorescein diacetátu (FDA) a propidium jodidu (PI), oba
Sigma-Aldrich (Sigma-Aldrich, St. Louis, USA). Princip stanovení
viability je založen na rozkladu FDA na vlastní fluorigenní
substrát esterázami živých buněk a penetraci PI buněčnou stěnou a
porušenou plazmatickou membánou buněk mrtvých s následnou DNA
interkalací. Sterilně odebraný vzorek (25 µl) byl doplněn
kultivačním médiem na objem 50 µl a kultivován po dobu 5 min s FDA
(2.4 µmol.l-1) a PI (30 µmol.l-1). Počet živých a mrtvých buněk byl
vyhodnocen pomocí fluorescenčního mikroskopu (Olympus AX 70) se
širokopásmovou UV excitací, vlastní viabilita byla stanovena jako
podíl buněk živých ke všem buňkám. Od každé experimentální varianty
bylo vyhodnoceno 10 náhodných polí, a to v triplikátu. Jaderná
architektura, stejně jako mitotický index, byla hodnocena pomocí
fluorescenčního barviva Hoechst 33258. Ve stručnosti: vzorek (500
µl) byl smíchán s PEM pufrem obsahujícím formaldehyd (4 %, w/w)
(500 µl). Od každé experimentální varianty bylo vyhodnoceno tisíc
jader, a to pomocí fluorescenční mikroskopie (Olympus AX70,
širokopásmová UV excitace). Jaderné změny, stejně jako mitotický
index, byly vyjádřeny procentuálně.
VÝSLEDKY A DISKUSE
Morfologické změny a viabilita
Aplikace všech tří látek, tj. komplexu
Cu(Law)2(H2O)2.1/2H2O,
měďnatých iontů i lawsonu, vedla ke změnám v morfologii buněk
buněčné suspenzní kultury BY-2. Pro sledování viability, stejně
jako buněčné struktury, byly použity FDA a PI. Kontrolní buňky se
vyznačovaly přítomností několika vakuol, dobře patrných jader a
ohraničených provazců cytoplazmy oddělujících jednotlivé vakuoly. V
případě komplexu, spolu s klesající viabilitou byly patrné výrazné
změny v buněčné struktuře, zejména nejasné ohraničení vakuol, jader
a provazců cytoplazmy, stejně jako difúzní probarvení celé buňky
degradačním produktem FDA -fluoresceinem, což naznačuje
pravděpodobnou schopnost komplexu ovlivňovat permeabilitu
biomembrán, a tím vyvolávat zánik buněk (obr. 1). Tyto změny
korelovaly s koncentrací komplexu, ale nebyly patrné v případě
měďnatých iontů a lawsonu. Nejvíce cytotoxický byl komplex, nejméně
naopak měďnaté ionty (obr. 2). Pokles viability o více jak 80 % v
případě nejvyšších koncentrací, tj. 500 a 1000 µM, a to již po 12
hodinách kultivace, svědčí o schopnosti komplexu vyvolávat rychlý
zánik buněk, tedy interagovat a porušovat permeabilitu biomembrán,
případně interferovat s buněčným energetickým metabolizmem, jak
bylo zjištěno v případě některých naftochinonů.
Mitotický index
Všechny testované látky byly k buněčné suspenzní
kultuře BY-2 aplikovány v exponenciální fázi růstu, kdy mitotický
index, tj. procento dělících se buněk, dosahoval 6 %. Aplikace
všech látek vedla ke snížení mitotického indexu, v případě
nejvyšších aplikovaných koncentrací pod 1 %. Pokles mitotické
aktivity byl nejvýraznější v případě komplexu, kdy byla zjištěna
rovněž kumulace buněk v anafázi, nejméně výrazný naopak v případě
mědnatých iontů.
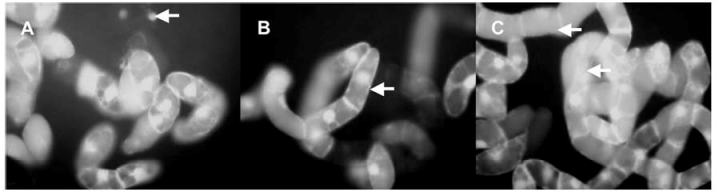
Obr. 1. Morfologické změny buněk BY-2 po
24 hodinách kultivace.
A - kontrola (šipka označuje jádro mrtvé buňky),
B - komplex aplikovaný v koncentraci 100 µM a C - 500 µM.
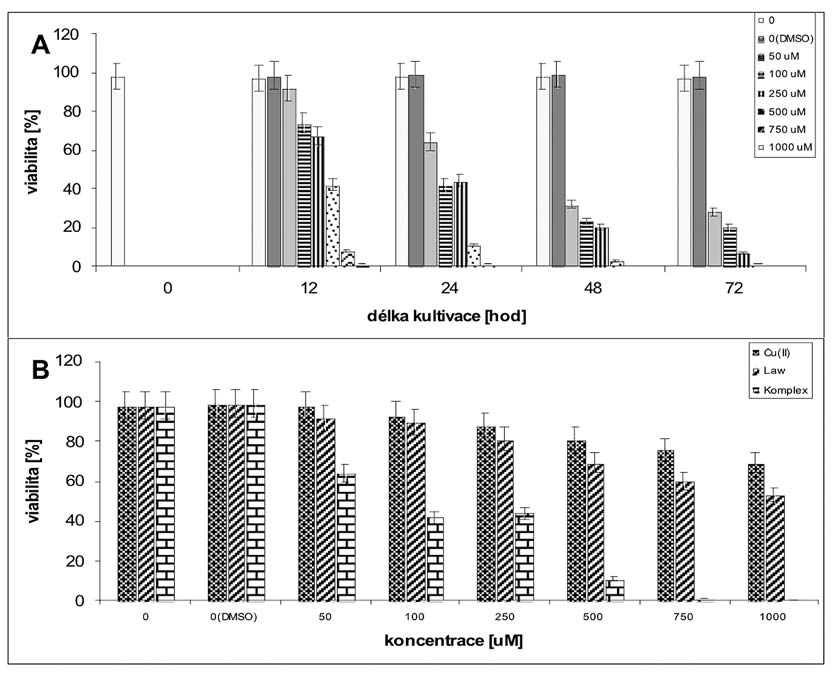
Obr. 2. Cytotoxické vlastnosti komplexu,
lawsonu a mědi jako Cu(II).
A - cytotoxicita komplexu v koncentracích 0 až 1000 µM.
B - porovnání cytotoxicity mědi jako Cu(II), lawsonu (Law) a
komplexu po 24 hodinách kultivace.
Jaderné změny a programovaná buněčná
smrt
Aplikace komplexu v dané koncentrační řadě,
stejně jako mědnatých iontů ve formě octanu a naftochinonu lawsonu
vedla ke zřetelným změnám v jaderné struktuře. Mezi nejčastější
změny patřila kondenzace chromatinu (na periferii jádra i kolem
jadérka), změny typického tvaru jader a přítomnost tzv.
„apoptic-like bodies", tedy fragmentovaných jader; právě jejich
přítomnost, která navíc byla doprovázena typickým smrštěním
cytoplazmy, svědčí o schopnosti testovaných látek vyvolávat
programovanou buněčnou smrt (obr. 3). V nejnižších koncentracích,
tj. 50 a 100 μM, dominovala přítomnost ´apoptic-like bodies´ v
případě komplexu, ve vyšších koncentracích, tj. 500 a 750 μ M, pak
v případě mědnatých iontů - Cu(II).
Závěr
Testovaný komplex naftochinonu lawsonu a
měďnatých iontů -
Cu(Law)2(H2O)2.1/2H2O -
projevil výraznou cytotoxicitu, výraznější ve srovnání se samotným
lawsonem nebo ionty měďi. V případě nižších koncentrací komplexu
byly patrné jaderné změny související s programovanou buněčnou
smrtí a vyšší viabilita, což by nasvědčovalo schopnosti komplexu
vyvolávat buněčné změny vedoucí k programované buněčné smrti, ale
nevedoucí k velmi rychlému zániku buněk, např. v důsledku porušení
energetického metabolizmu buněk, nebo změnám permeability
biomembrán.
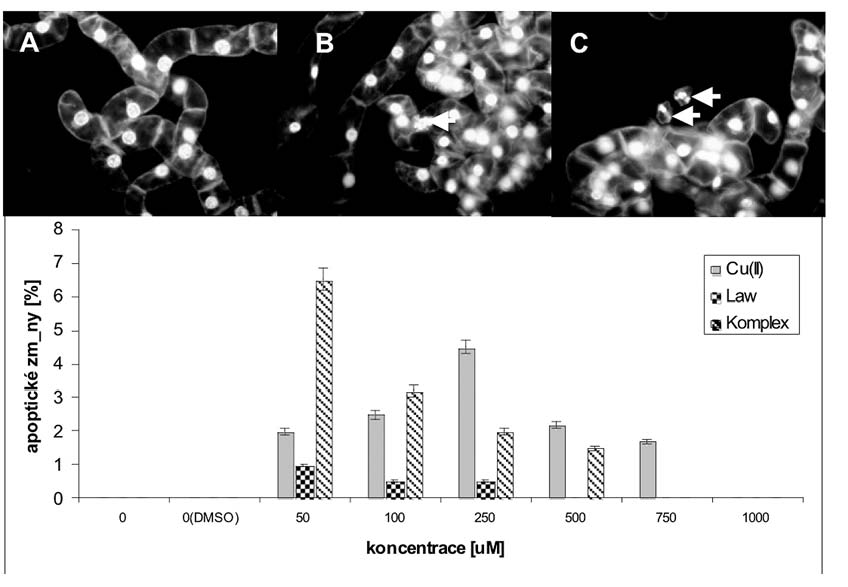
Obr. 3. Jaderná morfologie a apoptické
změny po 24 hodinách po aplikaci komplexu; A - kontrola, B - 100 μM
a C - 250 μM.
Graf vyjadřuje porovnání procenta apoptických změn jako
„apoptic-like bodies" (vyznačeno na fotografiích šipkami) v různých
koncentracích mědi jako Cu(II), lawsonu a komplexu po 24 hodinách
kultivace.
Naopak vyšší koncentrace komplexu vedly k velmi
rychlému zániku buněk, beze změn ve směru programované buněčné
smrti, což svědčí o pravděpodobné interferenci komplexu jak s
biomembránami, tak i metabolizmem buněk. Otázkou zůstává
mechanizmus účinku komplexu. Vzhledem k tomu, že cytotoxicita
komplexu je vyšší v porovnání s lawsonem a ionty mědi, je možné, že
komplex je v buňkách štěpen na lawson a Cu(II), které působí
synergicky. Komplex se nerozkládá ve vodném prostředí, jak prokázal
test stability, tudíž je předpoklad, že je buňkami přijímán a
pravděpodobně dále metabolizován za vzniku Cu(II)a law-sonu; ty
působí synergickým účinkem, který je komplexní, a vede k zániku
buněk. Komplex tedy vykazuje zajímavé biologické vlastnosti, což
jej činí zajímavým pro další testování biologických aktivit, stejně
jako interakcí s biomolekulami, např. DNA.
Poděkování
Práce byla podporována grantovým výzkumnými projekty: GAČR
P301/10/0356, INCHEMBIOL MSM0021622412.
Literatura
- Babula, P., et al., (2007): Naftochinony a jejich farmakologické vlastnosti. Česká a Slovenská farmacie, 56: 114-120.
- Babula, P., et al., (2009): Noteworthy Secondary Metabolites Naphthoquinones - their Occurrence, Pharmacological Proper-ties and Analysis. Current Pharmaceutical Analysis, 5: 47-68
- Babula, P., et al., An influence of cisplatin on tobacco cell culture Nicotiana tabacum BY-2. In: P. Ryant, et al., Eds.), Men-delNet05 Agro, Mendel University of Agriculture and Forestry in Brno, Brno, Czech Republic, 2005, pp. 97-97
- Babula, P., et al., (2006): Naftochinony - biosyntéza, výskyt a metabolismus v rostlinách. Česká a Slovenská Farmacie, 60: 151-159
- Babula, P., et al., (2007): An influence of cisplatin on the cell culture of Nicotiana tabacum BY-2. Plant Soil and Environment, 53: 350-354
- Damon, M., et al., (2005): Phylloquinone (vitamin K1) content of vegetables. Journal of Food Composition and Analysis, 18: 751-758
- Duroux, L., et al., (1998): Insight into naphthoquinone metabolism: beta-glucosidase-catalysed hydrolysis of hydrojuglone beta-D-glucopyranoside. Biochemical Journal, 333: 275-283.
- Hashem, E. Y., et al., (2000): Spectrophotometric study of the complexation equilibria of zinc(II) with lawsone, juglone and naphthazarin. Indian J. Chem. Sect. A., 39: 889-895
- Hernandez-Molina, R., et al., (2007): Complexes of Co(II), Ni(II) and Cu(II) with lapachol. Polyhedron, 26: 4860-4864.
- Chang, H. X., et al., (1999): Design of antineoplastic agents based on the "2-phenylnaphthalene-type" structural pattern. 4. Synthesis and biological activity of 2-chloro-3-(substituted phenoxy)-1,4-naphthoquinones and related 5,8-dihydroxy-l,4-naphthoquinones. Jornal of Medicinal Chemistry, 42: 405-408.
- Kelkar, V. D., et al., (1998): Synthesis and characterisation of Ho(III) a chelates of some juglones. Indian J. Chem. Sect. A.,37: 915-917
- Kiran Aithal, B., et al., (2009): Juglone, a naphthoquinone from walnut, exerts cytotoxic and genotoxic effects against cultu-red melanoma tumor cells. Cell Biology International, 33: 1039-1049
- umbhar, A., et al., (1996): Cytotoxic properties of iron-hydroxynaphthoquinone complexes in rat hepatocytes. Biometals, : 235-240
- Murashige, T., Skoog, F., (1962): Arevised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant, 15: 473-497.
- Nagata, T., et al., (1992): Tobacco BY-2 cell-line as the HeLa-cell in the cell biology of higher plants. A Surv. of Cell Biol., 132: 1-30.
- Smejkal, K., et al., (2008): Cytotoxic Activity of C-Geranyl Compounds from Paulownia tomentosa Fruits. Planta Medica, 74: 1488-1491.
- Tan, J., et al., (2009): DNA binding and oxidative DNA damage induced by a quercetin copper(II) complex: potential mecha-nism of its antitumor properties. J Biol Inorg Chem, 14: 727-739.
Datum přednesení příspěvku: 22. 4. 2010





