Konference: 2012 17. ročník sympózia Onkologie v gynekologii a mammologii
Kategorie: Zhoubné nádory prsu
Téma: Systémová léčba pokročilého a metastatického karcinomu prsu
Číslo abstraktu: 25
Autoři: prof. MUDr. Ľudovít Jurga, DrSc.
Protinádorová chemoterapia aplikovaná v maximálne tolerovaných dávkach (MTD) je uhoľným kameňom liečby zhubných nádorov (ZN). Mnohé chemoterapeutické režimy sú iniciálne účinné, vedú k regresii nádoru alebo k stabilizácii ochorenia, k predĺženiu prežívania s tým, že vyliečenie je relatívne vzácne. Nádorové odpovede sú často krátkodobé, dochádza k progresii ochorenia / k relapsom, ktoré sú agresívne a často chemorezistentné. Štandardná MTD chemoterapia navyše vedie k závažnej toxickosti, a tým k zhoršeniu kvality života pacientov. Ukazuje sa, že viac než 24 cytostatík, ktoré sú rutinne používané, resp. klinicky skúšané, interferuje s neoangiogenézou. Ide pritom o tradične používané cytostatiká (cyklofosfamid, metotrexát, vinblastin, 5-fluorouracil, doxorubicín, mitoxantron, vepezid, paklitaxel, atď.). Cieľom metronomickej chemoterapie (MCT) sú geneticky stabilné endoteliálne bunky novo tvorených ciev vaskulárneho lôžka nádoru, skôr než nádorové bunky s vysokou mierou mutácií. Antiangiogénna liečba tradičnými cytostatikami je prísľubom, lebo neindukuje získanú liekovú rezistenciu, ktorá je bežná u MTD chemoterapie. Nádorová angiogenéza je mnohokrokový proces iniciovaný kaskádou proangiogénnych faktorov secernovaných bunkami nádora a bunkami hostiteľa. Je teda odôvodené skúsiť túto ich vlastnosť využiť s cieľom klinického benefitu. Vzhľadom k nízkej rýchlosti bunkového delenia endotelií je pri epizodicky aplikovaných režimoch štandardnej MTD chemoterapie nízka pravdepodobnosť ich významného poškodenia. Okrem toho majú dostatok času na reparáciu a zotavenie behom 3-4týždňových prestávok v chemoterapii (CT).
Koncepciu antiangiogénnej dozáže protinádorovej chemoterapie prvýkrát v experimente navrhli T. Browder et al. G. Klement v roku 2000. Obidvaja súčasne navrhli kombináciu antiangiogénnej chemoterapie a vtedy experimentálnych inhibítorov angiogenézy (COX-2 inhibítory, VEGFs, Thalidomid, TNP-470).
Už Judah Folkman vo svojej pionierskej práci v New England J. Med. pred 40 rokmi (1971) poukázal na perspektívnosť antiangiogenézy v antineoplastickej terapii. Popripozitívnych výsledkoch cielenej antiangiogénnej liečby dve nedávno publikované experimentálne práce upozornili, že popri inhibícii nádorového rastu primárneho novotvaru dochádza k vyššej invazivite nádoru a k vyššej metastazabilite. Tieto experimentálne práce azda vysvetľujú, prečo VEGF cielená liečba síce často predlžuje celkové niekoľkomesačné prežívanie, napokon však pacienti zomierajú na metastatickú chorobu. Ich provokujúce pionierske práce ukázali, že myši so subkutánnymi tumormi odpovedali na frekventne opakované nízke dávky chemoterapie, dokonca vtedy, keď vykazovali získanú chemorezistenciu k tým istým cytostatikám predtým podávaným konvenčným spôsobom.
V roku 1991 R.S. Kerbel odporúčal atakovať nádorovú vaskulatúru cytostatikami, pretože mnohé endotelie tvoriace stenu tumorových krvných ciev sú jednak nezrelé a konštantne proliferujúce; mohli byť teda zraniteľné cytostatikami.
D. Hanahan a spol. V roku 2000 zaviedli pre nízkodávkovanú kontinuálnu CT (metronomic dosing) termín metronomic chemotherapy (MCT). MCT bola definovaná ako chronické podávanie cytostatík v relatívne nízkych minimálne toxických dávkach bez dlhších prestávok. MCT má inhibovať nádorový rast hlavne cestou antiangiogénneho mechanizmu bez nežiadúcej toxickosti. Teoretické výhody MCT sú nasledovné:
- Aktivita proti parenchýmovým a stromálnym komponentom nádoru
- Proapoptotická aktivita
- Nižšia pravdepodobnosť vynorenia sa získanej rezistencie
Možnosť dlhodobého podávania s prijateľnou toxicitou. Dáta štúdii in vitro a in vivo odporúčali MCT overovať ako novú liečebnú stratégiu v klinickej praxi. V posledných rokoch sa dosiahli priaznivé výsledky nielen u chemonaivných pacientov, ale tiež u v minulosti liečených chorých konvenčnou CT u mnohých entít ZN. Je však potrebné priznať, že v mnohých prípadoch MCT nedokázala signifikantne zlepšiť prežívanie chorých. Na základe predklinických štúdií MCT môže indukovať stabilizáciu ochorenia, alebo objektívnu odpoveďu nádorov refraktérnych, resp. relapsujúcich po konvenčnej CT. Navyše klinický benefit MCT môže byť dlhší než liečebný zisk docielený tradičnými prístupmi. Týka sa to viacerých entít ZN.
Klinické hodnotenia MCT u dospelých
Do dnešných dní najviac klinických triálov sa uskutočnilo u chorých s pokročilým karcinómom prsníka. V 8 klinických triáloch, ktoré zahŕňali takmer 500 pacientov bola aplikovaná MCT samostatná, resp. V kombinácii s letrozolom, trastuzumabom/bevacizumabom sa MCT ukázala ako efektívna metóda. Tieto výsledky sa dosiahli s minimálnou toxickosťou nielen u chemonaivných pacientov, ale tiež pri lokálne pokročilých/metastatických/rezistentných chorých s karcinómom prsníka. Priemerná response rate (RR) > ako 6 mesiacov, t.j. CR + PR bola 39 % (12-88 %). Overall clinical benefit (CR+PR+SD) bolo 57 % (24-93 %). Po MCT cyklofosfamid (CFA) a metotrexát (MTX) v kombinácii s trastuzumumabom klinický benefit sa zaznamenal u 46 % chorých; 27 % týchto pacientiek bolo pritom rezistentných na trastuzumumab. Išlo však o nerandomizované klinické triály. Ukazuje sa, že táto kombinácia môže pôsobiť antirelapsovo oddialením/ prekonaním získanej rezistencie na trastuzumumab. Napokon veľký randomizovaný triál PIII porovnával kombináciu perorálneho denného uraciu a tegafuru s konvenčnou chemoterapiou. Táto MCT môže byť sľubnou postoperačnou liečbou pre choré s vysokorizikovým karcinómom prsníka. Prehľad režimov metronomickej chemoterapie a výsledkov liečby pri karcinóme prsníka je v tabuľke 1.
Tab. 1 Metronomická chemoterapia karcinómu prsníka
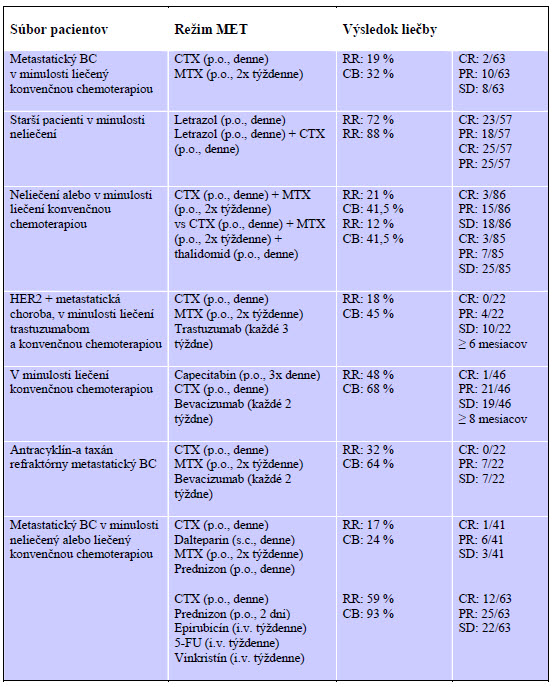
Legenda: CTX = cyklofosfamid; MTX = metotrexát; 5-FU = 5-fluorouracil; CB = clinical benefit; OCB = overall clinical benefit – t.j. CR + PR + SD;
CR = complete response; PR = partial response; SD = stable disease; RR = response rate; p.o. = orálne; i.v. = intravenózne; s.c. = subkutánne; BC = breast cancer
Pozitívne výsledky sa tiež dosiahli rôznymi režimami MCT u pacientok s recidivujúcim ovariálnym karcinómom, tiež u chorých s hormonálne rezistetným karcinómom prostaty, pokročilým mnohopočetným myelómom, pri relapsujúcom nehodgkinskom lymfóme, pri recidívach malígnych nádorov glie a tiež pri lokálne pokročilých/metastatických neuroendokrinnych karcinómoch,nádoroch detského veku a ďalších lokálne pokročilých / metastatických solídnych nádoroch. Tieto klinické štúdie, ktoré zahŕňali viac než 500 chorých, dávali priemernú RR 33 % (13-69 %). Overall clinical benefit bol 61 % (30-93 %). U väčšiny pacientov priemerné trvanie odpovede bolo niekoľko mesiacov, pričom odpovedajúci pacienti mali dlhšie celkové – overall a progression – free survival (OS a PFS). Hodnotiac skutočnosť, že väčšinu študijnej populácie tvorili chorí s veľmi zlou prognózou, ťažko predliečení pacienti s progresívnou a/alebo recidivujúcou chorobou, sú tieto výsledky vcelku prísľubom. Súbory chorých boli diagnosticky heterogénne, žiaduce sú štúdie v stratifikovaných skupinách jednotlivých entít ZN.
Menšie pilotné a retrospektívne štúdie prebehli pri kolorektálnom karcinóme, karcinóme žalúdka a pokročilom/metastatickom malígnom melanóme.
Nedávny multicentrický retrospektívny PII triál s viac než 200 chorými s rôznymi nádorovými entitami ukázal klinickú účinnosť kombinovanej MCT pozostávajúcej z COX-2 inhibítora, modulátora transkripcie a nesteroidných antiflogistík .
Prebehla tiež veľká randomizovaná štúdia PIII skúmajúca účinnosť uracilu a tegafuru pri adenokarcinómoch pľúc.
Na rozdiel od týchto povzbudivých výsledkov, však prinajmenšom 4 klinické triály ukázali obmedzenú účinnosť MCT. U 32 pacientov s progresívnym, lokálne pokročilým/metastatickým renálnym karcinómom kombinácia kontinuálnych nízkych dávok CFA a celecoxibu viedla len k jednej PR a traja chorí mali SD trvajúcu < než 6 mesiacov – klinický benefit bol 12,5 %. Klinická štúdia denných nízkych dávok CFA + MTX 2krát týždenne u 10 pacientov s recidivujúcim glioblastomom neviedla k predĺženiu PFS; triál bol preto predčasne ukončený.
Ďalšia štúdia PII hodnotila štvorkombináciu MCT pozostávajúcu z nízkych perorálnych dávok etopozidu, alternujúceho s nízkymi dennými dávkami CFA + thalidomid + celecoxib; v súbore 47 chorých s recidivujúcimi malígnymi gliómami, jeden pacient mal PR a 4 chorí mali minor response (< ako 50% zmenšenie nádorového objemu). Napriek SD pozorovanej u 59 chorých na CT-skene MCT nezlepšila signifikantne OS u týchto ťažko predliečených pacientov. Predsa však pri pozorovaní odpovedajúcich pacientov (PR + minor response + SD) s neodpovedajúcimi chorými sa zistili signifikantné rozdiely v OS (33 vs. 20 týždňov, P < 0,05) a v 6 mesačnom PFS (21 % vs. 0 % v 6. mesiaci P < 0,0001). Nakoniec PII pilotný triál hodnotiaci účinnosť kombinácie metronomického paklitaxelu s celecoxibom u 20 chorých s metastatickým melanómom ukázal 5 % RR (CR 0, PR1); klinický benefit bol 35 % (7SD včítane 3 chorých, u ktorých liečebný zisk trval > ako 6 mesiacov). Je dôležité zdôrazniť, že tieto zlyhania bolo možno predpokladať; išlo o nádorové entity, ktoré veľmi zle odpovedajú na konvenčnú chemoterapiu. Jestvuje nádej, že výsledky MCT s využitím novších molekúl budú lepšie. Ako príklad možno uviesť predbežné výsledky nedávneho PII triálu pri metastatickom renálnom karcinóme pomocou metronomickej dozáže kapetacibínu, sorafenibu a gemcitabínu (RR bol 50 %, klinický benefit 92,5 %).
Toxickosť MCT
MCT je v dôsledku nízkej kontinuálnej dozáže všeobecne dobre tolerovaná. Nízka toxickosť sa vysvetľuje tým, že TSP-1, teda vysoko špecifický a vysoko potentný endogénny inhibítor angiogenézy, sprostredkuje antiproliferatívny a proapoptotický efekt selektívnou primárnou väzbou na CD36 membránový receptor endotelií. Indukcia TSP-1 neatakuje CD36 negatívne bunky, teda napríklad progenitorové bunky kostnej drene, bunky vlasových folikulov. Toxickosť vyššieho stupňa sa vyskytuje len zriedkavo. Najbežnejšia G1 nevoľnosťa/alebo vracanie G1-G2 anémia, neutropénia, leukopénia a lymfopénia. Fatique býva obvykle nízkeho stupňa. Samozrejme MCT v kombinácii s ďalšími antiangiogénnymi liekmi sa môže toxickosť prehlbovať. Napriek dobrej tolerancii MCT, potenciálne riziko sa musí rešpektovať, pretože MCT je aplikovaná dlhodobo; zvlášť to platí pre nádory detského veku. Je potrebné rešpektovať vyvíjajúci sa organizmus i keď fyziologická angiogenéza sa líši od tumorovej neoangiogenézy. Protrahovaná MCT zvyšuje kumulatívnu dávku cytostatík s rizikom vzniku sekundárnych nádorov zvlášť po často používaných alkylačných látkach.
Nové mechanizmy účinku
Štúdie in vitro a neskôr in vivo s CFA, taxánmi a inými antineoplastickými látkami ukázali, že MCT funguje hlavne cestou inhibície nádorovej angiogenézy. Dochádza k selektívnej inhibícii proliferácie a/alebo k indukcii apoptózy endotélií, i keď ostáva nejasné, ako nízkodávkovaná CT indukuje selektívnu apoptózu endotelií. Znižuje sa tiež migrácia endoteliálnych buniek, stúpa expresia a hladina endogénneho inhibítora angiogenézy, t.j. trombospondinu-1/2 (TSP1/2), za sústavného poklesu hladiny a viability endotélií z kostnej drene pochádzajúcich endoteliálnych progenitorových buniek. Antiangiogénnu aktivitu majú ďalšie endogénne proteíny a fragmenty proteínov (angiostatin, endostatin, arresten, canstatin, tumstatin). Určovanie trombospondinu-1, cirkulujúcich endoteliálnych buniek (CECs) a cirkulujúcich progenitorových endoteliálnych buniek (CEPs) môžu slúžiť ako proangiogénne biomarkery na monitorovanie účinnosti MCT. CECs sa v krvi zdravých ľudí vyskytuje zriedkavo; výnimkou je aktívna menštruačná fáza, zápalové procesy v organizme, včítane cievnych ochorení. Početné in vitro a in vivo štúdie ukázali, že aktivované CECs novo tvorených krvných ciev sú vysoko selektívne na nízke dávky cytostatík.
Hladina CEPs je použitelná ako biomarker pre monitorovanie targetovanej anti-angiogennnej aktivity lieku. Nedávno známe sú ďalšie mechanizmy účinku MCT, ktorá je schopná nepriamo ničiťlieknaivné a liekrezistentné nádorové bunky indukciou hypoxie a zníženého prísunu nutrientov. Pre tento mechanizmus účinku svedčia experimentálne, predklinické a klinické štúdie. Avšak nie sú vylúčené ani doteraz neznáme mechanizmy. Bod zlomu bol rok 2000, keď sa I. J. Fidler a L. M. Ellis vyjadrili nasledovne: “Cancer is a chronic disease and should be treated like other chronic diseases“. i v prípade MCT jestvuje riziko len dočasného benefitu spôsobeného vynorením sa rezistencie na antiangiogénnu liečbu.
Poznáme dva spôsoby rezistencie na antiangiogénnu terapiu:
1) Tzv. „evasive resistance“
2) Intrinsic/pre-existing indifference
1) Evazívna rezistencia sa týka VEGF a ďalších inhibítorov angiogenézy. Môže dochádzať k revaskularizácii v dôsledku upregulácie alternatívnych proangiogénnych signálov. Príčinou môže byť tiež ochrana tumorovej vaskulatúry buď pomocou recruitovaných pro-angiogénnych zápalovýchbuniek (inflammatory cells), alebo vzostupom protektívneho krytia pericytmi. Na rezistencii sa môže podieľať tiež zvýšený „seeding“ nádorových buniek a ich rast v lymfatických uzlinách a vo vzdialených orgánoch. Celkovo teda ide o adaptívnu odpoveď nádoru. V priebehu antiangiogénnej terapie dochádza k evasive resistance zahŕňajúcej funkčný fibroblastový rastový faktor (FGF). Relapsujúce nádory sa stávajú invazívnejšími s vyššou mierou hematogénnej diseminácie.
2) Intrinsic rezistencia pravdepodobne zahŕňa podobné molekulové mechanizmy ako evasive resistance. Existujú dôkazy, že niektoré nádory v dôsledku štádia ich progresie, liečebnej anamnézy, genomickej konštitúcie a/alebo hostiteľového genotypu môžu mať pre-existujúce nádorové mikroprostredie (microenviroment) sprostredkujúce indiferenciu.
Dnes je známa kľúčová úloha vrodeného a adaptačného imunitného systému pri vzniku a kontrole ZN. Ukazuje sa, že únik nádoru (tumor escape) z imunodozoru, dnes nahradeného termínom imunokorekcia, je štandardným znakom chovania sa ZN. Popri nepriaznivom dreňotoxickom vplyve chemoterapie vedúcej k lymfopénii a neutropénii niektoré cytostatiká (antracyklíny, taxány a CFA) majú dôležité imunostimulačné vlastnosti. V kontexte MCT je dôležitý jej účinok na regulačné T bunky (TREG). TREG inhibujú protinádorovú imunitnú odpoveď supresiou aktivity tumor špecifických (CD8+, cytotoxické T lymfocyty a CD4+T helper cells) a nádor nešpecifických efektorových buniek (natural killer – NKT bunky). TREG bunky sú vo zvýšenom pomere prítomné u viacerých ZN. Zvýšená frekvencia TREG buniek koreluje s progresiou nádoru a chýbaním liečebnej odpovede.
Navyše poškodenie TREG aktivity buď špecifickou blokádou, alebo depléciou môže posilniť imunitnú odpoveď proti s nádorom asociovaným antigénom.
Viaceré experimentálne štúdie ukázali, že nízke dávky CFA môžu zvýšiťprotinádorovú imunitnú odpoveď poklesom počtu a inhibíciou supresívnych funkcii TREG buniek, tiež vzostupom proliferácie lymfocytov a pamäťových buniek.
Nízke dávky metronomického temozolomidu viedli k deplecii a k inhibícii imunosupresívnej aktivity TREG u chorých s gliómom. Navyše F. Ghiringhelli nedávno ukázal, že metronomický CFA redukoval frekvenciu cirkulujúcich TREG buniek a ich imunosupresívnych funkcií u pokročilých ZN. Je treba poznamenať, že tento účinok na TREG bunky bol selektívny, pretože žiadny signifikantný pokles v počte iných imunitných bunkových typov sa nepozoroval.
Jestvujú dva základné procesy indukované nádorom schopným rásť a progredovať. Ide o angiogenézu (rast nových ciev z pre-existujúcich krvných ciev, alebo z CEPs. Druhým procesom je únik nádoru spod imunitnej odpovede.
Protinádorový a antimetastatický efekt MCT možno teda dosiahnuť inhibíciou CEPs, únikom buniek pred imunitnou odpoveďou, resp. stimuláciou imunitnej odpovede a priamym antineoplastickým účinkom na tumorové bunky.
Indukcia nádorovej dormancie
Experimentálne a klinické dôkazy podporujú existenciu a kľúčovú úlohu nádorovej dormancie pri potláčaní progresie nádoru a rizika relapsu ochorenia. Nádorovú dormanciu pozorujeme už behom veľmi včasnej fázy rastu nádoru ešte pred tým, než dôjde k angiogénnemu switchu. Angiogenic switch nastáva, keď hladina stimulátorov angiogenézy (VEGF, basic fibroblast growth factor – bFGF) presahuje hladinu inhibítorov angiogenézy (trombospondin-1). Možno ju pozorovať po skončení protinádorovej liečby, tiež behom klinickej remisie. Vzácne cirkulujúce nádorové bunky možno zistiť aj viac než 20 rokov po mastektómii u chorých s non-evidence of disease. Možnosti re-indukcie a udržanie nádorovej dormancie sa stáva významnou zložkou protinádorovej liečby.
Nádorová dormancia je buď výsledkom zastavenia bunkového cyklu, alebo dosiahnutia dynamického equilibria, v ktorom je bunková proliferácia vyvážená indukciou apoptózy. Vyskytuje sa v primárnom nádore a/alebo v metastázach. Obvykle sa dormancia delí do 3 odlišných kategórii
- angiogénna dormancia
- bunková dormancia
- imunokorekcia
Od úvodnej publikácie J. Folkmana a spol je známe, že avaskulárne nádory môžu byťudržané v dormantnom stave. Tento druh dormancie sa pozoroval napr. U retinoblastómu. Znamená to, že inhibíciou nádorovej angiogenézy MCT možno indukovať a udržaťangiogénnu dormanciu. Samozrejme, angiogénna dormancia pri MCT sa môže prelínať so zložkami imunitného systému. Je teda zrejmé, že imunitný systém sa skutočne podieľa na kontrole a eradikácii nádorových buniek. Tumor – špecifické CD8+T lymfocyty môžu indukovať apoptózu nádorových buniek. Avšak reziduálne nádorové bunky obvykle perzistujú a môžu byť imunitným systémom držané ako klinicky dormantné. Prerušenie tejto dormancie môže nastať únikom buniek (cell escape) spod imunokorekcie. Predpokladom udržania nádorovej dormancie a imunologickej T-bunkovej pamäti je nízka hladina perzistujúceho antigénu.
Ukazuje sa, že kontrola a nie eradikácia všetkých nádorových buniek MCT môže prispieť k reinforcementu imunokorekcie a účinnosti MCT.
4-D efekt
MCT okrem účinku na nádorovú vaskulatúru a imunitný systém pravdepodobne atakuje priamo nádorové bunky. Francúzsko-austrálska skupina v roku 2009 (N. Andre, E. Pasquier) navrhla teoretický model protinádorového účinku MCT založený na indukčnej chemotherapy – driven dependence nádorových buniek nasledovanej vynútenou depriváciou lieku na konci terapie, resp. počas prestávky v liečbe. Tento fenomén autori nazvali drug driven dependency-deprivation effect alebo 4-D efekt. Hypotéza sa zakladá na princípoch vývoja nádorovej bunky počas dlhodobej liečby a na nedávnych predklinických a klinických dôkazoch demonštrujúcich priaznivý efekt zavedenia prestávky pri dlhodobej protinádorovej liečbe.
B. Seruga, I.F. Tannock v roku 2008 odporúčali, že intermitentná angiogénna deprivácia a nie kontinuálna hormonálna terapia má byť štandardom pri karcinóme prostaty. Predklinické štúdie naznačujú, že zavedenie prestávok pri dlhodobej liečbe (androgénna deprivácia pri karcinóme prostaty alebo inhibícia aromatáz pri karcinóme prsníka) by mohlo prekonať alebo dokonca zvrátiť získanú bunkovú rezistenciu. Údaje štúdii in vitro ukazujú, že väčšina mikrotubuly targetujúcich cytostatík (taxány, vinca alkaloidy a epothilóny) môžu indukovať závislosť bunkových línií na dlhodobej expozícii cytostatikám a po ich vysadení indukujú smrť týchto závislých (addicted) buniek. V klinickej praxi 3 najúčinnejšie metronomické protokoly vedúce k dlhodobým odpovediam/stabilizácii u detí zahŕňajú 4-5 liekov, pričom takmer každý liek bol pravidelne vysadený, konštantne tak tvoriac fázy dlhodobej expozície jedného alebo viacerých agens a depriváciu ostatných. Je tak plauzibilné, tvoriac fázy deprivácie jedného alebo viacerých agens zavedením prestávok pri MTC možno zvýšiť liečebnú účinnosť cestou týchto zatiaľ domnelých, ale veľmi pravdepodobných mechanizmov.
Celkovo tento teoretický model vedie k veľkým zmenám paradigmy, v ktorej protinádorová aktivita spočíva nielen na priamom efekte na nádorové bunky, ale aj na antiangiogénnom účinku na endoteliálne bunky. MCT môže cieliť nielen na endotelie, ale tiež na imunitný systém a potenciálne aj na nádorové a kmeňové bunky (cancer stem cells) cez viaceré priame a nepriame účinky. MCT sa tak konvertuje z antiangiogénnej liečby na multitargetované zameranie na nádorové bunky a ich mikroprostredie.
Závery a budúci vývoj
Existujú predklinické a klinické dôkazy podporujúce MCT ako účinný prostriedok voči určitým druhom ZN. Je však možno považovať MTC za novú liečebnú stratégiu v klinickej onkológii? MCT sa ponúka v ére targetovanej liečby. Mnohé práce s používaním MCT vo fáze I/II s použitím tradičných cytostatík u širokého spektra solídnych nádorov (karcinóm prsníka, nemalobunkové karcinómy pľúc, malígne lymfómy, karcinóm prostaty, karcinóm ovária, malígny melanóm) dáva povzbudivé výsledky. Za účelom hlbšieho poznania mechanizmov účinku MCT je žiadúca spolupráca experimentálnych a klinických onkológov. Ukazuje sa, že cieľom nemusí byť i tak nemožné zničenie všetkých nádorových buniek.
MCT ako prolongovaná liečba môže mať uplatnenie v rámci udržiavacej liečby pri minimálnej toxickosti a dobrej kvalite života pacientov. Pozitívom v neposlednom rade v porovnaní s MTD chemoterapiou sú výrazne nižšie náklady na cytostatiká a podpornú liečbu.
Je nepravdepodobné, že jeden MCT režim by bol univerzálne účinný. Rovnako ostáva úloha nájsť optimálnu kombináciu režimov u jednotlivých entít ZN. Budúce predklinické a klinické štúdie musia definovať najúčinnejšie agens a ich dozáž u jednotlivých druhov ZN, určiť počet cystostatík v jednom MCT režime a ev. komedikáciu. Dôležité je určiť timing podávania liekov, trvanie liečby a termín jej ukončenia (Naraz? Postupne?). Nevyhnutné je vypracovať stratégiu kombinácie MCT s rádioterapiou a určiť miesto cielenej liečby v kombinácii s MCT. S cieľom stratifikácie a monitorovania MCT je treba definovaťspoľahlivé markery kinetiky a viability cirkulujúcich endotelii a progenitorových endoteliálnych buniek. Pribúdajú dôkazy, že nádorové endotelie sú signifikatne odlišné od normálnych endotelii.
Literatúra:
- Andre, N. & Pasquier, E. Response to Intermittent androgen blockade should be regarded as standard therapy in prostate cancer. Nat. Clin. Pract. Oncol. 6, E1 (2009).
- Andre, N & Pasquier, E. For cancer, seek and destroy or live and let live? Nature 460, 324 (2009).
- Berges, G. & Hanahan, D. Modes of resistance to anti-angiogenic therapy. Nat Rev. Cancer 8, 592-603 (2008).
- Bocci, G. et al.: Thromboplastin 1, a mediator of the antiangiogenic effect of lowdose metronomic chemotherapy. PNAS, 100, 22, 12917-12992 (2003).
- Bocci G, Tuccori M, Emmenegger U, et al. Cyclophosphamide-methotrexate „ metronomic“ chemotherapy for the palliative treatment of metastatic breast cancer. A comparative pharmacoeconomic evaluation. Ann Oncol 2005; 16:1243-52.
- Bottini A, Generali D, Brizzi MP, et al: Randomized phase II trial of letrozole and letrozole plus low-dose metronomic oral cyclophosphamide as primary systemic treatment in elderly breast cancer patients. J. Clin Oncol 24: 3623-3628, 2006
- Browder, T. et al. Antiangiogenic scheduling of chemotherapy improves efficacy against experimental drug-resistant cancer. Cancer Res. 60, 1878-1886 (2000).
- Colleoni M, Rocca A, Sandri MT et al: Low-dose oral methotrexate and cyclophosphamide in metastatic breast cancer: antitumor activity and correlation with vascular endothelial growth factor levels. Ann Oncol 2002; 13: 73-80
- Colleoni M, Viale G, Zahrieh D, et al: Chemotherapy is more effective in patients with breast cancer not expressing steroid hormone receptors: a study of preoperative treatment. Clin.Cancer Res 10: 6622-6628, 2004
- Colleoni, M. et al. Metronomic low-dose oral cyclophosphamide and methotrexate plus or minus thalidomide in metastatic breast cancer: antitumor activity and biological effects. Ann. Oncol. 17, 232-238 (2006).
- Dellapasqua S, Bertolini F, Bagnardi V, et al: Metronomic cyclophosphamide and capecitabine combined with bevacizumab in advanced breast cancer. J. Clin Oncol, 26;4899-4905, 2008
- Ebos, J. M. et al. Accelerated metastasis after short-term treatment with a potent inhibitor of tumor angiogenesis. Cancer Cell 15, 232-239 (2009).
- Emmenegger U, Man S, Shaked Y, et al: a comparative analysis of low dose metronomic cyclophosphamide reveals absent or low-grade toxicity on tissues highly sensitive to the toxic effects of maximum tolerated dose regimens. Cancer Res 64: 3994-4000, 2004
- Folkman, J. Tumor angiogenesis: therapeutic implications. N. Engl. J. Med. 285, 1182-1186 (1971).
- Gasparini, G. Metronomic scheduling: the future of chemotherapy? Lancet Oncol. 2, 733-740 (2001).
- Ghiringhelli, F. et al. Metronomic cyclophosphamide regimen selectively depletes CD4+CD25 + regulatory T cells and restores T and NK effector functions in end stage cancer patients. Cancer Immunol. Immunother. 56, 641-648 (2007).
- Hanahan, D., Bergers, G. & Bergsland, E. Less is more, regularly: metronomic dosing of cytotoxic drugs can target tumor angiogenesis in mice. J. Clin. Invest. 105, 1045-1047 (2000).
- Jain, R. K. et al. Biomarkers of response and resistance to antiangiogenic therapy. Nat. Rev. Clin. Oncol. 6, 327-338 (2009).
- Kamen BA, Rubin E, Aisner J, Glatstein E, High-time chenitherapy or high time for low dose. J. Clin Oncol 2000, 18: 2935-2937.
- Kerbel, R. S. & Kamen, B. A. The anti-angiogenic basis of metronomic chemotherapy. Nat. Rev. Cancer 4, 423-436 (2004).
- Kerbel, R. S. Tumor angiogenesis. N. Engl. J. Med. 358, 2039-2049 (2008).
- Mancuso P, Colleoni M, Kalleri A, Orlando L., Maisonneuve P, Pruneti G, Agliano A, Goldhirsh A, Shaker Y, Kerbel RS, Bertolini F… irculating endothelial-cell kinetics and viability predoct sirvival in breast cancer patients receiving metronomic chemotherapy. Blood 2006; 108:452-59.
- Marusyk, A. & Polyak, K. Tumor heterogeneity: Causes and consequences. Biochim. Biophys, Acta 1805, 105-117 (2010).
- McShane L, et al: Reporting recommendations for tumor marker prognostic studies (REMARK). Nat Clin. Pract. Oncol 2, 416-422, 2005.
- Nannini, M. et al. To widen the setting of cancer patients who could benefit from metronomic capecitabine. Cancer Chemother. Pharmacol. 64, 189-193 (2009).
- Oldenhuis, C.N. Oosting S, Gietema J.A.& de Vries, E. G. Prognostic versus predictive value of biomarkers in oncology. Eur. J. Cancer 44, 946-953. 2008
- Orlando, L., Cardillo, A., Ghisini R., rocca a et al.: Trastuezumab in combination with metronomic cyclophosphamide and methotrexate in partients HER-2 positive metastatic breas cancer BMC Cancer 6, 225, 2006
- Paez-Ribes, M. et al. Antiangiogenic therapy elicits malignant progresion of tumors to increased local invasion and distant metastasis. Cancer Cell 15, 220-231 (2009).
- Pasquier, E., Andre, N. & Braguer, D. Targeting microtubules to inhibit angiogenesis and disrupt tumour vasculature: implications for cancer treatment. Curr. Cancer Drug Targets 7, 566-581 (2007).
- Pasquier,E., M. Kavallaris, André.N.: Metronomic chemotherapy: new rationale for new disectione. Nat. Rev. Clin Oncol. advance online publication XX Month 2010; doi: 10, 1038/ nrclinone. 2010. 82
- Sarmiento, R. & Gasparini, G. Antiangiogenic metronomic chemotherapy. Onkologie 31, 161-162 (2008)
- Simon R: Optimal two-stage designs for phase II clinical trials. Control Clin Trials 10: 1-10, 1989
- Sterba, J., Pavelka, Z. & Slampa, P. Concomitant radiotherapy and metronomic temozolomide in pediatric high-risk brain tumors. Neoplasma 49, 117-120 (2002).
- Seruga, B. & Tannock, I. F. Intermittent androgen blockade should be regarded as standard therapy in prostate cancer. Nat. Clin. Pract. Oncol. 5, 574-576 (2008).
- Wilson P.M., et al: Use of intratumoral mRNA expression of genes involved in angiogenesis and HIF1 pathway to predict outcome to VEGFR tyrosine kinase inhibitor in patients enrolled in CONFIRM1 and CONFIRM2 [Abstract] ASCO Meeting Abstracts 26, 4002, 2008
- Winer EP, Carey LA, Dowsett M, et al.: Beyond anatomic staging: Are we ready to take the leap to molecular classification? Am Soc Clin Oncol. Ed Book 46-59, 2005
- Wong Nan Soon, Bruckman, R.A., Clemons, M. et al.: Phase I/II trial of metronomic chemotherapy with daily delteparin and cyclophosphamide, twice –Weekly Methotrexate, and daily prednisone as therapy for metastatic Breast cancer Using vascular endothelial Growth factor and Soluble Vascular Endothelial Growth factor Receptir levels as markers of response. J Clin Oncol 28; 5, 723-730, 2009
- Yoshiji H, Harris S.R. & Thorgeirsson U.P. Vascular endothelial growth factor is essential for initial but not continued in vivo growth of human breast carcinoma cells. Cancer Res. 57, 3924-3928, 1997
Datum přednesení příspěvku: 7. 1. 2012





