Konference: 2010 XXXIV. Brněnské onkologické dny a XXIV. Konference pro sestry a laboranty
Kategorie: Genitourinární nádory
Téma: Pokroky v biologii nádorů
Číslo abstraktu: 084
Autoři: Mgr. Barbora Fialová; Ing. Kateřina Trtková, CSc.; prof. MUDr. Zdeněk Kolář, CSc.
Rakovina prostaty je jeden z nejčastěji diagnostikovaných typů nádorového onemocnění u mužů. Vývoj rakoviny prostaty je ve většině případů závislý na funkci androgenového receptoru (AR) a podle této závislosti lze rakovinu prostaty rozdělit na dvě stádia. Prvním stádiem je tzv. na androgenech-závislá rakovina prostaty, která ke svému růstu a progresi vyžaduje aktivní AR. Standardní léčba spočívá v odstranění prostaty nebo varlat, poté následuje hormonální léčba (Grossmann et al., 2001; Culig et al., 2005). Druhé, na androgenech-nezávislé stadium rakoviny prostaty, se často vyvíjí z prvního stádia po aplikaci hormonální léčby a jejím charakteristickým rysem je růst a progrese nádorových buněk, které nemají funkční AR (Kinoshita et al., 2000; Powell et Yin, 2006).
Posttranslační a epigenetické modifikace mohou ovlivňovat expresi genu AR u nádorů prostaty (Culig et al., 2005). Bylo zjištěno, že ve 20-30% případech u na androgenech-nezávislých stádií je gen AR umlčován na transkripční úrovni (Kinoshita et al., 2000) tzv. epigenetickými modifikacemi, zejména metylacemi DNA a acetylacemi/deacetylacemi histonů (Nakayama et al., 2000). Metylace DNA se vyskytují v krátkých, na CG bohatých vláknech DNA, známých jako CpG ostrůvky. Tyto se nejčastěji nacházejí v promotorových oblastech přibližně u 50% genů, které mohou zasahovat i do oblasti 1. exonu. Metylace CpG ostrůvků v promotorových oblastech ovlivňuje transkripci genů a je běžnou formou regulace genové exprese (Brena et al., 2006; Yoo et Jones, 2006).
Jednou z příčin vzniku rakoviny prostaty mohou být i změny v expresi tumor-supresorových genů (Schulz et al., 2003; Porkka et Visakorpi, 2004). Potenciální tumor-supresorový gen ZNF185 (Zinc finger protein 185 - ZNF185) leží na chromozomu Xq28 a kóduje protein obsahující LIM doménu (Heiss et al., 1997). Heiss et al. (1997) zjistili, že gen ZNF185 je ve velkém množství exprimován v prostatě, ale omezeně v ostatních tkáních. Vanaja et al. (2003) zaznamenali značně sníženou expresi genu ZNF185 ve všech prostatických nádorových tkáních ve srovnání s normální tkání prostaty. Dále prokázali inaktivaci genu ZNF185 metylací CpG dinukleotidů u prostatických nádorových buněčných linií a tkání nádorů prostaty. Vyšší úroveň metylace a snížená exprese mRNA korelovala s pokročilostí nádorů a metastázemi. Tento gen by tak mohl sloužit jako marker stádií vyvíjející se rakoviny prostaty (Vanaja et al., 2003).
Materiál a metody
DNA byla izolována z archivních vzorků biopsií
prostaty zalitých do parafinových bločků pomocí FitAmp™ Paraffin
Tissue Section DNAIsolation Kit (Epigentek). Pro tuto pilotní
studii jsme použili 46 vzorků DNA pocházejících od 9 pacientů. 26
vzorků DNA bylo izolováno z tkáně diagnostikované jako benigní
hyperplazie prostaty (BPH), 18 vzorků z nádorové tkáně a 2 vzorky
pocházely z normální tkáně prostaty. DNA byla modifikována
bisulfitovou reakcí s použitím Epitect® Bisulfite Kit (Qiagen).
Princip bisulfitové modifikace spočívá v tom, že se nemetylované
cytosiny v DNA konvertují na uracily a tyto se v následující PCR
reakci syntetizují jako thyminy. Naproti tomu metylované cytosiny
zůstávají metylovány a konverzi nepodléhají. Pro PCR analýzu jsme
použili primery amplifikující úsek 1. exonu genu ZNF185 a 1. exonu
genu AR. Jedná se o místa s extrémním výskytem CpG ostrůvků.
Primery jsme navrhli na nemetylované sekvence DNA po bisulfitové
modifikaci.
Výsledky a diskuze
U 2 vzorků normální prostatické tkáně byla
detekována metylace u 1. exonu genu AR i genu ZNF185 (Tab. 1). U
nízkého počtu vzorků pocházejících ze dvou pacientů (21605/04 a
126/06) byla zjištěna metylace AR i ZNF185 u BPH vzorků, zatímco
vzorky z nádorů prostaty metylační změny nevykazovaly.
Další výsledky naznačují, že metylace
tumor-supresorového genu ZNF185 se často vyskytuje u prostatických
nádorových tkání spolu s metylovaným genem AR. Přítomnost metylací
v úseku genu ZNF185 i genu AR v normální tkáni může být způsobena
kontaminací nádorovou tkání anebo chybou vyplývající z nízkého
počtu vzorků.
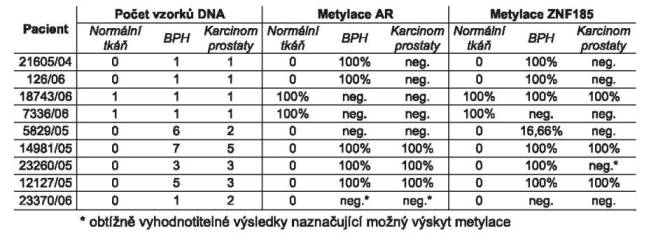
Tab. 1: Výsledky analýzy metylace genu AR a genu ZNF185
Závěr
Výsledky v této pilotní studii naznačují, že
výskyt metylací tumor-supresorového genu ZNF185 se shoduje s
výskytem metylací genu AR. Metylační analýza genu ZNF185 by tak
mohla sloužit jako důležitý marker pokročilých stádií rakoviny
prostaty. Pro potvrzení těchto výsledků by bylo potřebné provést
tyto analýzy na větším počtu pacientů.
Literatura
- Brena, R. M., Huang, T. H-M. et Plass, Ch. (2006): Toward a
human epigenome. Nature Genetics (38), 1359-1360.
- Culig, Z., Steiner, H., Bartsch, G. and Hobisch, A. (2005):
Mechanisms of endocrine therapy -responsive and unresponsive
prostate cancer. Endocrine-Related Cancer (12), 229-244.
- Davis, C. D. et Uthus, E. O. (2004): DNAmethylation, cancer
susceptibility, and nutrient interactions. Experimental Biology and
Medicine (229): 988-995.
- Grossmann, M. E., Huang, H. et Tindall, D. J. (2001): Androgen
receptor signaling in androgen-refractory prostate cancer. Journal
of the National Cancer Institute (93), 1687-1697.
- Heiss, N. S., Gloeckner, G., Bachner, D., Kioschis, P., Klauck,
S. M., Hinzmann, B., Rosenthal, A., Herman, G. E. et Poustka, A.
(1997): Genomic structure of a novel LIM domain gene (ZNF185) in
Xq28 and comparisons with the orthologous murine transcript.
Genomics (43), 329-338.
- Kinoshita, H., Shi, Y., Sandefur, C., Meisner, L. F., Chang,
Ch., Choon, A., Reznikoff, C. R., Bova, G. S., Friedl, A. et
Jarrard, D. F. (2000): Methylation of the androgen receptor minimal
promoter silences transcription in human prostate cancer. Cancer
Research (60), 3623-3630.
- Nakayama, T., Watanabe, M., Suzuki, H., Toyota, M., Sekita, N.,
Hirokawa, Y., Mizokami, A., Ito, H., Yatani, R. et Shiraishi, T.
(2000): Epigenetic regulation of androgen receptor gene expression
in human prostate cancer. Laboratory Investigation (80),
1789-1796.
- Powell, C. T. et Yin, L. (2006): Overexpression of PKC
sensitizes LNCaP human prostate cancer cells to induction of
apoptosis by bryostatin 1. International Journal of Cancer (118),
1572-1576.
- Schulz, W. A., Burchardt, M. et Cronauer, M.V. (2003):
Molecular biology of prostate cancer. Molecular Human Reproduction
(8), 437-448.
- Vanaja, D. K., Cheville, J. C., Iturria, S. J. et Xoung, Ch.Y.
F. (2003): Transcriptional silencing of Zinc finger protein 185
identified by expression profilings is associated with prostate
cancer progression. Cancer Research (63), 3877-3882.
- Yoo, Ch. B. et Jones, P. A. (2006): Epigenetic therapy of cancer: past, present and future. Nature Reviews (5), 37-50.
Práce byla financována grantem IGA NS10262-3/2009 a podpořena z MSM 6198959216.
Datum přednesení příspěvku: 23. 4. 2010





