Konference: 2005 10. ročník odborného sympózia na téma Onkologie v gynekologii a mammologii
Kategorie: Zhoubné nádory prsu
Téma: Terapie pokročilého karcinomu prsu. II. Blok: Systémová terapie pokročilého karcinomu prsu
Číslo abstraktu: 026
Autoři: MUDr. Renata Neumanová, Ph.D., MBA; K. Machařová; MUDr. Karel Dvořák, CSc.; H. Machařová; doc. MUDr. Zdeněk Pačovský, CSc.; J. Filka; MUDr. Josef Patera, CSc.; MUDr. Eva Jandáková
k myšlence, že karcinomy jsou v řadě případů onemocnění lokální a prováděla se proto jen léčba chirurgická. Teprve až od roku 1940 Haagenson a Stout popisují kritéria operability a snaží se předikovat význam radikálních chirurgických výkonů ve vztahu k pacientově
prognóze.
Podání neoadjuvantní CHT v případech lokálně pokročilého, primárně operabilního karcinomu prsu, se z řady preklinických i klinických studií jeví jako výhodné. Jedná se o podání systémové léčby před léčbou lokoregionální (tj. chirurgickou či radiační). Zůstává však řada nevyřešených otázek na teoretické i praktické úrovni. tumorózního růstu.
Závěry z nerandomizovaných studií s různými chemoterapeutickými režimy vykazují signifikantně významné zvýšení klinické odpovědi, ale nízké procento navýšení odpovědi patologické. Ukazuje se, že je možné provedení většího počtu prs zachovávajících konzervativních výkonů po redukci primárního nálezu. Současně existují údaje o tom, že neoadjuvantní chemoterapie redukuje velikost a počet pozitivních uzlin v axille.
Přesto není možné jednoznačně dokumentovat delší DFS a OS s užitím této léčebné strategie.
Množství randomizovaných trialů bylo designováno tak, aby odpovědělo na výše zmíněné otázky.
Velká studie NSABP 18 je čistě zaměřená na srovnání efektu neoadjuvantního a adjuvantního podání CHT u lokoregionálního onemocnění prsu. Byli srovnáváni pacienti, kteří obdrželi CHT předoperačně s pacienty, kteří absolvovaly chirurgickou léčbu a následně
CHT.
Skipper uváděl hypotézu, že velikost odpovědi primárního tumoru na CHT nemusí nezbytně znamenat totéž při odpovědi mikrometastáz.
Coldie a Colman předpovídali, že tak jak se zvětšuje populace nádorových buněk, zvyšuje se i resistence buněčných klonů, díky sekundárním či spontánním somatickým mutacím a tyto buněčné klony je obtížné následně eradikovat.
Nakonec Gunduz a spol. a Disher a spol. pozorovali, že odstranění primárního tumoru vede často ke zvýšení kinetiky nádorového růstu v mikrometastázách, čemuž může být zabráněno
podáním CHT před chirurgickou léčbou. Tyto hypotézy a pozorování vedly k racionální přípravě trialů, týkajících se užití předoperační
chemoterapie v klinické praxi.
Výstupy: zmenšení primárního tumoru, z toho resultující větší množství provedených prs šetřících výkonů, které nemusí nutně znamenat navýšení lokálních či regionálních recidiv.
Randomizované trialy s užitím neoadjuvantní chemoterapie
STUDIE: Maurice v r. 1991 randomizovaný trial 272 žen s operabilním tumorem nad 3
cm.
A group (138) – iniciálně RMM + adj. CHT
B group ( 134) - NCHT + PME, pokud došlo k regresi prim. Tu
Výsledky: 32 pac. ze skupiny A neobdrželo CHT, 44 pac., které měly CCR nepodstoupily chirurgický výkon, ale následnou RT.
Scholl et al. V r. 1995 u 414 premenopauzálních žen s T2-3 N0-1 M0 obdržely
A group: FAC, následovaný radioterapií a parcielní mastektomií nebo
B group: primárně RT s následnou parcielní ME, a tam, kde nebylo dosaženo pCR + 4 cykly
FAC.
Bylo zde prokázáno signifikantně lepší přežívání ve skupině A tj. s neoadjuvancí., bez rozdílu v DFS. Míra prs šetřících výkonů byla srovnatelná.
Royal Marsden Hospital et al. prezentovala malý trial právě s primárním předoperačním použitím CHT oproti CHT pooperační.
A group: 4x CHT – operace – 4x CHT (tatáž)
B group: operace – 8x CHT
Randomizováno 212 pacientek, celková klinická odpověď byla 85%, kompletní patologická regrese byla zaznamenána v 10% případů. Byla prokázána i významná redukce radikálních modifikovaných mastektomií u žen po neoadjuvantní chemoterapii, ve srovnání s ženami, které obdržely chemoterapii adjuvantní.
Kompletní výsledky byly známy v roce 1998, kdy již bylo zařazeno 309 žen, podávaná chemoterapie byla ve složení Mitoxantron + MTX ± Mitomycin, event. TX dle positivity SR.
Výsledky: kompletní klinická regrese byla 22%, částečná klinická odpověď byla 29%, patologická regrese byla zaznamenána u 33% žen, beze změny – 15% žen a jen 2 pacientky měly evidentní progresi základního onemocnění. Medián follow byl cca 48 měsíců, přesto nebyly v obou skupinách zaznamenány statisticky významné rozdíly v době do lokální recidivy či vzdálené diseminace, ani v době celkového přežívání.
V roce 1988 NSABP iniciovalo trial NSABP 17 u pacientek s operabilním karcinomem prsu ke srovnání předoperačně a pooperačně podané chemoterapie. Group A podstoupila nejprve chirurgický výkon a následně dostala 4 cykly AC nebo group B měla 4x AC před operačním výkonem.
Pacientky, které měly parcielní mastektomii se dále podrobily adjuvantní radioterapii a to v obou skupinách, v průběhu 5 ti let bylo zrandomizováno 1523 pacientek (760 a 763).
Výsledky: kompletní klinické odpovědi dosáhlo 36% pacientek a 44% dosáhlo parcielní klinické odpovědi, tj. celková klinická odpověď je 80%. Beze změny zůstalo 17 % pacientek, ve 3% případů došlo k progresi. Dle multivarietní analýzy byl rozměr tumoru a stav uzlin
významným prediktorem klinické odpovědi tumoru.
Z pacientů, kteří dosáhli klinické patologické odpovědi mělo 26% pCR, u 11% byla nalezena jen ložiska mikroinvazivního ca .
Downstaging v oblasti axillárních uzlin. Byla prokázána jasná souvislost s podáním neoadjuvantní chemoterapie a downstagingem axillárních uzlin. 57% pacientek, které měly adjuvantní CHT měly patologicky postižené axillární uzliny, 41% pacientek, které obdržely neoadjuvantní chemoterapii byly shledány N0 (P< 0,001). Přibližně 1/3 patologicky positivních uzlin byla konvertována na patologicky negativní. Též byla zaznamenána korelace mezi odpovědí tumoru a uzlin na CHT. Pacientky, které podstoupily předoperační CHT mohly ve větší míře podstoupit i prs záchovný výkon, zvláště markantní byly rozdíly u žen s primárním tumorem nad 5 cm rozměru. (22% versus 8%).
Lokální recidiva na stejné straně se v průběhu let u pacientek po parcielní mastektomii objevila v pooperační skupině v 5,8%, ve skupině předoperační v 7,9%, přičemž tento rozdíl nebyl signifikantně významný.
Celkové výsledky – po srovnání obou skupin nebyly nalezeny signifikantně významné rozdíly v DFS, distant DFS a OS mezi oběma skupinami. Pro obě skupiny po 5 ti letém sledování byl DFS 67%, distant DFS 73% a OS 80%. Byly však zaznamenány signifikantně významné vztahy mezi klinickou a patologickou odpovědí u skupiny s předoperační chemoterapií v závislosti na celkových výsledcích. Pacientky, které dosáhly
cCR: měly 76% 5ti letého DFS
cPR: 64%
SD 60% p= 0,001
Nejvíce zajímavé je, že pacientky, které kromě cCR měly i pCR, měly prokázané významně delší DFS a OS, ve srovnání s těmi, u kterých bylo prokázáno residuum invazivního karcinomu.
Z toho plyne jasný závěr: pCR indikuje lepší prognozu !
Protože odpověď tumoru na předoperační chemoterapii koreluje s delším DFI a OS, je možné neoadjuvantní chemoterapii využít k testování účinnosti jednotlivých léků a režimů.
Výstupy budou hodnoceny po 5 ti a 10 ti letech sledování.
Studie prokázaly i korelaci biomarkerů s odpovědí tumoru na neoadjuvantní chemoterapii.
Prognostické tumor markery : ER, PgR, ploidita, S fáze, erbB2, p53, growth factor korelují (individuelně nebo v kombinacích) s odpovědí tumoru na léčbu, tudíž mohou mít tyto markery prognostickou hodnotu pro DFS a OS. Nadějné se do budoucna jeví využití těchto biomarkerů k identifikaci pacientek – po dosažení cCR-u kterých se dá vysoce pravděpodobně očekávat i pCR a u kterých je vhodné dále pokračovat chirurgií nebo RT.
Role neoadjuvantní CHT v léčbě operabilního karcinomu prsu je následující, může nahradit chemoterapii podávanou adjuvantně, zejména u pacinek, které si přejí provedení prs záchovného výkonu, tam, kde by původní rozměr tumoru byl pro primární
chirurgický výkon nevhodný.
Při určitém nadhledu je výhodou neoadjuvantní chemoterapie – oproti adjuvantní – navození klinické či i patologické regrese tumoru, což může být použito nejen jako prognostický faktor, ale i jako vodítko pro výběr následné adjuvantní systémové terapie. Uvedení taxanů a nových tříd chemoterapeutických agens s novými mechanismy účinku, které vykazují významnou antitumorózní aktivitu u pokročilých karcinomů prsu do praxe,
vede k možnosti podpořit další trialy, které se budou neoadjuvantní chemoterapií zabývat. Testovány jsou i nové varianty podání včetně dose dense režimů, sekvenčního podání atd., využívány jsou v kombinacích další látky jako např. vinorelbin, gemcitabin, trastuzumab.
Klinické trialy s taxany
Taxany vykazují vysokou účinnost zejména u pacientů antracyklin resistentních, jsou velice účinné v první linii MBC, celková odpověď je 30-60%. Z nežádoucích účinků je výrazná především neuropatie, která u cca 14% pacientů dosahuje G3-4.
Paclitaxel jako samostatné agens
Zkušenosti z MD Anderson (Buzdar et al.) randomizovaly 174 pacientů s T1-3, N0-1, pacienti obdrželi buď Paclitaxel po 3 týdnech 4x, s následnou chirurgií a aplikací FAC 4x nebo FAC 4x – chirurgie – adjuvantně FAC 4x. cCR byla v obou ramenech podobná, avšak
pacientů s pCR bylo více v rameni s pouze FAC režimem v poměru 17% vs. 8 %.
To vedlo k další studii - Greenově, která měla prověřit efekt standardně podávaného paclitaxelu v třítýdenním režimu ve srovnání s režimem týdenním.
Pacienti s negativními uzlinami (N-) obdrželi 80 mg/m2/wk/12x, s pozitivními uzlinami (N+) 150 mg/m2/wk vždy 3x s jedním týdnem pauzy, to vše 4x + 4x FAC. Srovnávací skupina obdržela u pacientek (N+ i N-) 225 mg paclitaxelu v 3 týdenním podání 4x + 4x FAC.
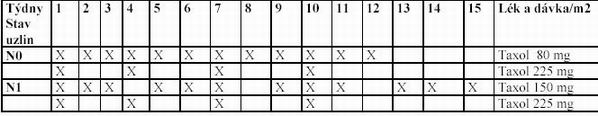
Týdenní podání paclitaxelu následované FAC zdvojnásobilo pCR ve srovnání s 3týdenním podáním Taxolu následovaného podáním FAC. (Prezentováno na ASCO 2002)
U pacientek N+ byla pCR (mamma i uzliny) prokázána u 28%pacientů v týdenním režimu, ve srovnání s 13,7% u pacientek v režimu standardním.
U pacientek s N- byla pCR prokázána ve 29,4% ve weekly podání, ve srovnání s 13,4% v podání třítýdenním.
Výsledky trialu demonstrují, že standardní dávky samotného paclitaxelu
v neoadjuvantním podání mají výraznou antitumorózní aktivitu, která je srovnatelná s FAC režimem. Avšak použití dose denze režimu poukazuje i na výrazné zvýšení pCR, a to v případě pacientek s pozitivními i negativními uzlinami. Týdenní podání mělo přitom zaznamenánu nižší nebo srovnatelnou toxicitu při podstatně lepší účinnosti.
Jedná se o důležitý pokrok v současném poznání, který by měl být povýšen na standard.!!!

PST – primery systemic therapy S - surgery
PAC – paclitaxel FAC – 5-FU, ADR, CFA
Na ASCO 2002 Fumoleau konstatuje, že dávka 80 mg/m2 v týdenním podání je nejlepším režimem pro neoadjuvantní chemoterapeutické režimy a že by tyto údaje mohly být extrapolovány pro adjuvantní podání.
Paclitaxel a doxorubicin
Tato kombinace byla testována v několika dalších studiích.. Kompletní klinická odpověď byla zaznamenána u 9% - 34% pacientek a pCR se vyskytovala v rozmezí 5% - 27,5 %.
Moliterni et al. léčil 309 pacientek s ADR nebo EPI v 3 týdenním režimu samostatně a prokázal 4% pCR. Při užití kombinace ADR nebo EPI + PAC v 3 týdenním režimu bylo zvýšení pCR minimální tj. na 5%.
Naproti tomu Semiglazov et al. užil ADR a PAC ve stejném režimu jako Moliterni et al. a získal 27,5% pCR. Vysvětlení pro tuto diferenci zatím neexistuje, neboť pacientky byly odpovídající věkem, stadiem tumoru, prognostickými parametry, léčebným režimem i
dávkováním.
!!! European Cooperative Trial (ECTO) Gianni et al. u operabilních karcinomů prsu,
jejichž rozměr nebyl větší nebo byl roven 2 cm randomizoval do následujících ramen:
group A) adjuvantně ADR + sekvenčně CMF
Group B) adjuvantně AT + následně CMF
Group C) AT + CMF předoperačně
Základní otázkou bylo, zda může přidání Taxolu k doxorubicinu, následované kombinací
CMF zlepšit výsledky oproti režimu ADR + CMF? Dále -. může kombinace AT následovaná CMF zlepšit dosavadní výsledky standardní adjuvantní chemoterapie?
Primární CHT vedla k 52% klinických odpovědí (27% po AT a 25 % po CMF). pCR byla prokázána u 23% pacientek a byla spojen v 87% s negativitou axillárních uzlin. Frekvence patologicky negativních uzlin byla ve skupině s neoadjuvancí signifikantně vyšší – (61% vs. 38%).
Vysoké % downstagingu vedlo k významné redukci RMME a k provedení 68% prs záchovných výkonů ve srovnání s 34% v rameni s adjuvantní CHT.
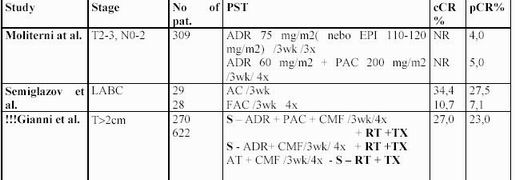
LABC – locally advanced breast cancer
Paclitaxel a epirubicin
Tato kombinace vede k RR v rozmezí 6,8 – 19%.
Ghilezan et al. například při užití EPI a PAC v 3 týdenním intervalu 5x, dosáhl pCR v 19%.
Chen et al.srovnává RR u dvou skupin pacientek, první užívala EPI a PAC den 1. a 8, druhá FAC ve standardním dávkování. pCR bylo srovnatelné v obou skupinách.
Paclitaxel v kombinaci s jinými cytostatiky
Potenciace kardiotoxicity kombinace PAC (paklitaxel) a ADR vedla k vývoji
nonantracyklinových režimů.
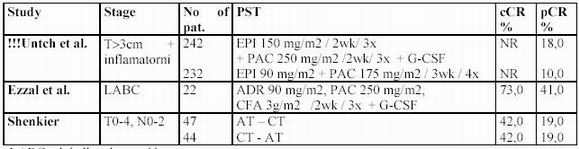
Ezat et al. kombinuje PAC s cis DDP a dosáhnul pCR u 20% pacientů. V rozsáhlejší studii o 122 pacientech, Rahal et al. při stejném režimu dokladuje 16% pCR.
V další studii u pacientek s T3-4 byl podán PAC a cis DDP nebo PAC a FAC. Nejednalo se o randomizovanou studii, ale v obou skupinách byly zařazeny pacientky se srovnatelnými charakteristikami (34 a 34 pacientek). pCR v oblasti prsu byla v platinovém rameni 24%
oproti 12% v rameni s FAC. pCR v mammě i uzlinách byla 15% vs. 6%.
Buzzi et al. užíval u pacientek s tumorem T2-3 primární chemoterapii v 8 týdenních aplikacích cisDDP, EPI a PAC s podporou G-CSF. pCR bylo zaznamenáno 17%, polovina z nich měla prokázanou i kompletní patologickou regresi v axillárních uzlinách.
pCR dosažené kombinací PAC a cisDDP vykazují lepší výsledky než kombinace PAC s ADR. Počet zařazených pacientek do studií je zatím ale velice malý.

PST primary systemic therapy
NR – no reported
Sekvenční užití paclitaxelu
!!!Untch et al. (AGO study) randomizoval 475 pacientek s pokročilým karcinomem prsu větším než 3 cm nebo inflamatorní do dvou skupin.
První obdržela 3 cykly epirubicinu 150 mg/m2 ve dvou týdenních intervalech 3x a následně paclitaxel 250 mg/m2 taky 3x s podporou G-CSF nebo 4 cykly kombinace EPI 90 mg/m2 a PAC 175 mg/m2 každé 3 týdny.
Předběžná data uvádějí zvýšení počtu prs záchovných operací v rameni A ve srovnání s ramenem B (66% vs.55%) a pCR jsou 18% v dose-dense sekvenčním rameni versus 10% ve standardním. Adjuvantně obdržely všechny pacientky CMF a RT.
Tato studie prokázala, že dose-dense režim se sekvenčním podáním EPI a PAC vede ke zvýšení frekvence konzervativních chirurgických výkonů a vyšší míře pCR v primárním tumoru i axillárních uzlinách. Lze předpokládat, že v sekvenční skupině bude dosaženo vyššího pěti i desetiletého přežití, nebylo shledáno rozdílů v toxicitě,
zejména v kardiotoxicitě.
-----------------------------------------------------------------------------------
Výsledky AGO studie dose-dense režim standardní režim
Konzervativní chirurgie 66% 55%
pCR 19% 10%
pN0 52% 41% (p<0,05)
-----------------------------------------------------------------------------------Fáze II studie (Ezzal, Rahal Ajarim et al.) s 22 pacienty užívala dose-dense sekvenční režim s podporou G-CSF. ADR 90 mg/m2 následovaná PAC 250 mg/m2 a pak CFA 3g/m2, které byly podávány v dvou týdenních intervalech vždy po 3 cyklech. Výsledky této malé
studie byly velice slibné, neboť byla zaznamenána kompletní klinická remise u 73% pacientek a ve 41% případů byla prokázána kompletní patologická remise v primárním tumoru i v uzlinách.
Shenkier at al. ve dvou studiích užil sekvenčně ADR + PAC (AT) /3wk/4x, za 3 týdny paclitaxel v eskalovaných dávkách a cisplatinu (tj. CT) každé 2 týdny 4x. pCR byly 21,4%. V následující studii byla testována důležitost sekvence AT-CT versus CTAT.
Výsledky v obou ramenech byly srovnatelné a vykazovaly 19% pCR.

LABC – lokally advanced breast cancer
Závěry:
Randomizované klinické studie prokázaly, že neoadjuvantní systémová terapie vede ve velkém procentu případů ke zmenšení primárního tumoru i axillárních uzlin, čímž výrazně zvyšuje šanci žen na provedení konzervativního prs šetřícího výkonu.
DFS a celkové přežívání je stejné ve srovnání při použití předoperační a pooperační chemoterapie.
Objevuje se nová generace studií, které hodnotí různé léčebné strategie se začleněním nových cytostatik a užitím nových režimů. Trendem jsou zejména taxany, ale též platinové deriváty v kombinaci s již tradičními antracykliny, dále pak užití dose-dense režimů event.
v sekvenčním podání. Zejména naposledy zmíněné režimy resultují v signifikantně vyšší procento pCR, které mají vliv i na DFS a celkové přežívání. Optimální režim nebyl zatím definován
Náš soubor
Na základě výsledků proběhlých studií jsme u pacientek s pokročilým karcinomem prsu stadia T2-T4, N0-2 aplikovali předoperačně neoadjuvantní chemoterapii režimem antracyklin (doxorubicin nebo epirubicin) + paclitaxel, v týdenním podání ve 12 cyklech.
Dávkovací režim byl: ADR 15 mg/m2 nebo EPI 20 mg/m2 + Taxol 80 mg/m2. Všechny pacientky měly před zahájením chemoterapie provedenou histologickou verifikaci nádoru z tru-cut biopsie, kompletní stagingová vyšetření, při kterých nebyla prokázána diseminace, ekg a echokardiologické vyšetření k posouzení EF LK.
Vylučovací kritéria: špatný celkový stav pacientky (KI pod 80%), četné interkurence a nízké hodnoty EFLK pod 54%.
Do souboru byl prováděn nábor od 9/03 do 10/04, zařazeno bylo 24 žen ve věku 38 – 76 let, s průměrem 55 let a mediánem 54 roků. Nejčastější lokalizací byl ZHK (52%), stranové rozložení bylo homogenní.
Dle velikosti primárního tumoru bylo rozdělení následující: 25% žen s tumorem T2, 20,8% žen s tumorem T3 a 54,2% žen s tumorem T4. Uzliny byly klinicky i UZ pozitivní v 71% případů. Histologie invazivní duktální karcinom byla prokázána u 75% žen, invazivní lobulární karcinom u 16,7% žen, invazivní smíšený karcinom se vyskytnul u 1 ženy tj. 4,2%, 1x tj. opět 4,2% byl karcinom blíže nespecifikovatelný tj. anaplastický.
Grading st. 1: 1x (tj. 4,2%), u 11 žen grading 2 (45,8%), u 9 žen stupně 3 (37,5%), 3x nebyl z tru-cut biopsie blíže udán tj. u 12,5%. Pozitivita obou steroidních receptorů se vyskytovala u 50% žen, přičemž 71,5% žen bylo pre- či perimenopauzálních (dohromady 15 žen).
V průběhu terapie byly 3 pacientky ukončeny předčasně. Jedna pro významnou hematologickou toxicitu po 2 sériích (následně byla pacientka hospitalizována pro febrilní neutropenii) a v chemoterapii již nebylo pokračováno. Následně podstoupila RMME a v současnosti je pro nepříznivé prognostické parametry (11 pozitivních uzlin ze 17(4 přes
pouzdro), G3, angioinvaze, ypT2, negativita SR, HER 2 ++), indikována k adjuvantní systémové léčbě a RT.
2 pacientky byly ukončeny pro zdánlivě nulovou odpověď na léčbu a to po 6 sériích chemoterapie ( na základě diagnostických vyšetřovacích metod - dvourozměrně). Jedna z těchto pacientek - s tumorem původně T2 – následně podstoupila parcielní ME a při porovnání volumometrických hodnot z UZ před zahájením terapie a z definitivního
histopatologického vyšetření, byla zaznamenána regrese 68% objemu tumoru.
Druhá pacientka, která byla přerušena v polovině cyklu přišla původně s tumorem T4b, který zdánlivě na léčbu nereagoval proto podstoupila radikální radioterapii a s odstupem 2 měsíců též operační výkon (při hodnocení UZ před zahájením léčby a po 6ti měsících léčby
ve 3 rozměrech však šlo o 50% regresi). U této pacientky byla pooperačně zaznamenána pCR.
Ze zbývajících 21 žen léčbu neoadjuvantní chemoterapií k dnešnímu datu ukončilo 18 a 16 z nich je již po provedeném chirurgickém výkonu. U těchto pacientek můžeme tedy předběžně vyhodnotit efektivitu aplikovaného režimu a akutní nežádoucí účinky podávané terapie.
Regresi primárního tumoru jsme vyhodnocovali nejen palpačně, ale i ultrazvukově, kvůli lepší objektivizaci zmenšení původního nálezu. Měření na UZ bylo prováděno před zahájením terapie, po skončení 6. a 12. série chemoterapie a to ve všech 3 rozměrech. Následně byly k posouzení efektu hodnoceny procentuelní volumometrické změny ve smyslu regrese primárního nádoru. Po provedeném chirurgickém výkonu byla zjišťována korelace s histopatologickým výsledkem vyšetření.
V našem souboru hodnotitelných 18 pacientek byla prokázána následující regrese.
Z toho UZ volumometrických regresí nad 90 % bylo 61% (11 pacientek).
Parcielní výkon byl proveden u 59 % žen.
Nežádoucí účinky:
Hematologické:
vážný stupeň leukopenie st. 4 byl zaznamenán u jedné pacientky, s febrilní neutropenií, která již byla referována (z původního počtu započatých pacientek by se jednalo o 4,2%), vzhledem
k tomu, že absolvovala pouze dva cykly CHT, nebyla již dále hodnocena, je nutno ji ale v případě NÚ znovu zmínit.
Dále je již opět vycházeno z počtu 18 hodnocených pacientek. Stupeň 3 (1 - 1,9) byl zaznamenán 2x (tj. 11%), stupeň 2 (2 - 2,9) též 2x. Anemie stanovená dle hladiny Hb:
stupeň 2 (80-94) 1x tj. 5,5%, stupeň 1 (95-109) 4x tj. 22,2%, vyšší stupně toxicity nebyly zaznamenány. Trombocytopenie v 0 % případů , žádného stupně.
Nehematologické:
Alopecie se vyskytovala ve 100% případů a byla vždy reverzibilní. Nausea a vomitus byly přítomny v 50% a 11% případů. Parestezie stupně 2 udávalo 33,3% žen, mírného stupně 1 – 72% žen. Myalgie st. 2 udávalo 22,2, % žen, stupně 1 44,4%. Arthralgie´st. 2 27,7% žen a
stupně 1 55,5% žen. Alergické projevy mírného stupně se objevily ve 44,4%, nevyžadovaly trvalé přerušení léčby. Změny nehtových lůžek byly patrny u 27, 7% pacientek.
Závěrem:
Do souboru byly zařazeny ženy s lokálně pokročilým onemocněním, které by jinak vzhledem k velikosti či stadiu tumoru musely podstoupit radikální modifikovanou mastectomii nebo by vůbec k chirurgickému výkonu indikovány nebyly (všechna stadia T4 – tj. 54% žen). Při použití neoadjuvantní chemoterapie s weekly podáním AT došlo v 94,5% ke klinické regresi tumoru minimálně o 50%, přičemž regrese více než 90%
byla zaznamenána u 61% žen. Přestože patologických kompletních regresí bylo pouze 11%, mohla více jak polovina pacientek absolvovat prs záchovný výkon – 59% žen.
Zaznamenaná toxicita byla přijatelná, pouze v jednom případě z 24 (4%) byla zaznamenána febrilní neutropenie s leukopenií st. 4, která vyžadovala intenzivní péči.
Výsledky v zásadě korelují s údaji randomizovaných studií a potvrzují vysoký účinek neoadjuvantní chemoterapie u lokálně pokročilých karcinomů prsu v případě použití kombinace antracyklin + taxan v dose dense režimu.
Dalším úkolem je umět předikovat, u kterých žen by tento způsob léčby byl nejvhodnější. Ukazuje se, že roli bude hrát věk, celkový stav pacientky, grading, pozitivita či negativita steroidních receptorů, proliferační aktivita, HER2 pozitivita.
Datum přednesení příspěvku: 7. 1. 2005





