Konference: 2011 2. pražské mezioborové onkologické kolokvium
Kategorie: Zhoubné nádory prsu
Téma: Prezentace
Číslo abstraktu: 004
Autoři: prof. MUDr. Petra Tesařová, CSc.
Neoadjuvantní léčba je systémová onkologická terapie předřazená
lokálnímu zákroku, vedoucímu k místnímu odstranění zhoubného
nádoru.
Existuje několik důvodů k její indikaci:
- Preklinické modely léčby i výsledky klinických studií dokazují, že předoperační chemoterapie je pro organismus biologicky příznivější než pooperační a znamená stejný přínos pro zlepšení celkového přežití jako léčba adjuvantní.
- Neoadjuvantní léčba může zmenšit původní nádor tak, že pacientka nemusí podstoupit ablaci, ale prs šetřící výkon.
- Klinické hodnocení změny velikosti nádoru a obdobné hodnocení pomocí zobrazovacích metod umožňuje včas detekovat rezistenci nádoru ke zvolené léčbě, a tím se vyvarovat podání neúčinné léčby, která by pacientku mohla poškodit nežádoucí toxicitou.
- Časné podání systémové léčby umožní dobrou distribuci léku do nádoru prostřednictvím intaktního cévního zásobení.
Existují ale i určitá úskalí:
- Méně než 5 % pacientek s lokálně pokročilým karcinomem prsu, které se podrobí neoadjuvantní systémové léčbě, při ní progreduje. Pro tyto nemocné a pro ty, u kterých nemá neoadjuvance žádný efekt, znamená volba předoperační léčby zdržení kurativního chirurgického zákroku.
- Předoperační chemoterapie může teoreticky indukovat časnou rezistenci k léčbě.
- Neoadjuvantní terapie by mohla zvyšovat riziko chirurgických a poradiačních komplikací, což ale nebylo nikdy potvrzeno.
V praxi tedy převažují výhody neoadjuvantní terapie nad nevýhodami,
a neoadjuvance je tedy standardním léčebným postupem pro pacientky
klinického stadia III karcinomu prsu (Stále více se ale uplatňuje i
u operabilních nádorů nepříznivé biologické charakteristiky, tedy u
nádorů s vysokou růstovou aktivitou, vysokým grade, HER2
pozitivitou, to znamená nádorů s vysokým rizikem metastazování. U
těchto nemocných je systémová léčba pro osud nemocné významnější
než terapie lokální.)
Neoadjuvantní terapie je obvykle součástí multimodální léčby. V
průměru 75 % žen dosáhne indukční léčbou významné odpovědi
primárního nádoru a skoro polovina z nich dokonce tzv. zobrazovací
remise, tedy stavu, kdy nádor není pomocí zobrazovacích metod
detekovatelný. Polovina až dvě třetiny nemocných v zobrazovací
remisi patří mezi ty šťastné pacientky, u kterých může patolog při
histologickém vyšetření konstatovat tzv. patologickou kompletní
remisi, tedy úplné vymizení invazivního nádoru z prsu a spádových
uzlin. Neoadjuvantní chemoterapie může změnit klinicky pozitivní
postižení axilárních uzlin na patologicky negativní (pN0), což se
dle výsledků klinických studií podaří ve 23-38 %.
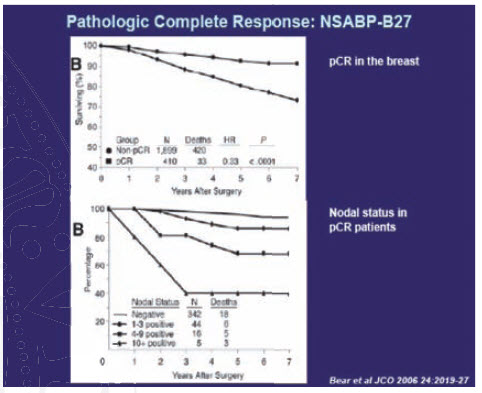
Řada studií také dokládá statisticky významnou souvislost mezi
dosažením patologické kompletní remise a prodloužením doby bez
nemoci (DFS - disease free survival) i celkovým přežitím (OS -
overall survival) (Obrázek 1). Pacientky s negativitou původně
pozitivních uzlin dopadají po neoadjuvantní chemoterapii lépe než
pacientky s pozitivními uzlinami, přičemž riziko rekurence a smrti
roste proporcionálně s počtem reziduálních patologických
uzlin.
Obrázek 1 Celkové přežití a patologická kompletní remise primárního
nádoru a uzlinového postižení
Neoadjuvantní chemoterapie
Počet léčebných cyklů ani typ chemoterapie není striktně určen,
protože závisí na odpovídavosti nádoru, ale pokud si klademe za cíl
co nejúčinnější redukci nádoru, je rozumné indikovat předoperačně
kompletní chemoterapii, odpovídající typu i délce trvání
adjuvance.
Hormonální neoadjuvance
U zhoubných hormonálně dependentních lokálně pokročilých karcinomů
prsu postmenopauzálních žen je možné dosáhnout úspěchu také
indukční hormonální léčbou tamoxifenem nebo inhibitorem aromatázy.
Daleko méně než u neoadjuvantní chemoterapie je jasné, jaké
procento kompletních patologických remisí lze hormonální léčbou
dosáhnout a jaká je souvislost mezi úspěchem léčby a celkovým
přežitím.
Optimální lokoregionální léčba
Po indukční neoadjuvantní léčbě je třeba zvolit správný způsob
lokoregionální terapie, a to na základě hodnocení efektu léčby
pomocí zobrazovacích metod (mamografie, ultrasonografie, NMRI).
Vzhledem k vysoké úspěšnosti neoadjuvantní léčby provádíme po jejím
prvním cyklu časnou kontrolu efektu k eventuální indikaci značení
místa nádoru (tuš, kovový klip atp.) pro zacílení a maximální
šetrnost operace. Při indikaci operace vycházíme vždy z původního
rozsahu onemocnění (vstupní infiltrace uzlin - exenterace axily,
inflamatorní karcinom - ablace atp.)
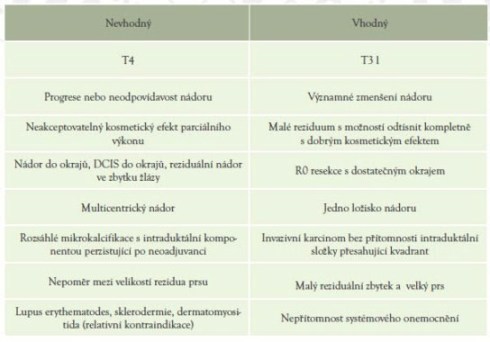
Pro 50-90 % nemocných s lokálně pokročilým karcinomem prsu je
vhodný prs šetřící chirurgický výkon (Tabulka 1).
Klinická odpověď na neoadjuvantní léčbu
Kritéria obecně přijímaná k hodnocení odpovědi
WHO/UICC kritéria (World Health Organization/International Union
Against Cancer) užívaná více než 20 let definují klinickou remisi
(CR) jako úplné vymizení všech klinických známek nádoru v prsu i v
regionálních uzlinách. Parciální neboli částečná odpověď (PR) je
definovaná jako > 50% redukce velikosti nádoru ve dvou
nejdelších kolmých rozměrech nádoru. Progrese potom jako > 25%
zvýšení velikosti nádoru ve dvou nejdelších kolmých průměrech nebo
objevení se nových lézí.
Tzv. RECIST kritéria (Response Evaluation Criteria in Solid Tumors)
se používají v rámci řady klinických studií. Definice CR se neliší
od WHO kritérií, PR je popisovaná jako 30% zmenšení nejdelšího
průměru. K vyloučení subjektivních chyb při klinickém hodnocení
slouží posuzování změn velikosti nádoru pomocí zobrazovacích metod
- mamografie, ultrazvuku, NMR, PET s využitím stejných pravidel
hodnocení. Jedině biopsie je ale schopná rozhodnout o tom, zda
nemocná dosáhla patologické kompletní remise (pCr), tedy stavu, kdy
i v hodnocení tkáně prsu mikroskopem došlo k úplnému vymizení
invazivního zhoubného nádoru.
Tabulka 1: Kritéria prs šetřícího výkonu po neoadjuvantní léčbě
lokálně pokročilého karcinomu prsu
Vliv neoadjuvantní léčby na celkové přežití
Odpověď primárního nádoru i uzlinového postižení je předpokládanou
analogií efektu systémové adjuvantní léčby na případné vzdálené
metastázy. Dosažení pCr po neoadjuvanci je tak významným úspěchem,
protože dává nemocné naději na úplnou úzdravu a v případě, že má
pacientka nádor s paralelním způsobem metastazování, pak je
neoadjuvantní léčba jedinou možností, která u této nemocné může
vést k uzdravení.
Neoadjuvantní versus adjuvantní chemoterapie
Řada randomizovaných studií porovnává efekt neoadjuvantní a
adjuvantní chemoterapie u pacientek s lokálně pokročilým karcinomem
prsu. Obecně je výsledek obou přístupů stejný.
Tabulka 2 Nejčastější chemoterapeutické režimy užívané v
neoadjuvanci

Klikni pro zvětšení tabulky
Volba chemoterapeutického režimu (Tabulka 2)
Většina doporučení se přiklání k zahájení neadjuvantní léčby pomocí
antracyklinového režimu (AC, FEC, FAC). U pacientek s pozitivními
spádovými uzlinami využíváme především režimů s taxány, a to ve
dvou nejčastějších podobách. Prvním je sekvenční režim, kdy po
antracyklinech ve 4 cyklech následuje monoterapie docetaxelem nebo
paclitaxelem, jehož výhodou je možnost nezávislého posouzení
účinnosti obou po sobě podávaných medikací a eventuální překonání
rezistence na antracykliny. Druhou možností je kombinovaný režim
taxánů s antracykliny (ET, AT, TAC).
Není zcela jasné, zda je účinnější sekvenční nebo simultánní
podávání taxánů, ale přínos sekvence prokázala studie s 913
nemocnými léčenými pro operabilní karcinom prsu (T2-3 N0-2, M0)
dosedenzní chemoterapií 4 x AT versus 4 x AC se sekvenčním podáním
4 x docetaxel. Sekvenční podání bylo spojeno s dvojnásobným
zvýšením pCr (14 versus 7 %).
Pokud se podávají taxány v neoadjuvanci, preferujeme tedy sekvenční
režim.
Optimální časování taxánů prověřovala také řada klinických studií.
Výsledek studie SWOG 0012 prokázal větší přínos weekly režimu s
paclitaxelem než jeho podávání v třínedělním intervalu. Léčba
docetaxelem je naopak na základě výsledků studií doporučovaná
jedenkrát za 3 týdny jako efektivnější.
Role trastuzumabu v neoadjuvanci
Asi 15-20 % lidských karcinomů prsu vykazuje amplifikaci nebo
overexpresi HER2. Trastuzumab se jako humanizovaná monoklonální
protilátka váže na specifický epitop HER2 proteinu a působí
destrukci nádorové buňky. Protinádorový efekt se zvyšuje v
kombinaci s chemoterapií, což prokázala řada studií u pacientek s
metastatickým HER2 dependentním karcinomem prsu, ale i v adjuvanci.
Nepochybný účinek a příhodný bezpečnostní profil trastuzumabu v
klinických studiích u metastatického nádoru prsu byly důvodem
zavedení trastuzumabu do adjuvantní léčby.
Na základě výsledků dosavadních studií doporučují zodpovědné
autority (např. NCCN - National Comprehensive Cancer Network)
podání trastuzumabu po dobu 1 roku po dokončení chemoterapie s
antracykliny nebo po kompletní chemoterapii, buď společně s taxány
nebo v monoterapii. Krátkodobá a dlouhodobá kardiotoxicita
představuje zásadní limitaci podání adjuvantního trastuzumabu.
Dalším významným omezením trastuzumabu je neschopnost pronikat přes
hematoencefalickou bariéru, a to vzhledem k přílišné velikosti
molekuly.
Centrální nervový systém je tedy nejčastějším místem relapsu nádoru
s vývojem mozkových metastáz. Nehledě na známé přesvědčivé důkazy o
podání trastuzumabu v neoadjuvanci nebyl donedávna v této indikaci
standardně používán. Ve studii fáze III NOAH (Neo-Adjuvant
Herceptin) italských autorů bylo zařazeno 228 pacientek s lokálně
pokročilým karcinomem prsu včetně inflamatorního nádoru. K
neodajuvantní chemoterapii s antracykliny a taxány byl přidán
trastuzumab, 3letá doba bez známek nemoci byla v kombinovaném
rameni 70 % v porovnání s 53 % v rameni s chemoterapií samotnou, to
znamená, že relativní riziko rekurence bylo po přidání trastuzumabu
téměř poloviční (hazard ratio 0,56; P = 0,006). Po přidání
trastuzumabu dosáhlo patologické kompletní remise téměř 2 x více
nemocných než s chemoterapií samotnou (39 % vs. 20 %; P = 0,002).
Celková odpověď byla také vyšší v kombinovaném rameni 89 % vs. 77 %
(P = 0,02). Zlepšení celkového přežití v rameni s trastuzumabem
nebylo zatím signifikantní. Další významnou klinickou studií, která
řešila otázku neoadjuvantní biochemoterapie, byla německá studie
Geparquattro. Pacientky (1509) s operabilním nebo lokálně
pokročilým karcinomem prsu byly léčeny neoadjuvantně 4 cykly EC
(epirubicin, cyklofosfamid) a potom 4 cykly docetaxelu s
kapecitabinem nebo bez něj a s trastuzumabem v obvyklém dávkování,
pokud byly HER2 pozitivní. U 445 nemocných s HER2 pozitivitou bylo
neoadjuvantní chemoterapií s trastuzumabem dosaženo patologické
kompletní remise ve 31,7 %, u pacientek HER negativních bylo léčbou
bez trastuzumabu dosaženo stejného efektu jen u 15,7 %. HER2
pozitivní nemocné, které nereagovaly na úvodní dva cykly
antracyklinové neoadjuvance, při další léčbě s trastuzumabem
dosáhly překvapivě vysoké procento pCr (16,6 %) na rozdíl od HER
negativních nereagujících nemocných (3,3 %). Procento dosažených
konzervativních chirurgických výkonů se v obou skupinách nijak
nelišilo (63,1 % vs. 64,7 %).
Závěr
Kombinovaná multimodální onkologická léčba je standardem terapie
pro lokálně pokročilý karcinom prsu včetně inflamatorního a
představuje neoadjuvantní systémovou chemoterapii doplněnou při
HER2 pozitivitě trastuzumabem, následovanou operačním řešením a
eventuálně radioterapií a hormonální léčbou při pozitivitě
hormonálních receptorů.
Hormonální neoadjuvantní léčba je účinná u hormonálně dependentních
karcinomů prsu, ale měla by být určena pouze pro postmenopauzální
pacientky v celkově špatném stavu, s vysokým rizikem operačního
zákroku.
Jedním z cílů neoadjuvantní systémové léčby je i dosažení lepšího
kosmetického efektu operace, pro primárně diagnostikovaný
inflamatorní karcinom prsu je ale jedinou operační možností ablace.
Neoadjuvantní léčbu zahajujeme, pokud nemá nemocná kontraindikaci,
antracyklinovým režimem (zpravidla 4 cykly) s kontrolu efektu léčby
a případným značením lůžka tumoru.
V neoadjuvanci preferujeme zařazení taxánů v sekvenci, docetaxelu v
režimu po 3 týdnech (4 x), paclitaxelu ve weekly režimu (12 x).
Nemocným, které na neoadjuvantní léčbu nereagují a jejich nádor je
inoperabilní, je doporučovaná radioterapie následovaná chirurgickým
zákrokem.
U pacientek s HER2 pozitivním nádorem je plně indikované zařadit
léčbu trastuzumabem do neoadjuvantního režimu co nejdříve s
vědomím, že nemocné můžeme zásadně prospět zvýšením šance na
dosažení patologické kompletní remise.
V trastuzumabu pokračujeme po operaci do 12 měsíců celkového
podávání v rámci adjuvance.
Na základě výsledků klinických studií jsou k neoadjuvantní léčbě
indikovány vybrané nemocné s primárně operabilním karcinomem prsu,
které jsou významně ohroženy rychlou generalizací (žena < 35
let, KI 67 > 50, G3, lymfangioinvaze, angioinvaze, perineurální
šíření, N2 atp.).
Literatura
- Schwartz GF, Hortobagyi GN. Proceedings of the consensus conference on neoadjuvant chemotherapy in carcinoma of the breast, April 26-28, 2003,Philadelphia, Pennsylvania. Cancer 2004; 100:2512.
- Thomas E, Holmes FA, Smith TL, et al. The use of alternate, non-cross-resistant adjuvant chemotherapy on the basis of pathologic response to a neoadjuvant doxorubicin-based regimen in women with operable breast cancer: long-term results from a prospective randomized trial. J Clin Oncol 2004; 22:2294.
- Shenkier T, Weir L, Levine M, et al. Clinical practice guidelines for the care and treatment of breast cancer: 15. Treatment for women with stage III or locally advanced breast cancer. CMAJ 2004; 170:983.
- Reynoso D, Subbiah V, Trent JC, Guadagnolo BA, Lazar AJ, Benjamin R , Pollock RE, Ludwig JA. Neoadjuvant treatment of soft-tissue sarcoma: a multimodality approach.J Surg Oncol. 2010 Mar 15;101(4):327-33.
- Smith IC, Heys SD, Hutcheon AW, et al. Neoadjuvant chemotherapy in breast cancer: significantly enhanced response with docetaxel. J Clin Oncol 2002;20:1456.
- Heys SD, Sarkar T, Hutcheon AW. Primary docetaxel chemotherapy in patients with breast cancer: impact on response and survival. Breast Cancer Res Treat 2005; 90:169.
- Ellis MJ, Tao Y, Luo J, et al. Outcome prediction for estrogen receptor-positive breast cancer based on postneoadjuvant endocrine therapy tumor characteristics. J Natl Cancer Inst 2008; 100:1380.
- Sinclair S, Swain SM. Primary systemic chemotherapy for inflammatory breast cancer. Cancer. 2010 Jun 1;116(11 Suppl):2821-8.
- Colleoni M, Viale G, Goldhirsch A. Lessons on responsiveness to adjuvant systemic therapies learned from the neoadjuvant setting. Breast. 2009 Oct;18 Suppl 3:S137-40.
- Guarneri V, Broglio K, Kau SW, et al. Prognostic value of pathologic complete response after primary chemotherapy in relation to hormone receptor status and other factors. J Clin Oncol 2006; 24:1037.
- Hennessy BT, Hortobagyi GN, Rouzier R, et al. Outcome after pathologic complete eradication of cytologically proven breast cancer axíllary node metastases following primary chemotherapy. J Clin Oncol 2005; 23:9304.
- Thomas E, Holmes FA, Smith TL, et al. The use of alter nate, non-cross-resistant adjuvant chemotherapy on the basis of pathologic response to a neoadjuvant doxorubicin-based regimen in women with operable breast cancer: long-term results from a prospective randomized trial. J Clin Oncol 2004; 22:2294.
- Mauri D, Pavlidis N, Ioannidis JP. Neoadjuvant versus adjuvant systemic treatment in breast cancer: a meta-analysis. J. Natl Cancer Inst 2005; 97:188.
- Bear HD, Anderson S, Smith RE, et al. Sequential preoperative or postoperative docetaxel added to preoperative doxorubicin plus cyclophosphamide for operable breast cancer: National Surgical Adjuvant Breast and Bowel Project Protocol B-27. J Clin Oncol 2006; 24:2019.
- Ellis GK, Barlow WE, Russell CA, et al. SWOG 0012, a randomized phase III comparison of standard doxorubicin (A) and cyclophosphamide (C) followed by weekly paclitaxel (T) versus weekly doxorubicin and daily oral cyclophosphamide plus G-CSF (G) followed by weekly paclitaxel as neoadjuvant therapy for inflammatory or locally advanced breast cancer (abstract). J Clin Oncol 2006; 24:12s.
- Chang HR. Trastuzumab-based neoadjuvant therapy in patients with HER2-positive breast cancer. Cancer. 2010 Jun 15;116(12):2856-67.
- Iwata H. Neo(adjuvant) trastuzumab treatment: current perspectives. Breast Cancer 2009;16(4):288-94. Epub 2009 Jul 17.
- Gianni L, Eiermann W, Semiglazov V, Manikhas A, Lluch A, Tjulandin S, Zambetti M, Vazquez F, Byakhow M, Lichinitser M, Climent MA, Ciruelos E, Ojeda B, Mansutti M, Bozhok A, Baronio R, Feyereislova A, Barton C, Valagussa P, Baselga J. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant t rastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet 2010 Jan 30;375(9712):377-84.
- Dawood S, Gong Y, Broglio K, Buchholz TA, Woodward W Lucci A, Valero V, Gonzalez-Angulo AM, Hortobagyi GN, Cristofanilli M. Primary Inflammatory Breast Cancer (IBC): High Pathological Response Rates and Improved Outcome. Breast J 2010 Jul 6.
- Untch M, Rezai M, Loibl S, Fasching PA, Huober J, Tesch H, Bauerfeind I, Hilfrich J, Eidtmann H, Gerber B, Hanusch C, Kúhn T, du Bois A, Blohmer JU, Thomssen C, Dan Costa S, Jackisch C, Kaufmann M, Mehta K, von Minckwitz G. Neoadjuvant treatment with trastuzumab in HER2-positive breast cancer: results from the GeparQuattro study J Clin Oncol 2010 Apr 20;28(12):2024-31.
doc. MUDr. Petra Tesařová, CSc.
Onkologická klinika 1. LF UK a VFN, Praha
email:petra.tesarova@lfl.cuni.cz
Datum přednesení příspěvku: 28. 1. 2011





