Konference: 2014 19. ročník sympózia Onkologie v gynekologii a mammologii
Kategorie: Zhoubné nádory prsu
Téma: Neoadjuvantní chemoterapie karcinomu prsu a její dopad na další terapeutické modality
Číslo abstraktu: 013
Autoři: MUDr. Renata Neumanová, Ph.D., MBA; prof. MUDr. Jiří Petera, Ph.D.
Karcinom prsu je v České republice nejčastějším zhoubným nádorem žen. Ročně jím u nás onemocní kolem 120 ze 100 000 žen, což v absolutních číslech znamená cca 6600 žen ročně. Podobná situace je však i v ostatních vyspělých zemích a během roku se na celém světě diagnostikuje několik milionů nových případů.
Přestože výskyt karcinomu prsu u žen stále stoupá, úmrtnost na tuto diagnózu se snižuje. V posledních letech se výrazně podařilo zlepšit léčebné výsledky tohoto typu nádoru u žen a to jednak díky zvýšenému záchytu v jeho časných stadiích v souvislosti s preventivními vyšetřeními a dále díky novým možnostem léčby, které jsou důsledkem výzkumů, týkajících se molekulárně biologických charakteristik nádorů.
Karcinom prsu je onemocnění sta tváří (jedná se o morfologicky a geneticky velmi heterogenní onemocnění) a jeho dělení na podskupiny podle klinicko-patologických parametrů není dostatečným vodítkem pro volbu léčebné strategie. Molekulární klasifikace nám pomáhá rozlišit nádory stejného histologického obrazu, které však mohou mít odlišnou biologickou charakteristiku a díky tomu budou pravděpodobně i různě odpovídat na léčbu. K léčbě karcinomů prsu je tedy nutné přistupovat přísně individuelně. Neodmyslitelnou roli při vytváření základní léčebné strategie mají v dnešní době indikační komise, tvořené týmy odborníků, kteří se na léčbě podílejí.
Jednou z možných léčebných strategií je zahájení terapie neoadjuvantní systémovou léčbou. Ta byla původně vyhrazena jen pro inflamatorní karcinomy a lokálně pokročilé formy onemocnění, u kterých byl primární chirurgický výkon kontraindikován, a to nejen v případech technicky inoperabilního nádoru. Hlavním důvodem je fakt, že tato primární (indukční) chemoterapie může konvertovat i nádory technicky inoperabilní na operabilní a nebo (v některých případech) může vést k významné regresi lokálně pokročilého nádoru, která následně umožní prs šetřící výkon.
Dalším důvodem použití této strategie byl předpoklad likvidace mikrometastáz a snaha dosažení lepšího přežití u žen s pokročilejší formou onemocnění. Tato hypotéza však nebyla dosud potvrzena a zatím proběhlé a uzavřené studie (jednou z největších byla studie NSABP B18) dokládají skutečnost, že u žen s operabilním tumorem prsu je rozdíl v dlouhodobém přežití (DFS i OS) po neoadjuvantní či adjuvantní chemoterapii nesignifikantní. Závěry potvrdila i následná metaanalýza.
Dalším přínosem použití primární systémové léčby je i možnost rychlého vyhodnocení efektu podané terapie, která nám umožňuje hodnotit senzitivitu různých typů nádorů na podanou terapii. Zatímco výsledky hodnocení efektu adjuvantní léčby je možné řádově v letech, v případě neoadjuvance jsme schopni hodnotit výsledky „prakticky okamžitě“, tj. v řádu několika málo měsíců (4 – 6 měsíců). Další výhodou časně podané systémové léčby je dobrá distribuce léku do nádoru, díky intaktnímu cévnímu zásobení.
Klinické hodnocení změny velikosti nádoru a taktéž hodnocení efektu léčby v průběhu terapie pomocí UZ může pomoci zjistit rezistentní typy nádorů k dané léčbě a uchránit tak ženu před zbytečnými nežádoucími účinky této terapie. Nicméně v těchto případech pak podání neoadjuvantní chemoterapie znamená pro ženu odklad chirurgického výkonu.
V průběhu let se tento léčebný algoritmus postupně dostává i do léčby méně pokročilých, operabilních tumorů, s nepříznivou biologickou charakteristikou (vysoký grade, vysoký proliferační index, HER2-pozitivita …).
Neoadjuvantní léčba u lokálně pokročilých stadií IIIA, IIIB, IIIC a inflamatorních karcinomů je léčbou první volby, dále by měla být zvažována u nemocných v klinickém stadiu IIA a IIB.
S podáním iniciační systémové léčby a jejím efektem na tumor (zejména primárně operabilní) je však spjata i řada otazníků, které se týkají především následujících oblastí:
- které ženy a s jakým typem tumoru budou nejvíce profitovat z primárního podání systémové léčby ?
- jakou iniciační systémovou léčbu použít a jak dlouho ji podávat ?
- kdy a jak přistoupit ke značení tumoru ?
- které faktory jsou při hodnocení efektu léčby rozhodující pro následnou prognózu nemocných ?
- Jaká je definice kompletní patologické odpovědi ?
- jaký zvolit následně rozsah operačního výkonu (v prsu, v axile) a jaký při cCR ?
- jaké jsou následně indikace radioterapie ?
- podávat ještě adjuvantní systémovou terapii ?
OTÁZKY A ODPOVĚDI
- které ženy a s jakým typem tumoru budou nejvíce profitovat z primárního podání systémové léčby ?
Po podání předoperační chemoterapie bylo v klinických studiích dosahováno 49-93 % objektivních léčebných odpovědí. Při použití chemoterapie s antracykliny a taxany je u neselektovaných pacientek dosahováno 4-30% patologických kompletních regresí (pCR). Tab. č. 1
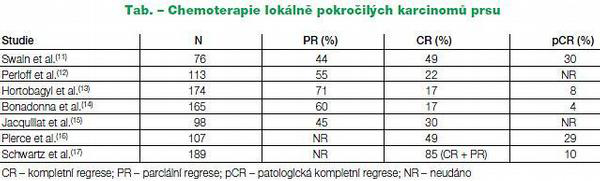
Nejlepším prediktivním markerem odpovědi na chemoterapii je negativita hormonálních receptorů. U těchto typů nádorů lze neoadjuvantní chemoterapií dosáhnout až 40% pCR. Na základě výsledků některých klinických studií lze horší odpověď neoadjuvantní chemoterapie předpokládat u lobulárního invazivního karcinomu ve srovnání s non-lobulárními invazivními karcinomy. Lobulární karcinomy jsou naopak citlivější na hormonální léčbu.
Hlavními adeptkami na neoadjuvantní chemoterapii jsou tedy ženy, jejichž nádor vykazuje primárně špatné prognostické faktory a nepříznivé biologické parametry např. nízké nebo negativní estrogenové (ER) a progesteronové (PR) receptory, nádory s vysokým gradem, non-lobulární invazivní karcinomy, karcinomy s vysokou proliferací, typ luminal B, nádory HER 2 pozitivní nebo triple negativní.
- jakou iniciační systémovou léčbu použít a jak dlouho ji podávat ?
V současné době neexistuje jediný režim neoadjuvantní chemoterapie, který by bylo možno označit za všeobecně přijatý standard. Neoadjuvantní chemoterapie karcinomu prsu by však měla být (je-li to možné) založena na kombinaci antracyklinů a taxanů, optimálnější se jeví podání v sekvenčním režimu. Doporučuje se podat nejméně 6 cyklů chemoterapie v rozmezí 4 až 6 měsíců. Chemoterapie má být ukončena před operací. Optimální doba vyhodnocení léčebné odpovědi je za 6–9 týdnů po zahájení léčby.
V případě nádorů s vysokou expresí HER-2 je indikováno podání trastuzumabu v kombinaci s chemoterapií. U triple negativních tumorů se jeví jako účinná intensivnější chemoterapie a deriváty platiny. U nádorů s vysokou proliferační aktivitou, pokud to dovoluje celkový stav nemocné, je možné zvolit i dose dense režimy.
U HER 2 pozitivních tumorů je dnes již standardem přidání trastuzumabu k běžné chemoterapii, což dle výsledků studií zvýšilo četnost pCR až na 40-60 %. Významným potvrzením účinnosti a bezpečnosti podání neoadjuvantní chemoterapie v kombinaci s Herceptinem jsou výsledky klinické studie fáze III NOAH (Neoadjuvant Herceptin).
V této mezinárodní, multicentrické, nezaslepené, randomizované studii fáze III byly pacientky s lokálně pokročilým nebo inflamatórním karcinomem prsu randomizované v poměru 1 : 1 na léčbu CHT + Herceptin následovanou adjuvantním podáním Herceptinu (n=115) a nebo s podáním samotné CHT (n=113). Paralelní kohorta 99 srovnatelných pacientek s HER2-negativním onemocněním byla léčená stejným chemoterapeutickým režimem. Tento neoadjuvantní chemoterapeutický režim obsahoval doxorubicín, paklitaxel, cyklofosfamid, metotrexát a 5-fluorouracil. Primárním cílem studie bylo porovnání event free survival (EFS), které bylo definované jako čas od randomizace do rekurence nebo progrese onemocnění (lokální, regionální, vzdálené nebo kontralaterální) nebo smrti z jakékoliv příčiny.
Ve studii byla během mediánu sledování 5,4 let potvrzená prospěšnost trastuzumabu v EFS. Četnost pCR u HER2-dependentních karcinomů byla 43 % v rameni s trastuzumabem a 23 % v rameni se samostatnou chemoterapií (p = 0,02). Tříleté období bez projevů nemoci bylo signifikantně vyšší u nemocných léčených trastuzumabem ve srovnání s chemoterapií (70,1 % vs. 53,3 %; HR 0,56, p = 0,006). Zlepšení celkové doby přežití OS nebylo statisticky signifikantní (85,3 % vs. 80,4 %; HR 0,65; p = 0,18). Tab. č. 2
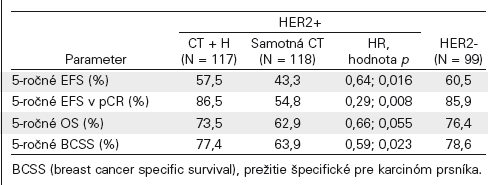
Změny v LVEF byly minimální (u > 95 % nemocných byly zaznamenány projevy kardiální toxicity stupeň 0 nebo 1), v rameni s trastuzumabem byly zaznamenány u 2 nemocných nežádoucí projevy kardiotoxicity vyššího stupně.
Neoadjuvantní hormonální léčbu lze zvažovat u pacientek, u kterých není indikována neoadjuvantní ani adjuvantní chemoterapie a u kterých lze očekávat odpověď na hormonální léčbu (nádory s pozitivními ER a PR, s nízkým gradem, s nízkou proliferací, lobulární invazivní karcinom). Cílem je minimalizace zbytečné toxicity u žen, u kterých nepředpokládáme dostatečnou léčebnou odpověď na chemoterapii. Pro příznivý profil nežádoucích účinků je tato léčba vhodná pro starší nemocné a nemocné s intolerancí chemoterapie. Zlepšení výsledků primární hormonální léčby lze dosáhnout zařazením sektivních inhibitorů aromatáz. Při kratším trvání hormonální léčby je počet pCR nízký (< 5 %). Nedosažení pCR v případě neoadjuvantní hormonální terapie však nelze interpretovat jako rezistenci k hormonální léčbě.
Existuje však jen málo klinických studií, které by v neoadjuvantní indikaci porovnávaly chemoterapii a hormonální léčbu. Velké retrospektivní vyhodnocení 1731 nemocných léčených primární chemoterapii prokázalo signifikantně nižší pCR u nemocných s hormonálně dependentními nádory (8 % vs. 24 %; p = 0,0001).
- Jaká je definice kompletní patologické odpovědi ?
Definice pCR, tak jak byla uváděná v různých klinických studiích, nebyla zcela uniformní, což může být vysvětlením pro poměrně značné rozdíly ve výsledcích těchto hodnocení. Sjednocení definice pCR se tedy jeví velmi potřebné. Podle nejvíce užívané definice pCR znamená nepřítomnost reziduí buněk invazívního karcinomu jak v prsu, tak v lymfatických uzlinách.
Klinická kompletní regrese (cCR) nemusí vždy korelovat s pCR a téměř jedna třetina nemocných s cCR má zjištěna patologická rezidua při chirurgickém výkonu.
Přítomnost nebo absence reziduí DCIS po předoperační léčbě nemá vliv na dlouhodobý interval bez aktivity choroby ani celkovou dobu přežití. Naopak přítomnost jakýchkoliv reziduí v lymfatických uzlinách je spojena s horší prognózou a proto tento reziduální nález pCR vylučuje.
- které faktory jsou při hodnocení efektu léčby rozhodující pro následnou prognózu nemocných ?
Pro adjuvantní léčbu je nejvýznamnějším cílem prodloužení celkové doby přežití. V adjuvantní léčbě předpovídá zlepšení DFS též zlepšení celkové doby přežití.
Při předoperační léčbě je významným prognostickým faktorem pCR.
V současné době máme k dispozici přesvědčivá data, která ukazují, že patologická kompletní odpověď je tím nejsilnějším prognostickým faktorem u nemocných po neoadjuvantní chemoterapii. U nemocných, u kterých je dosaženo patologické kompletní odpovědi, onemocnění relabuje významně méně než u nemocných, u kterých nebylo kompletní patologické odpovědi (pCR) dosaženo. Nemocné s reziduálním nádorem po neoadjuvantní chemoterapii mají zvýšené riziko recidivy a úmrtí na základní onemocnění a to včetně hormonálně dependentních karcinomů.
Zvlášť výrazný rozdíl je patrný u pacientek s triple negativními nádory (TNBC), u kterých při dosažení pCR onemocnění téměř nerelabuje, zatímco pokud k této pCR nedojde, pohybuje se dlouhodobé přežití okolo 50%.
Faktory spojené s větší pravděpodobností pCR jsou velikost nádoru, histologický a molekulární subtyp (duktální > lobulární), (bazaloidní nebo HER-2 subtyp > luminální), stav exprese hormonálních receptorů (ER negativní > ER pozitivní) a stupeň vyzrálosti nádoru - grade (vysoký > nízký).
- podávat ještě adjuvantní systémovou terapii ?
Standardním postupem po kompletním chirurgickém odstranění nádorového rezidua po indukční chemoterapii je pooperační radioterapie a adjuvantní hormonální nebo cílená biologická léčba podle biologického profilu nádoru. Pokračování v chemoterapii po neoadjuvantní léčbě není běžně doporučováno a není podpořeno klinickými daty.
Závěr
Neoadjuvantní systémová léčba pro a proti
Pro
Výhodou předoperační systémové léčby je zejména časné zahájení systémové léčby, z čehož plyne i lepší dostupnost cytostatik při intaktním cévním zásobení a možnost bezprostředního zhodnocení léčebné odpovědi. Primární chemoterapie je účinnější u hormonálně independentních nádorů, které vykazují nízkou nebo žádnou expresi hormonálních receptorů, mají vyšší grade, vysokou expresi Ki67a jedná se o typ luminal B nebo non-lobulární typ tumoru.
Další výhodou je event. zmenšení nádoru (down-staging), které může vést k operabilitě primárně inoperabilních nádorů nebo k prs záchovným výkonům u nádorů, které by jinak byly indikovány k mastektomii. Stupeň dosažené objektivní léčebné odpovědi je klinickým prediktorem dlouhodobého léčebného výsledku a to zejména při dosažení kompletní patologicky ověřené regrese (pCR).
Neoadjuvantní chemoterapie je tolerována stejně jako chemoterapie adjuvantní a nezvyšuje výskyt pooperačních komplikací.
Proti
Primární předoperační (neoadjuvantní) chemoterapie nezlepšuje dlouhodobé léčebné výsledky v parametrech srovnávajících období bez aktivity onemocnění (DFS) a celkovou dobu přežití (OS). Prs záchovný výkon při primární indikaci mastektomie, provedený po indukční chemoterapii, je spojen s mírným zvýšením rizika lokální recidivy.
Ve studii NSABP B-18 bylo celkem zařazeno 1523 žen a po 9 letech sledování bylo zjištěno navýšení rizika lokální rekurence po neoadjuvantní léčbě na 10,7 % oproti adjuvantnímu podání chemoterapie, kde se riziko lokální rekurence vyskytovalo u 7,6 %. V tomto trialu bylo vyšší riziko lokální rekurence zaznamenáno zejména u těch pacientek, u kterých byla primárně indikována mastektomie a díky neoadjuvantní chemoterapii došlo k regresi a proto byl následně proveden prs záchovný výkon ve srovnání se skupinou, u které byla záchovná operace v plánu již primárně (15,9 % vs. 9,9 % v 9 letech).
Literatura
- PETRUŽELKA, Karcinom prsu - jak dál v diagnostice a léčbě ve světle nových možností. Vnitř Lék, 2007, 53, č. 9, s. 22-23.
- HARRIS, , KAELIN, CM., BELLON, JR., et al. Preoperative therapy for operable breast cancer. In HARRIS, JR., LIPPMAN, MC., MORROW, M., et al. Diseases of the breast. 4rd ed, Philadelphia, PA : Lippincott Williams & Wilkins, 2010, p. 929-943.
- SHARMA, , ABRAHAM, J. Breast Cancer In ABRAHAM, J., GULLEY, JL., ALLEGRA, CC. (Eds), The Bethesda Handbook of Clinical Oncology. Lippincott Williams & Wilkins, 2010, 688 p.
- BUZDAR, , VALERO, V., IBRAHIM, NK., et al. Neoadjuvant therapy with paclitaxel followed by 5-fluorouracil, epirubicin, and cyclophosphamide chemotherapy and concurrent trastuzumab in human epidermal growth factor receptor 2-positive operable breast cancer: an update of the initial randomized study population and data of additional patients treated with the same regimen. Clin Cancer Res, 2007, 13, p. 228-233.
- GIANNI, , EIERMANN, W., SEMIGLAZOV, V., et al. Neoadjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer: primary efficacy analysis of the NOAH trial. 31st San Antonio Breast Symposium; San Antonio, TX, USA; Dec 10-14, 2008; abstr 31.
- DIXON, Neoadjuvant Endocrine Therapy. ASCO educational book, 2009.
- GUARNERI, , BROGLIO, K., KAU, SW., et al. Prognostic value of pathologic complete response after primary chemotherapy in relation to hormone receptor status and other factors. Clin Oncol, 2006, 24, No. 7, p. 1037-1044.
- MAZOUNI, , PEINTINGER, F., WAN-KAU, S., et al. Residual ductal carcinoma in situ in patients with complete eradication of invasive breast cancer after neoadjuvant chemotherapy does not adversely affect patient outcome. J Clin Oncol, 2007, 25, p. 2650-2655.
- Von MINCKWITZ, , KAUFMANN, M., KÜMMEL, S., et al. Integrated meta- analysis on 6634 patients with early breast cancer receiving neoadjuvant anthracycline-taxane/ trastuzumab containing chemotherapy. Res Breast Cancer Symp, 2008, abstr 79.
- HENNESSY, , HORTOBAGYI, GN., ROUZIER, R., et al. Outcome after pathologic complete eradication of cytologically proven breast cancer axillary node metastase following primary chemotherapy. Clin Oncol, 2005, 23, p. 9304-9311.
- GREEN, , BUZDAR, AU., SMITH, T., et al. Weekly paclitaxel followed by FAC as primary systemic chemotherapy of operable breast cancer improves pathologic complete remission rates when compared to every 3-week paclitaxel therapy followed by FAC - Final results of a prospective phase II randomized trial (abstract). Proc Am Soc Clin Oncol, 2002, 21, 35abstr.
- CHEN, , MERIC-BERNSTAM, F., HUNT, KK., et al. Breast conservation after neoadjuvant chemotherapy: The M. D. Anderson Cancer Center experience. J Clin Oncol, 2004, 22, p. 2303-2312.
- GIANNI, , BASELGA, J., EIERMANN, W., et al. Feasibility and tolerability of sequential doxorubicin/paclitaxel followed by cyclophosphamide, methotrexate, and fluorouracil and its effects on tumor response as preoperative therapy. Clin Cancer Res, 2005, 11, p. 8715-8721.
- Van der HAGE, , Van de VELDE, CJH., JULIEN, JP., et al. Preoperative chemotherapy in primary operable breast cancer: Results from the European Organization for Research and Treatment of Cancer trial 10902. J Clin Oncol, 2001, 19, p. 4224-4237.
- MAURI, , PAVLIDIS, N., IOANNIDIS, JP. Neoadjuvant versus adjuvant systemic treatment in breast cancer: A meta-analysis. J Natl Cancer Inst, 2005, 97, p. 188-194.
Datum přednesení příspěvku: 27. 2. 2014





