Konference: 2012 3. pražské mezioborové onkologické kolokvium Prague ONCO
Kategorie: Zhoubné nádory prsu
Téma: Review
Číslo abstraktu: 006
Autoři: prof. MUDr. Luboš Petruželka, CSc.; MUDr. Michal Vočka
Obrázek 1: Mořská houba Halichondria okadai

Úvod
Karcinom prsu je nejčastější zhoubný nádor postihující ženskou část populace. Počet nových onemocnění každoročně pozvolna stoupá. Příznivou zprávou je pokles mortality zaznamenaný ve vyspělých zemích včetně ČR, který souvisí s rozvojem diagnostických a terapeutických možností.
Nejméně u čtyřiceti cytostatik byla prokázána účinnost v systémové léčbě karcinomu prsu. Výrazné zlepšení znamenalo zavedení nových cytostatik často s unikátními mechanismy účinku, jakými jsou taxany (paklitaxel a docetaxel), vinorelbin, gemcitabin a nové fluoropyrimidiny. Další vývoj cytostatik s unikátními mechanismy stagnuje. Prakticky jedinou výjimkou je ixabepilon. Jednou z mála inovací jsou cytostatika s příznivějším profilem nežádoucích účinků (liposomální doxorubicin, nano-paklitaxel) při obdobných mechanismech účinku jako cytostatika základní a vývoj perorálních forem dříve pouze parenterálně používaných cytostatik (kapecitabin, vinorelbin).
Konvenční chemoterapie se tak přiblížila k maximu léčebných možností. Neznamená to, že konvenční chemoterapie ztratila své místo jako systémová modalita léčby karcinomu prsu. Současné základní armamentarium konvenčních cytostatik má stále své nezastupitelné místo v systémové léčbě karcinomu prsu jak u časných, tak u pokročilých stadií onemocnění. V současnosti lze při kombinované chemoterapii metastazujícího karcinomu prsu dosáhnout až 50-85 % objektivních léčebných odpovědí při léčbě první linie (s 10-20 % kompletních odpovědí). Léčebná účinnost klesá u předléčených nemocných. Na chemoterapii druhé řady odpovídá asi 30-50 % pacientek. (1)
Při chemoterapii třetí linie lze zastavit progresi choroby (≥ 6 měsíců) až u 40 % nemocných. Účinnost a tolerabilita chemoterapie u vyšších léčebných linií je ovlivněna množstvím faktorů jako: celkový výkonnostní stav nemocných, přítomnost přidružených chorob, rozsah a lokalizace metastatického postižení, složení a trvání předchozí chemoterapie. Výběr další linie léčby musí být prováděn individuálně a v současnosti nelze stanovit optimální „standardní“ režim. Kvantifikovat přínos léčby při použití více léčebných linií není jednoduché vzhledem k velké heterogenitě nemocných (použitá léčba, nežádoucí účinky, léčebný efekt, interindividuální variabilita) a u těchto skupin existuje jen málo prospektivních studií. Rozšiřování léčebného armamentaria, účinnější léčba, zdokonalení podpůrné léčby vede k používání většího počtu léčebných linií systémové léčby. Průměrný počet linií chemoterapie metastazujícího karcinomu prsu se v USA podle provedeného průzkumu pohybuje mezi čtyřmi až šesti. (2)
Obrázek 2: Polyéterový makrolid halichondrin B
Cytostatika s antimikrotubulárním účinkem
Terčovou strukturou některých cytostatik je buněčný mikrotubulární systém. Mikrotubuly jsou polymery vytvořené z proteinů α-tubulinu a β-tubulinu, které jsou součástí cytoskeletu v cytoplazmě buňky. Mikrotubuly mají klíčovou úlohu pro správnou migraci chromozomů při mitóze, podílejí se též na udržení tvaru buňky, na buněčné motilitě a na přenosu signálů mezi povrchovými membránovými receptory a jádrem. Za normálních okolností je polymerizace a depolymerizace tubulinu v rovnováze.(3) Mezi cytostatika zasahující mikrotubulární systém patří taxany (paklitaxel a docetaxel), vinka alkaloidy (vinorelbin a vinblastin) a epothilony (ixabepilone). Mitotické inhibitory (vinorelbin, vinblastin) se váží na mikrotubulární proteiny, a způsobují tak rozpad struktury mitotického vřeténka (inhibice polymerizace). Inhibitory depolymerizace (paklitaxel, docetaxel) urychlují tvorbu mikrotubulů a stabilizují vytvořené mikrotubuly. Ovlivněním dynamiky mikrotubulů způsobují zástavu buněčného cyklu a apoptózu. Mezi cytostatika též narušující rovnováhu mikrotubulárního aparátu patří jedno z mála nových cytostatik zavedených v poslední době do klinické praxe – eribulin. Eribulin inhibuje formaci dělícího vřeténka, váže se na konce mikrotubulů, a způsobuje tak ireverzibilní mitotický blok. Eribulin inhibuje mikrotubuly mechanismem odlišným od ostatních molekul cílených na mikrotubuly. Váže se na malé množství vysokoafinitních míst na konci mikrotubulů. (4)
Eribulin
Mořské houby představují možný zdroj pro vývoj léků s protinádorovým účinkem. U téměř šesti set z nich byly prokázány známky protinádorové aktivity.( 5) Řada přírodních produktů, které narušují dynamiku tubulů, jako jsou phomopsin A, halichondrin B, homohalichondrin B a spongistatin 1, je předmětem preklinického a klinického výzkumu. Z dalších přírodních produktů izolovaných z mořských hub jsou v klinickém výzkumu syntetické formy hemiasterlinu (HTI-286 and E7974).(6)
V r. 1986, Hirata a Nemura izolovali z vzácné mořské houby Halichondria okadai polyéterový makrolid halichondrin B (obrázky 1,2), vykazující antimitotické účinky.(7,8) Eribulin (E7389) je syntetický makrocyklický ketonový analog přírodního mořského produktu halichondrinu B ke klinickému použití, přičemž další dvě syntetická analoga ER- 076349 a ER-086526 jsou ve fázi časného klinického zkoušení. Eribulin narušuje rovnováhu mikrotubulárního systému, váže se na tubulin, inhibuje jeho polymerizaci, narušuje formaci mitotického vřeténka a dynamiku centromer, a indukuje tak zastavení mitózy následované apoptózou.(9) Mechanismus vazby eribulinu se liší od ostatních molekul cílených na mikrotubuly. Eribulin si zachovává in vitro aktivitu i u k taxan rezistentních nádorových buněk nesoucích mutaci β-tubulinu.
Mechanismus účinku
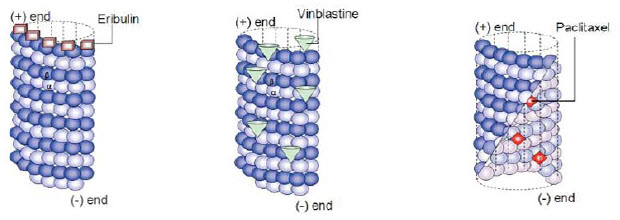
Eribulin mesylát (E7389) je inhibitor dynamiky mikrotubulů. Mechanismus účinku je odlišný od ostatních agens ovlivňujících mikrotubulární systém (taxany, epothilony a vinka alkaloidy). Taxany, epothilony a vinka alkaloidy inhibují ve fyziologických koncentracích jak růst (polymerizace), tak zkracování (depolymerizace) mikrotubulů. Unikátní protinádorový efekt eribulinu spočívá v blokádě polymerizace tubulinu bez ovlivnění procesu depolymerizace (zkracování mikrotubulů). Kromě toho způsobuje sekvestraci mikrotubulů na nefunkční části. Eribulin tak zabraňuje formaci dělícího vřeténka, které vede k ireverzibilní blokádě mitózy, blokádě G2/M fáze buněčného cyklu a následné apoptotické smrti buňky. Eribulin se ireverzibilně váže na pozitivní konec mikrotubulů, viz obrázek 3.(10,11,12)
Preklinická data
Protinádorový účinek eribulinu byl doložen v preklinických studiích na buněčných nádorových liniích a xenograftech karcinomů prsu, tlustého střeva a melanomů s největším potenciálem v liniích karcinomu prsu. Antiproliferační aktivita byla zaznamenána u paklitaxel rezistentních linií ovariálních karcinomů.(13)
KLINICKÉ STUDIE
Fáze I
Na základě preklinických výsledků byl eribulin mesylát hodnocen ve čtyřech studiích fáze I u pokročilých solidních nádorů různých typů s cílem určení nejvhodnějšího režimu a dávky pro studie fáze II.
Ve studiích s týdenní aplikací byla dosažena maximální tolerovatelná dávka (MTD) 1,4 mg/m2 a 1 mg/m2. Eribulin byl podáván 1., 8. a 15. den při 28denním cyklu. Při 3týdenních intervalech byla MTD 2 mg/m2 při podání 1. a 21. den, při podání 1. a 8. den v 3týdenním intervalu byla MTD 1,4 mg/m2. Nejčastějším dávku limitujícím nežádoucím účinkem byla neutropenie. Z nehematologických nežádoucích účinků (NÚ) byla zaznamenána hypoglykemie, hypofosfatemie a únavový syndrom.(14,15,16,17)
Obrázek 3: podle: Jordan M. and Wilson L. Nat Rev Cancer 2004 a Smith J, et al. Biochemistry 2010
Fáze II
Program fáze II byl zahájen v roce 2004, kdy byly k dispozici výsledky fáze I. Pro studii fáze II byla iniciálně zvolena dávka eribulinu 1,4 mg/m2 podávaná 1. ,8. a 15. den v 2-5 minutové infuzi každých 28 dní. Byly provedeny tři studie fáze II u velmi předléčených nemocných se 103, 299 a 84 hodnocenými pacienty. U všech nemocných musela předcházet léčba antracykliny a taxany a byla možná léčba jinými cytostatiky. Primárním cílem ve všech třech studiích byl podíl objektivních léčebných odpovědí (ORR).
V první studii fáze II nebylo 2/3 pacientek možné podat plnou dávku z důvodu výskytu neutropenie v 15. den, a proto byl časový rozvrh dávkování změněn na 1. a 8. den v 21denních cyklech. V západních studiích byl ORR cca 10 %, v japonské studii 20 % (pozn.: do japonské studie bylo možné zařazovat méně předléčené pacientky). Trvání léčebné odpovědi bylo v rozmezí 4-5,6 měsíců. Klinický benefit (CBR) (PR plus SD alespoň 6 měsíců) se pohyboval mezi 17-27,5 %. Délka období bez progrese onemocnění byla v rozmezí 2,6-3,6 měsíců a celková doba přežití v rozmezí 9-11 měsíců.
Tolerance léčby byla dobrá. U 1/2 až 2/3 pacientek byla zaznamenána neutropenie stupně 3 a 4, z toho jen v 5 % se jednalo o febrilní neutropenii. U 20-50 % nemocných byly použity růstové faktory jako sekundární profylaxe. Periferní neuropatie stupně 1 nebo 2 byla pozorována u 1/4 nemocných, včetně nemocných předléčených taxany. U 5 % se jednalo o stupeň 3. Stupeň 4 pozorován nebyl. Eribulin nezhoršoval již existující neuropatii.
Více než polovina nemocných ve všech studiích trpěla únavovým syndromem. Ostatní NÚ jako nauzea, anemie a anorexie byly mírné, alopecie stupně 1 a 2 byla pozorována u poloviny nemocných. Souhrnně byly nežádoucí účinky u opakovaně předléčených nemocných akceptovatelné pro klinickou praxi.(18, 19,20)
Fáze III
Ve studii EMBRACE (studie 305, E7389-G000-305), otevřené, randomizované, multicentrické studii fáze III byla hodnocena účinnost eribulinu (eribulin mesylát, E7389, Halaven) ve srovnání s léčbou dle výběru ošetřujícího lékaře u předléčených pacientek s recidivujícím nebo metastazujícím karcinomem prsu. Do studie bylo randomizováno 762 žen ze 135 center z 19 zemí, z nichž bylo 508 zařazeno do ramene s eribulinem a 254 pacientkám byla podána chemoterapie dle výběru ošetřujícího lékaře. Tyto ženy byly předléčeny 2 až 5 liniemi chemoterapie obsahující antracykliny a taxany (event. bylo-li jejich podávání kontraindikováno) a stratifikovány podle zeměpisné lokality, předchozí chemoterapie obsahující kapecitabin a stupně exprese HER2 receptoru.
Klíčovými vylučovacími kritérii byla předchozí účast na jiné studii s eribulinem, podávání jakékoliv jiného zkušebního preparátu méně než 4 týdny před randomizací, léčba chemoterapií, zářením, trastuzumabem nebo hormonální terapií méně než 3 týdny před randomizací a preexistující neuropatie závažnější než stupeň 2.
V rámci této studie byl pacientkám podáván eribulin mesylát v dávce 1,4 mg/m2 intravenózně (2-5 min.) v 1. a 8. den každých 21 dní, nebo terapie dle ošetřujícího lékaře (randomizační poměr 2:1) definovaná jako jakákoliv monoterapie hormonální, cílená nebo chemoterapie, záření nebo symptomatická terapie. Léčba byla ukončena při progresi onemocnění, při výskytu nepřijatelných nežádoucích účinků nebo při závažném porušení dávkovacího schématu.
Primárním cílem této studie bylo porovnání celkového přežití pacientek. Sekundárními cíly bylo porovnání času bez progrese, míra objektivní odpovědi a doba trvání odpovědi. V rameni s eribulinem bylo po randomizaci dodatečně vyřazeno z různých důvodů 5 pacientek a stejně tak ve druhém rameni. V rameni s terapií dle výběru ošetřujícího lékaře byla 238 pacientkám podána chemoterapie (96 %), z toho nejčastěji vinorelbin, gemcitabin nebo kapecitabin. Z celkového počtu 762 pacientek bylo 123 HER2-pozitivních (16 %) a 144 triple negativních (19 %). Celkem 386 pacientek (51 %) mělo vzdálené metastázy, nejčastěji jaterní a kostní. Medián doby podávání eribulinu (n = 503) byl 3,9 měsíce (0,7-16,3 měsíce), přičemž 295 pacientek (59 %) absolvovalo 5 a více cyklů.(1-23) Naproti tomu medián doby podávání terapie dle výběru ošetřujícího lékaře byl pouze 2,1 měsíce (0,03-21,2 měsíce) u pacientek, kterým byla podávána chemoterapie, a 1,0 měsíce (0,8-6,2 měsíce) u pacientek na hormonální léčbě.
Celkové přežití se statisticky významně prodloužilo v rameni s eribulinem (medián 13,1 měsíce, 95% CI 11,8-14,3) oproti rameni s chemoterapií dle výběru ošetřujícího lékaře (medián 10,6 měsíce, 95% CI 9,3-12,5, hazard ratio 0,81, 95% CI 0,66-0,99; p = 0,041). V rameni s eribulinem zemřelo 274 pacientek (54 %) oproti 148 úmrtím (58 %) v rameni s léčbou dle výběru ošetřujícího lékaře.
Medián času bez progrese byl 3,7 měsíců (95% CI 3,3-3,9) v rameni s eribulinem a 2,2 měsíce (95% CI 2,1-3,4) v rameni s léčbou dle výběru ošetřujícího lékaře (HR 0,76, 95% CI 0,64-0,90, p = 0,002 podle hodnocení investigátorů; HR 0,87, 95% CI 0,7-1,05, p = 0,137 při nezávislém hodnocení). K objektivní odpovědi došlo u 57 pacientek s měřitelným nádorovým postižením (12 %) v rameni s eribulinem (n = 468) a u 10 pacientek (5 %) v rameni s léčbou dle výběru ošetřujícího lékaře (n = 214) (p = 0,002) při nezávislém hodnocení. Z toho u 3 pacientek v rameni s eribulinem došlo ke kompletní léčebné odpovědi.
Medián doby trvání odpovědi byl u ramene s eribulinem 4,2 měsíce (95% CI 3,8-5,0) oproti 6,7 měsíce (95% CI 6,7-7,0) u ramene s léčbou dle výběru ošetřujícího lékaře (p = 0,159). Klinický benefit byl prokázán u 23 % (106) pacientek v rameni s eribulinem (n = 468) oproti 17 % (36) v rameni s léčbou dle výběru ošetřujícího lékaře.
Nežádoucí účinky byly pozorovány u 497 (99 %) pacientek v rameni s eribulinem (n = 503), z toho stupně 4 u 121 pacientek (24 %), nejčastěji se objevovaly svalová slabost nebo únava u 54 % (stupeň 4 u 1 %), neutropenie u 52 % (stupeň 4 u 24 %), alopecie u 45 %, periferní neuropatie u 35 % (stupeň 4 u < 1 %) a nauzea u 45 % (stupeň 4 se nevyskytl). Rameno s léčbou dle výběru ošetřujícího lékaře bylo rozděleno na podskupiny dle podávané terapie. V podskupině s vinorelbinem se nežádoucí účinky stupně 3 objevily u 18 z 61 pacientek (30 %) a stupně 4 u 6 (10 %), v podskupině s taxany stupně 3 u 5 pacientek z 38 (14 %) a stupně 4 u 6 (16 %) a s gemcitabinem stupně 3 u 9 pacientek z 46 (20 %) a stupně 4 u 3 (7 %). Nejčastějším nežádoucím účinkem v tomto rameni byla svalová slabost nebo únava, a to u 40 % pacientek (stupeň 4 se nevyskytl u žádné z pacientek), dále neutropenie u 30 % (stupeň 4 u 7 %), nauzea u 28 % (stupeň 4 se nevyskytl u žádné z pacientek), anemie u 23 % (stupeň 4 u < 1 %), zácpa u 21 % (stupeň 4 se nevyskytl u žádné z pacientek), průjem u 18 % a zvracení u 18 % (stupeň 4 se nevyskytl u žádné z pacientek).
V klinické studii fáze III EMBRACE bylo prokázáno, že léčba eribulinem je dobře tolerovaná a statisticky signifikantně prodlužuje celkovou dobu přežití u žen s metastazujícím karcinomem prsu předléčených více liniemi chemoterapie v porovnání s chemoterapií na základě volby ošetřujícího lékaře. Jedná se o první klinickou studii u nemocných předléčených antracykliny a taxany se signifikantním prodloužením doby přežití.(21,22,23)
ZÁVĚR
Indikace pro klinické použití
Monoterapie přípravkem eribulin (HALAVEN®) je indikována k léčbě pacientů s lokálně pokročilým nebo metastatickým karcinomem prsu s progresí onemocnění po nejméně dvou chemoterapeutických režimech zaměřených na pokročilé onemocnění. Předchozí léčba měla zahrnovat antracykliny a taxany, s výjimkou případů, kdy u pacientů nebyla léčba těmito přípravky vhodná.
Shrnutí pro klinické použití
| Dávka: | 1,23 mg/m2 |
| (1,4 mg/m2 eribulin mesylát) | |
| Způsob podání: | i.v. krátká infuze 2-5 minut |
| Časování: | 1. a 8. den každých 21 dní |
Nejčastější nežádoucí účinky (více než 35 %): astenie nebo únavnost, neutropenie, alopecie, periferní neuropatie, nauzea
prof. MUDr. Luboš Petruželka, CSc., MUDr. Michal Vočka Onkologická klinika VFN a 1. LF UK a Ústav radiační onkologie FNB a 1. LF UK e-mail: lubos petruzelka@seznam.cz
Literatura
- Petruželka L. Současné možnosti a nové perspektivy systémové léčby karcinomu prsu. Klin Farmakol Farm 2007;21(3):30-35.
- Lin NU, Burstein HJ. EMBRACE, eribulin, and new realities of advanced breast cancer. www.thelancet.com Vol 377 March 12, 2011.
- Klener P. Klinická onkologie. Galén, 2002.
- Munoz-Cosuelo E, Perez-Garcia J, Cortes J. Eribulin mesylate as a microtubule inhibitor for treatment of patients with metastatic breast cancer. OncoTargets and Therapy 2011;4:185-192.
- Menis J, Twelves C. Eribulin (Halaven): a new, effective treatment for women with heavily pretreated metastatic breast cancer. Breast Cancer: Targets and Therapy 2011;3:101-111.
- Loganzo F, Discafani CM, Annable T, et al. HTI-286, a synthetic analogue of the tripeptide hemiasterlin, is a potent antimicrotubule agent that circum-vents P-glycoprotein mediated resistance in vitro and in vivo. Cancer Res 2003;63:1838-1845.
- Kuznetsov G, Towle MJ, Cheng H, et al. Induction of morphological and biochemical apoptosis following prolonged mitotic blockage by halichondrin B macrocyclic ketone analog E7389. Cancer Res 2004; 64:5760-5766.
- Towle MJ, Salvato KA, Budrow J, et al. In vitro and in vivo anticancer activities of synthetic macrocyclic ketone analogues of halichondrin B. Cancer Res 2001;61:1013-1021.
- Jimeno A. Eribulin: rediscovering tubulin as an anticancer target. Clin Cancer Res 2009;15:3903-3905.
- Jordan MA, Kamath K, Manna T, et al. The primary antimitotic mechanism of action of the synthetic halichondrin E7389 is suppression of microtubule growth. Mol Cancer Ther 2005;4:1086-1095.
- Okouneva T, Azarenko O, Wilson L, et al. Inhibition of centromere dynamics by eribulin (E7389) during mitotic metaphase. Mol Cancer Ther 2008;7:2003-2011.
- Towle MJ, Salvato KA, Budrow J, et al. In vitro and in vivo anticancer activities of synthetic macrocyclic ketone analogues of halichondrin B. Cancer Res 2001;61:1013-1021.
- Okouneva T, Azarenko O, Wilson L, et al. Inhibition of centromere dynamics by eribulin (E7389) during mitotic metaphase. Mol Cancer Ther 2008;7:2003-2011.
- Goel S, Mita AC, Mita M, et al. A Phase I study of eribulin mesylate (E7389), a mechanistically novel inhibitor of microtubule dynamics, in patients with advanced solid tumors. Clin Cancer Res 2009;15:4207-4212.
- Tan AR, Rubin EH, Walton DC, et al. Phase I study of eribulin mesylate (E7389) administered once every 21 days in patients with advanced solid tumors. Clin Cancer Res 2009;15:4213-4218.
- Synold TW, Morgan RJ, Newman EM, et al. A phase I pharmacokinetic and target validation study of the novel antitubulin agent E7389: a California Cancer consortium trial. J Clin Oncol 2005;23:200 (abstract).
- Minami H, Mukohara T, Nagai S, Mukai H, Namiki M. A phase I study of eribulin mesylate (E7389) in patients with refraktory cancers. Eur J Cancer Suppl 2008;6:140 (abstract).
- Vahdat LT, Pruitt B, Fabian CJ, et al. Phase II study of eribulin mesylate, a halichondrin B analog, in patients with metastatic breast cancer previously treated with an anthracycline and a taxane. J Clin Oncol 2009;27:2954-2961.
- Cortes J, Vahdat L, Blum JL, et al. Phase II study of the halichondrin B analog eribulin mesylate in patients with locally advanced or metastatic breast cancer previously treated with an anthracycline, a taxane, and capecitabine. J Clin Oncol 2010; 28:3922-3928.
- Iwata H, Aogi K, Masuda N, et al. Efficacy and safety of eribulin in Japanese patients (pts) with advanced breast cancer. J Clin Oncol 2010;28:1081.
- Twelves C, Loesch D, Blum JL, et al. A phase III study (EMBRACE) of eribulin mesylate versus treatment of physician‘s choice in patients with locally recurrent or metastatic breast cancer previously treated with an anthracycline and a taxane. J Clin Oncol 2010; 28:CRA1004 (abstract).
- Cigler T, Vyndat L. Eribulin mesylate for the treatment of breast cancer. Expert Opin Pharmacother 2010;11(9):1587-1593.
- Cortes J, O’Shaughnessy J, Losech D, et al. Eribulin monotherapy versus treatment of physician’s choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomised study. Lancet 2011;377:914-23.
Datum přednesení příspěvku: 26. 1. 2012





