Konference: 2011 XXXV. Brněnské onkologické dny a XXV. Konference pro sestry a laboranty
Kategorie: Gastrointestinální nádory
Téma: Onkochirurgie
Číslo abstraktu: 093
Autoři: as. MUDr. Miroslav Levý, Ph.D., MBA; doc. MUDr. Vladimír Visokai, PhD.; doc.MUDr. Ludmila Lipská, Ph.D.
Mezi periampulární nádory lze počítat maligní novotvary vzniklé z pankreatické tkáňe (75%), epitelu Vaterské papily (7%), duodenální sliznice (3%), žlučovodu (3%), Langerhansových ostrůvků (1%) a z retroperitonea (2%) [1]. Histopatologicky rozlišujeme 2 základní typy: typ pankreatobiliární a typ intestinální [2]. Pankreatobiliární typ má obvykle jednoduché nebo větvící se žlázy a malá hnízda buněk obklopené desmoplastickým stromatem. Intestinální typ je typ podobající se karcinomu tlustého střeva.
Výsledky radikálních operací se liší podle původu nádoru. Dlouhodobé přežití po hemipankreatoduodenektomi je nejlepší u pacientů s primárním nádorem z papily a duodena, o něco horší je po radikální operaci pro nádor ze žlučovodů a nejhorší je u duktálního adenokarcinomu pankreatu. Pětileté přežití po radikální operaci pro ampulom se pohybuje mezi 50-60% [3] zatímco u resekce s kurativním záměrem pro duktální karcinom je 5-ti leté přežití 15-30% [4].
Stadium onemocnění v době operace a radikalita operace je významným prognostickým faktorem. Přesto je rozdílné dlouhodobé přežití adjustované na stadium onemocnění u nádorů, které vycházejí z pankreatické tkáně a ostatních periampulárních nádorů.
Imunohistochemicky můžeme charakterizovat pankreatobiliární typ pomocí cytokeratinových markerů: keratin 7+, keratin 20–, MUC2–, MUC 1+, MUC4+. Intestinální typ: keratin 7–, keratin 20+, MUC2+, MUC1–, MUC4+ [5]. Cytokeratinové markery MUC1 a MUC4, které jsou predominantně produkovány duktálním karcinomem pankreatu, jsou ukazatelem agresivního chování nádoru a špatné prognózy, zatímco MUC2 znamená inaktivní (indolentní) nádor [6].
Materiál a metody
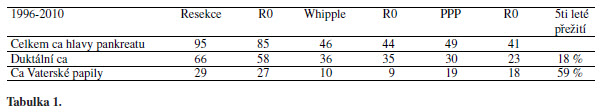
Autoři dokumentují zkušenost na souboru pacientů operovaných na chirurgické klinice 1. LFUK a FTNsP. V letech 1996-2010 bylo provedeno celkem 95 resekčních výkonů pro karcinom lokalizovaný v oblasti hlavy pankreatu. Pro duktální karcinom lokalizovaný v hlavě pankreatu bylo provedeno 66 resekcí (Whipple 36, Traverso-Longmire 30), pro karcinom Vaterské papily 29 resekcí (Whipple 10, Traverso-Longmire 19).
Graf 1.
Výsledky
Z celkového počtu 95 resekcí bylo hodnoceno 85 resekcí jako kurativní R0 resekce. Pro duktální karcinom hlavy pankreatu bylo provedeno 58 R0 resekcí (Whipple 35, Traverso-Longmire 23), pro karcinom Vaterské papily 27 R0 resekcí (Whipple 9, Traverso-Longmire 18).
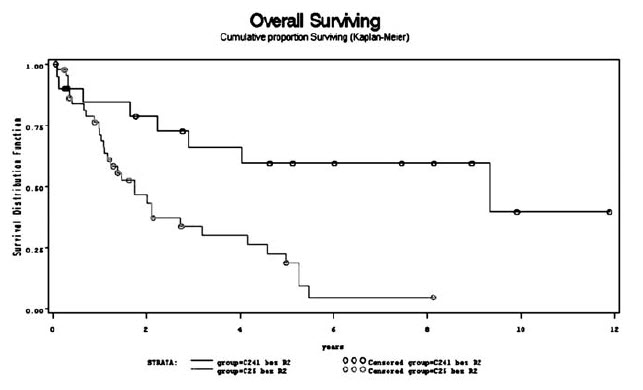
V souboru R0 resekcí je 5 leté přežití u nemocných s duktálním karcinomem pankreatu 18% a u karcinomu Vaterské papily je 5 leté přežití 59%. (Viz graf).

Obrázek 1:
Operační fotografie: stav po hemipankreatoduodenektomii s lymfadenektomií.
VP: Vena portae, AH: Arteria hepatica communis, TC: Truncus coeliacus, VL: vena lienalis, VCI: Vena cava inferior, VMS: Vena mesenterica superior, AMS: Arteria mesenterica superior
Diskuze
Možné využití imunohistochemických markerů v diagnostice: stanovení exprese MUC1, MUC4, MUC2 a MUC5A může být užitečné v diferenciální diagnostice periampulárních nádorů a také v časné a přesné detekci těchto nádorů (protilátky DU-PAN-2 Ab, Mab PAM4) [7,8]. Možné využití imunohistochemických markerů k léčbě: aktivní imunoterapie, která je cílená na MUC1, byla vyzkoušena na myších. Vakcina byla aplikována myším před vznikem karcinomu pankreatu preventivně a v druhé skupině byly myši imunizovány vakcinou po vzniku karcinomu. Vakcina indukovala imunitní odpověď na tumor jak profylakticky, tak terapeuticky [9]. Je tedy předpoklad, že by se mohla použít v adjuvantní léčbě karcinomu pankreatu.
Závěr
Zdá se tedy, že histologický typ nádoru je ten faktor, který určuje prognózu, ne anatomická lokalizace, ale v určité anatomické struktuře převažuje jeden nebo druhý histologický typ nádoru, a tím lze částečně vysvětlit rozdíl mezi prognózou duktálního karcinomu hlavy pankreatu a karcinomem Vaterské papily.
Literatura:
- Cubilla, A. L., Fitzgerald, P. J.: Surgical pathology aspects
of cancer of the ampulla-head-of-pancreas region, Monogr Pathol.,
1980; 21: 67-81
- Westgaard A, Tafjord S, Farstad IN, Cvancarova M, Eide TJ,
Mathisen O, Clausen OPF, Gladhaug IP, Pancreatobiliary versus
intestinal histologic type of differentiation is an independent
prognostic factor in resected periampullary adenocarcinoma, BMC
Cancer 2008, 8:170
- Krejčí T., Leffler J., Poloušek P. Dlouhodobé výsledky po
radikálních resekcích pro duktální adenokarcinom pankreatu –
desetileté zkušenosti Rozhl. Chir., 2007, roč. 86, č. 4, s.
174-179.
- Giuseppe Garcea, Ashley R Dennison, Clare J Pattenden,
Christopher P Neal, Christopher D Sutton, David P Berry: Survival
Following Curative Resection for Pancreatic Ductal Adenocarcinoma.
A Systematic Review of the Literature, JOP. J Pancreas (Online)
2008; 9(2):99-132.
- Fischer HP, Zhou H. Pathogenesis of carcinoma of the papilla of
Vater. J Hepatobiliary Pancreat Surg. 2004;11(5):301-9
- Yonezawa S, Goto M, Yamada N, Higashi M, Nomoto M. Expression
profiles of MUC1, MUC2, and MUC4 mucins in human neoplasms and
their relationship with biological behavior. Proteomics. 2008
Aug;8(16):3329-41.
- Yonezawa S, Higashi M, Yamada N, Yokoyama S, Goto M.
Significance of mucin expression in pancreatobiliary
neoplasms.
J Hepatobiliary Pancreat Surg. 2010 Mar;17(2):108-24 - Gold DV, Modrak DE, Ying Z, Cardillo TM, Sharkey RM, Goldenberg
DM, New MUC1 serum immunoassay differentiates pancreatic cancer
from pancreatitis. J Clin Oncol 2006; 24:252-8.
- Rong Y, Jin D, Wu W, Lou W, Wang D, Kuang T, Ni X, Qin1: Induction of protective and therapeutic anti-pancreatic cancer immunity using a reconstructed MUC1 DNA vaccine, BMC Cancer. 2009; 9: 191.
Datum přednesení příspěvku: 22. 4. 2011





