Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Chemoterapie
Téma: Novinky v protinádorové chemoterapii a v bioterapii
Číslo abstraktu: 043
Autoři: doc.RNDr. Vojtěch Adam, Ph.D.; Mgr. Jitka Petrlová, Ph.D.; Mgr. David Potěšil; MUDr. Hana Binková, Ph.D.; MUDr. Zuzana Horáková; J. Zehnálek; MUDr. Lucia Trnková; B. Sures; P. Lubal; doc.Ing. René Kizek, Ph.D.
Metalothionein, Platinová cytostatika, DNA, Interakce, Biosensor, Krevní sérum, Lidská moč
Úvod
Platinové komplexy hrají důležitou roli v chemoterapii různých zhoubných nádorů. Biologická aktivita prvního cytostatika založeného na platině – cisplatiny (cis-diamminodichloroplatina(II)), které je stále jedním z nejvíce používaných cytotoxických agens, byla objevena již v roce 1965 Rosenborgem během studia vlivu elektrického proudu na růst bakterií. Během následujících 40 let byly syntetizovány a testovány stovky platnatých a platičitých komplexů jako možná protirakovinová léčiva. Díky intenzivnímu vývoji v této oblasti bylo vyvinuto v osmdesátých letech minulého století platinové léčivo „druhé generace“ – carboplatina [cis-diammino(1,1-cyklobutan-dikarboxylato)platina(II)] jako méně toxická alternativa k cisplatině vykazující také menší počet vedlejších účinků. Dalším zástupcem používaných na platině založených cytostatik je oxaliplatina, která byla navržena v devadesátých letech minulého století jako „třetí generace“ platinových léčiv k překonání rezistence vůči cisplatině a carboplatině.
I přesto, že jsou platinová cytostatika úspěšně používána při léčbě nádorových onemocnění více než 30 let, mechanismus jejich biochemického účinku je stále nejasný. Všeobecně akceptovaný názor popisující jejich účinek je, že platinové léčivo indukuje své cytotoxické vlastnosti prostřednictvím vazby do struktury jaderné DNA a následným narušením transkripčních anebo replikačních mechanismů. Chaney et al. a další objevili, že cisplatina, carboplatina a oxaliplatina tvoří stejné typu aduktů na stejných místech ve struktuře DNA. Je tedy nezbytné nejen sledovat koncentraci platinového cytostatika v krvi pacienta, ale také studovat tvorbu Pt-DNA aduktů. Pro samotné stanovení platinových cytostatik bylo navrženo mnoho technik jako HPLC spojená s různými typy detektorů anebo elektrochemické metody. Na druhou stranu pro detekci Pt-DNA aduktů je využíváno technik velmi málo a navíc, biosensor pro detekci Pt-DNA aduktů ještě nebyl nikdy navržen. Na základě výše zmíněných fakt jsme se v této práci rozhodli navrhnout biosensor pro detekci Pt-DNA aduktů.
Materiál a Metody
Chemikálie
Metalothionein (králičí játra, MW 7143) obsahující 5,9 % Cd a 0,5 % Zn, chlorid sodný, dusičnan kademnatý, dusičnan zinečnatý a další použité chemikálie byly zakoupeny od Sigma Aldrich (St. Louis, USA), vyjma tris(2-karboxyethyl)fosfinu (TCEP), který byl od Molecular Probes (Evgen, Oregon, USA). Cisplatina byla syntetizována v Pliva-Lachema (Brno, Česká republika). Zásobní roztoky standardu metalothioneinu v koncentraci 10 ug.ml-1 a cisplatiny byly připravovány pomocí ACS vody (SigmaAldrich, USA) a uchovávány ve tmě při 4 °C. Pracovní standardní roztoky byly připravovány denně ředěním roztoků zásobních. Hodnoty pH byly měřeny pomocí WTW inoLab Level 3 pH metrem (Weilheim, Německo), který byl propojen s osobním počítačem a řízen programem (MultiLab Pilot Weilheim, Německo). pH-elektroda (SenTixH, pH 0-14/3M KCl) byla pravidelně kalibrována sadou WTW pufrů (Weilheim, Německo).
Elektrochemické metody
Elektrochemické měření bylo prováděno na AUTOLABu (EcoChemie, Holandsko) ve spojení s VA-Stand 663 (Metrohm, Švýcarsko). Byl použit tříelektrodový systém a skládal se z visící rtuťové kapkové elektrody (HMDE) jako pracovní elektrody s plochou 0,4 mm2, Ag/AgCl/3 mol.l-1, KCl elektrody jako referenční elektrody a platinového drátku jako pomocné elektrody. GPES software (EcoChemie, Holandsko) byl aplikován na zpracování hrubých dat za použití levelu 4 Savitzky a Golay filtru. Analyzované vzorky byly deoxygenovány pro měření pomocí probublávání argonem (99,999%) nasyceného vodou po 200 s. Všechny experimenty byly prováděny při pokojové teplotě. Cyklická voltametrie DNA byla prováděna v 0,3 M mravenčanu amonném (pH 6,5). Použité CV parametry byly: počáteční potenciál 0 V, potenciál obratu -1,8 V a konečný potenciál 0 V, potenciálový krok 2 mV/s, rychlost scanu 1 V, vylučovací potenciál -1,7 V a tA = 30 s.
Navržení biosensoru
Schéma navržení biosensoru spočívá v (1) obnovení povrchu HMDE (2) adsorpce MT z kapky vzorku na povrch HMDE při otevřeném potenciálu (240 s) (3) omytí elektrody v chloridu sodném (0,5 M, pH 6,4) (4) interakce modifikované elektrody s PtDNA aduktem při otevřeném potenciálu (400 s) (5) omytí elektrody v chloridu sodném (0,5 M, pH 6,4) (6) detekce MT pomocí diferenční pulzní voltametrie v 0,5 M chloridu sodném, pH 6,4. Metalothionein byl před samotnou adsorpcí na povrch HMDE zredukován pomocí TCEP. Byly použity následující DPV parametry: počáteční potenciál -1,2 V, koncový potenciál -0,3 V, modulační čas 0,057 s, časový interval 0,2 s, potenciálový krok 1,05 mV/s, modulační amplituda 25 mV.
Příprava DNA aduktu s cisplatinou a jeho purifikace
dsDNA získaná z kuřecích erytrocytů (100 ug/ml) byla modifikována cisplatinou v prostředí 10 mM NaClO4. Experimenty byly prováděny po dobu 24 hodin při teplotě 25°C v termostatovaném boxu (Model TER – 5/1, Chirana, Brno, Česká republika). Získaný Pt-DNA adukt byl purifikován pomocí ultrafiltrace (Microcon YM-30, Millipore). Pt-DNA adukt byl umístěn na membránu Microcon YM-30 a centrifugován (Eppendorf, 14 000 g) po dobu 10 min při 20°C. Všechny nízkomolekulární látky jako volná cisplatina a fragmenty DNA přítomné v roztoku prochází přes nitrocelulósovou membránu. Následně byl vzorek obrácen a centrifugován (14 000 g, 10 min, 20 °C). Získaný supernatant obsahoval Pt-DNA adukt.
Výsledky a diskuse
Jak jsme již zmínili, protirakovinový efekt platinových cytostatik pravděpodobně souvisí s konformačními změnami ve struktuře DNA. Jako modelové cytostatikum jsme zvolili cisplatinu, u které bylo navrženo několik možných Pt(II) komplexů s DNA. Interakce Pt(II) komplexů pravděpodobně nejčastěji probíhá na molekule guaninu (G) v DNA, ale jsou také známy i adukty dalších bazí. Na obrázku 1A je ukázána interakce komplexu Pt(II) s a) „chelatace pomocí guaninu a b) intrastrand cross-linking. V dřívějších pracích bylo ukázáno, že pomocí elektrochemických technik je možné studovat vznik aduktů Pt(II) s DNA. DNA poskytuje na HMDE dva redoxní signály – redukční signál adeninu a guaninu (CA), a oxidační signál redukčního produktu guaninu (G). V naší práci jsme studovali interakci Pt(II) komplexů s dvouřetězcovou (ds) DNA pomocí CV. Jak jsme předpokládali, dsDNA (100 ug/mL), která nebyla vystavena interakci s cisplatinou, poskytovala CA a G pík (Obr. 1B). Nedávno, bylo ukázáno, že pík G se snižuje v případě vzniku aduktu DNA s Pt(II). V našem experimentu byla DNA modifikována v přítomnosti 10 mM NaClO4 při teplotě 37°C. CV voltamogramy DNA se vzrůstající koncentrací cisplatiny jsou ukázány na Obr. 1B. Z obrázku je jasně patrné, že se vzrůstající koncentrací cisplatiny klesá pík guaninu. K výraznějšímu poklesu signálu dochází do koncentrace cisplatiny 60 uM, poté se již signál guaninu mění jen velmi pozvolna (Obr. 1C).
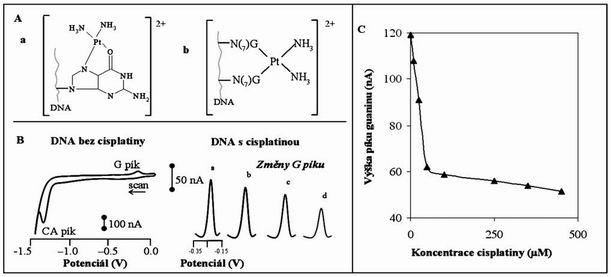
Obr. 1:
Dva možné modely Pt(II) s DNA chelatace pomocí guaninu (Aa) a intrastrand cross-linking (Ab).
Typické CV voltamogramy DNA bez a DNA s cisplatinou po matematické úpravě signálu (a-0, b-10, c-25 a d-50 mM) (B). Závislost výšky píku guaninu na různé koncentraci cisplatiny (C).
Další podrobnosti jsou uvedeny v sekci Materiály a Metody.
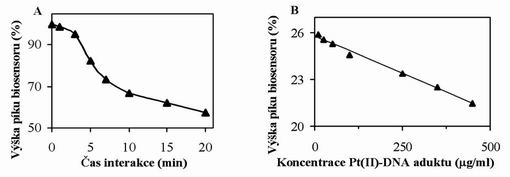
Obr. 2:
Závislost výšky píku biosensoru na době interakce s Pt-DNA aduktem (A) a na různé koncentraci Pt-DNA aduktu (B). Další podrobnosti jsou uvedeny v sekci a Metody.
Poté, co jsme pomocí CV potvrdili, že DNA interaguje s cisplatinou, jsme chtěli kvantifikovat a zjednodušit analyzovanou směs, která obsahovala nenavázanou cisplatinu, nemodifikovanou DNA a Pt-DNA adukt. Proto jsme se rozhodli odstranit pomocí ultrafiltrace veškeré nízkomolekulární látky včetně cisplatiny. Získaná směs byla následně analyzována pomocí CV. Koncentraci Pt-DNA aduktů jsme odvodili pomocí přidané cisplatiny. Se vzrůstající koncentrací Pt-DNA aduktů klesal pík guaninu. Je ovšem zřejmé, že pomocí CV se detekuje nejen DNA modifikovaná, ale taká nemodifikovaná, která vnáší do celého procesu analýzu falešně pozitivní výsledek. Z tohoto důvodu jsme použili námi navržený biosensor, jehož signál se měnil pouze v přítomnosti Pt-DNA aduktu, zatímco nemodifikovanou DNA nebyl schopen detekovat. Závislost výšky signálu biosensoru na době interakce s Pt-DNA aduktem je zobrazena na Obr. 2A. Z obrázku je patrné, že se signál biosensoru snižoval se vzrůstajícím časem interakce. Do desáté minuty byl tento pokles rychlý, poté už se pozorovaný signál měnil jen pozvolně. Jako nejvhodnější čas interakce jsme zvolili 5 min z důvodu rychlé a zároveň senzitivní analýzy. Závislost výšky signálu biosensoru na koncentraci PtDNA aduktu je ukázána na Obr. 2B. Se vzrůstající koncentrací Pt-DNA aduktu klesal signál biosensoru. Detekční limit Pt-DNA aduktu detekovaného pomocí námi navrženého biosenoru byl stanoven jak 312,5 ng/ml.
Závěr
Vývoj jednoduchých a rychlých sensorů a biosensorů pro stanovení různých látek je jedním z velmi důležitých úkolů bio-analytické chemie. V této práci se nám podařilo navrhnout biosensor pro stanovení Pt-DNA aduktů. Navržený biosensor je schopen analyzovat 100 ng Pt-DNA aduktu v jednom mililitru.
Poděkování
Příspě vek vznikl za podpory grantů GAČR 525/04/P132 a INCHEMBIOL 0021622412.
Literatura
- E. Raymond, S. Faivre, S. Chaney, J. Woynarowski, E. Cvitkovic,
Mol. Cancer. Ther. 1 (2002) 227.
- M. A. Fuertes, J. Castilla, C. Alonso, J.M. Perez, Curr. Med.
Chem. 10 (2003) 257.
- B. Rosenberg, L. Van Camp, T. Krigas, Nature 205 (1965)
698.
- R. S. Go, A. A. Adjei, J. Clin. Oncol. 17 (1999)
409.
- H. T. See, R.S. Freedman, A.P. Kudelka, T.W. Burke, D.M.
Gershenson, S. Tangjitgamol, J.J. Kavanagh, Int. J. Gynecol. Cancer
15 (2005) 209.
- A. Grothey, R.M. Goldberg, Expert Opin. Pharmaco. 5 (2004)
2159.
- D. Wang, S.J. Lippard, Nat. Rev. Drug Discov. 4 (2005)
307.
- S. G. Chaney, S.L. Campbell, B. Temple, E. Bassett, Y.B. Wu, M.
Faldu, J. Inorg. Biochem. 98 (2004) 1551.
- J. M. Woynarowski, W.G. Chapman, C. Napier, M.C.S. Herzig, P.
Juniewicz, Mol. Pharmacol. 54 (1998) 770.
- M. Kartalou, J.M. Essigmann, Mutat. Res-Fund. Mol. M. 478
(2001) 1.
- Z. Stefanka, S. Hann, G. Koellensperger, G. Stingeder, J. Anal.
Atom. Spectrom. 19 (2004) 894.
- D. Hernandez-Santos, M.B. Gonzalez-Garcia, A. Costa-Garcia,
Electrochim. Acta 50 (2005) 1895.
- V. Brabec, Electrochim. Acta 45 (2000) 2929.
- T. Hagemeister, M. Linscheid, J. Mass. Spectrom. 37 (2002)
731.
- V. Adam, J. Zehnalek, J. Petrlova, D. Potesil, B. Sures, L.
Trnkova, F. Jelen, J. Vitecek, R. Kizek, Sensors 5 (2005)
70.
- R. Kizek, J. Vacek, L. Trnkova, F. Jelen, Bioelectrochemistry
63 (2004) 19-24.
- V. Adam, J. Petrlova, D. Potesil, J. Zehnalek, B. Sures, L.
Trnkova, F. Jelen, R. Kizek, Electroanalysis 17 (2005)
1649.
- R. Zaludova, A. Zakovska, J. Kasparkova, Z. Balcarova, V.
Kleinwachter, O. Vrana, N. Farrell, V. Brabec, Eur. J. Biochem. 246
(1997) 508.
- O. Vrana, V. Brabec, Bioelectrochem. Bioenerg. 19 (1988) 145.
Datum přednesení příspěvku: 13. 5. 2005





