Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: Nové nádorové markery a prediktory
Číslo abstraktu: 187p
Autoři: Mgr. Jitka Petrlová, Ph.D.; prof. MUDr. Marek Svoboda, Ph.D.; O. Blaštík; MUDr. Zuzana Horáková; Z. Binková; Ing. Soňa Křížková, Ph.D.; doc.RNDr. Vojtěch Adam, Ph.D.; MUDr. Lucia Trnková; doc.Ing. René Kizek, Ph.D.
Metalothionein; analytické metody; elektrochemické metody; katalytické signály; nádorový marker
Úvod
Zhoubné novotvary jsou druhou nejzávažnější příčinou úmrtí v České Republice. Ročně u nás nově onemocní více jak 50 tisíc lidí různého věku a polovina z nich nádorovému onemocnění podlehne [1,2]. Včasná, rychlá a senzitivní diagnostika umožní zahájit léčbu onemocnění v počátku onemocnění, což v řadě případů vede k úplnému vyléčení. Z těchto důvodů se hledají nové analytické techniky a postupy jak toho cíle dosáhnout. Na druhé straně jsou hledány jasné a zřetelné ukazatele (markery), že v organismu je přítomen nebo vzniká zhoubný nádor. Naše experimentální práce se zabývá studiem metalothioneinu (MT) [3]. Jak nejnovější výzkum naznačuje, hladina MT může souviset s průběhem nádorového onemocnění [4]. Objev metalothioneinu
(MT) je datován rokem 1957, kdy Margoshes a Valee izolovali MT z koňských ledvin [5]. Metalothionein patří do skupiny intracelulárních, nízkomolekulárních na cystein velmi bohatých proteinů (obsah Cys až 30 % v molekule proteinu) o molekulové hmotnosti 6-10 kDa [3,6]. MT se skládají ze dvou vazebných domén á, â které jsou složeny z cysteinových klastrů (Obr.1).
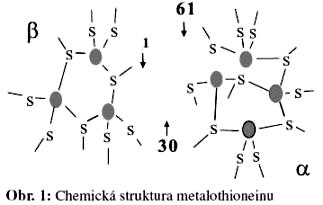
N-terminální část peptidu je označena jako â-doména, má tři vazebná místa pro dvojmocné ionty; C-terminální část peptidu
(á-doména) má schopnost vyvázat čtyři dvojmocné ionty kovů. V případě jednomocných iontů kovů je MT schopen vázat celkem 12 atomů [5].
Metody pro kvantifikaci MT
Proto, aby bylo možné studovat hladinu MT u pacientů je nezbytné mít k dispozici analytické nástroje. Současné metody používané pro kvantifikaci celkového množství MT v biologických materiálech je možné rozdělit do několika skupin.
První skupina je založena na měření množství iontu kovu vázaného na molekulu MT. Množství vázaného kovu je pak úměrné k množství MT. Bylo prokázáno, že afinita MT k různým iontům kovů se liší Hg(II) > Ag(I) ~ Cu(I) > Cd(II) > Zn(II) [7]. Mechanismus interakce MT k jednotlivým těžkým kovům není doposud uspokojivě vysvětlen, ale je využitelný pro analýzu obsahu MT. Nejjednodušší metodou pro kvantifikaci MT je Cd-hem metoda. Cd-hem metoda využívá dvou vlastností MT, jednak jde o tepelně stabilní protein, který je navíc schopný vázat sedm atomů kadmia místo zinku. Na podobném principu jsou založeny saturační techniky využívající Ag(I) a Hg(II).
Druhá skupina metod kvantfikuje celkový obsah MT s ohledem na množství vázaného těžkého kovu. Pro identifikaci kovu navázaného v MT, stanovení obsahu izoforem MT a celkového obsahu MT je možné využít řady kombinovaných analytických jako atomová absorpční spektrometrie s grafitovou kyvetou (GPC-AAS), vysokoúčinná kapalinová chromatografie v kombinaci s AAS (HPLC-AAS). Analýzu jednotlivých iontů kovů vázaných do struktury MT je možné kvantifikovat pomocí indukčně vázaného plazmatu v kombinaci s hmotnostní detekcí (ICP-MS). Relativně často využívaným způsobem detekce MT je kombinace nízkotlaké chromatografie na Sephadexu G-75 v kombinaci s atomovou absorpční spektrometrií (AAS).
Třetí skupina metod je založena na analýze sulfhydrylových zbytků na molekule MT většinou za využití chemické modifikace Ellmanovým činidlem. Chemická modifikace umožňuje analytické stanovení MT pomocí detekce v UV oblasti a fluorescence. Bez této modifikace je detekce MT pomocí výše uvedených metod velmi obtížná.
Čtvrtá skupina metod využívá protilátek proti MT. Mezi tyto metody se řadí radioimunoanalýza (RIA) a enzyme-linked immunosorbent assay (ELISA). ELISA a RIA metody vykazují vysokou senzitivitu pro detekci hladiny MT v tkáních. Z tohoto důvodu jsou poměrně často využívány pro studium exprese MT v tkáňových řezech.
Pátá skupina metod jsou metody separační. Separační techniky umožňují rozlišení jednotlivých izoforem MT. Pro separaci MT se často používá gelová permeační chromatografie na Sephadexu G-75 (GPC). Velmi málo je známo o separaci MT pomocí iontově výměnná chromatografie či vysoko účinná kapalinová chromatografie (HPLC). Nedávno byly identifikovány jednotlivé izoformy a pod-izoformy MT pomocí kombinace technik HPLC-MS [8,9].
Více pozornosti je věnováno stanovení MT za pomocí kapilární zónové elektroforézy (CZE). Separační technika CZE byla vyvinuta v 1990 a je využívána pro studium MT od roku 1993 [10]. Při stanovení MT pomocí CZE se testovaly vhodné podmínky pro separaci MT (kapiláry, elektrolyty, zařízení, detektory) [11-13]. Optimální parametry pro studium MT pomocí CZE byly publikovány v roce 1998 [11]. Data odpovídající stanoveni MT pomocí nepotažené a polyakrylamidem potažené kapiláry (běžně používány pro analýzu). Experimentální data naznačují, že nejvhodnější elektrolyt je borát-SDS o alkalickém pH v nepotažené kapiláře a Tris-HEPES pufr bez detergentů při neutrálním pH dával nejlepší rozlišení v polyakrylamidem-potažené kapiláře [14,15].
Šestá skupina metod je založená na detekci mRNA. Rodina lidského genu MT má 17 sub-genů (13 sub-genů náleží MT-1, dva náleží MT-2, jeden náleží MT-3, a jeden patří MT-4) na chromozomu 16 [16]. Proč má rodina genů MT tak mnoho sub-genů? Souvisí exprese genu se zvýšenou hladinou proteinu a každé izoformy MT? Jsou nějaké rozdíly ve funkci mezi izoformami? Pro
odpověď na tyto otázky je nezbytné studovat expresi každého sub-genu a funkci každé izoformy MT. Hladiny mRNA je možné studovat za využití polymerázové řetězové reakce v kombinaci s reverzní transkriptázou (RT-PCR) [9]. Jak je z uvedeného přehledu zřejmé všechny doposud využívané analytické techniky pro stanovení MT vyžadují poměrně složitou přípravu biologického vzorku. Je potřebné také připomenout, že uvedenou analytickou instrumentaci musí také obsluhovat vysoce specializovaný technik.
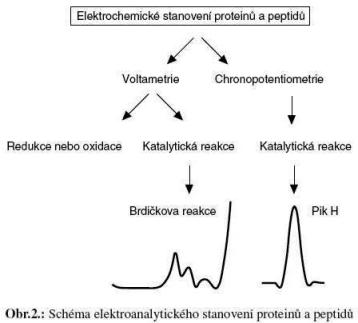
Sedmá skupina metod je založená na elektrochemické detekci MT [17-22]. Před více jak před 70 lety byla objevena Brdičkova reakce využívající komplexy kobaltu pro stanovení proteinů obsahující ve své molekule řadu sufhydrylových skupin. Vzniklý katalytický signál má tvar dvojvlny, tento tvar závisí na počtu cysteinu v molekule, na velikosti molekuly a její koncentraci
[23-28]. Další elektrochemická metoda, která také využívá katalytický signál vodíku vylučovaného ze základního elektrolytu v přítomnosti proteinu, se nazývá pík H [29]. Tento signál se měří pomocí chronopotenciometrické rozpouštěcí analýzy, kdy se zaznamenávána derivace převrácené hodnoty času ku potenciálu (dE/dt)-1 v závislosti na potenciálu E [23].
Závěr
Savčí MT má čtyři hlavní izoformy, avšak role jednotlivých izoforem MT v tkáni nejsou stále přesně známé, zvláště pak funkce biologická a fyziologická. Vedle separačních technik jsou velmi účinné i metody elektrochemické. Jak se ukazuje, katalytické signály vylučování vodíku umožňují také velmi senzitivní analýzu MT v attomolární koncentraci. Doposud neexistuje žádná systematická studie hladiny MT v tělních tekutinách a tkáních. Výzkum je především orientován na stanovení hladiny MT u jedinců exponovaných zvýšené koncentraci těžkých kovů. Analyzovány byly většinou orgány, ve kterých dochází ke značné kumulaci těžkých kovů (játra, ledviny, gonády, žábra apod.) a tedy i MT. Námi navržené elektroanalytické metody umožnily snížit limity stanovení MT a jsou aplikovatelné pro detekci MT v krevním séru a také v plné krvi. Studium množství MT v biologických vzorcích se ukazuje být velmi zajímavé, ale i důležité pro studium nádorových onemocnění.
Poděkování
Příspěvek vznikl za podpory grantů RASO 8/2005, MSMT INCHEMBIOL 0021622412 a GAČR 525/04/P132.
Literatura>
- J. Abrhamova Národní onkologický registr,
http://www.uzis.cz/cz/nor/norindx.htm (2005).
- L. Jurickova Zhoubné nádory v roce 2003, Aktuální informace
ústavu zdravotnických informací a statistiky České republiky
(2006) 1-4. - J.H.R. Kägi and A. Schäffer Biochemistry of Metallothionein,
Biochemistry 27 (1988) 8509-8515.
- J. Zelena, D. Potesil, J. Vacek, V. Adam, J. Hradecky, R.
Prusa, R. Kizek and B. Vojtesek Metalothionein jako prognosticky
marker nadoroveho onemocneni, Klinická onkologie 17 (2004)
190-195.
- J.H.R. Kägi Overview of metallothionein. Metallobiochemistry
Part B: metallothionein and related molecules, Methods Enzymol. 205
(1993) 613-626.
- M. Margoshes and B.L.A. Vallee A cadmium protein from equine
kidney cortex, J. Am. Chem. Soc. 79 (1957) 4813-4814.
- P. Moffatt and F. Denizeau Metallothionein in physiological and
physiopathological processes, Drug Metabolism Reviews 29 (1997)
261-307.
- H. Chassaigne and R. Lobinski Characterization of horse kidney
metallothionein isoforms by electrospray MS and reversedphase
HPLC-electrospray MS, Analyst 123 (1998) 2125-2130.
- Y. Hathout, K.J. Reynolds, Z. Szilagyi and C. Fenselau
Metallothionein dimers studied by nano-spray mass spectrometry,
Journal of Inorganic Biochemistry 88 (2002) 119-122.
- J.H. Beattie and M.P. Richards Separation of Metallothionein
Isoforms by Micellar Electrokinetic Capillary Chromatography,
Journal of Chromatography A 664 (1994) 129-134.
- J.H. Beattie Strategies for the qualitative and quantitative
analysis of metallothionein isoforms by capillary electrophoresis,
Talanta 46 (1998) 255-270.
- V. Virtanen, G. Bordin and A.R. Rodriguez Separation of
metallothionein isoforms with capillary zone electrophoresis using
an uncoated capillary column – Effects of pH, temperature, voltage,
buffer concentration and buffer composition, Journal of
Chromatography A 734 (1996) 391-400.
- G.Q. Liu, W. Wang and X.Q. Shan Factors Influencing the
Separation of Metallothioneins by Capillary Zone Electrophoresis,
Journal of Chromatography B-Biomedical Applications 653 (1994)
41-46.
- T. Minami, C. Yoshita, M. Tanaka, K. Kubo, N. Okabe and Y.
Okazaki Separation of metallothionein isoforms of mouse liver
cytosol by capillary zone electrophoresis, Talanta 46 (1998)
347-354.
- T. Minami, S. Ichida and K. Kubo Study of metallothionein using
capillary zone electrophoresis, Journal of Chromatography
B-Analytical Technologies in the Biomedical and Life Sciences 781
(2002) 303-311.
- A.T. Miles, G.M. Hawksworth, J.H. Beattie and V. Rodilla
Induction, regulation, degradation, and biological significance of
mammalian metallothioneins, Critical Reviews in Biochemistry and
Molecular Biology 35 (2000) 35-70.
- V. Dorcak and I. Sestakova Electrochemical behavior of
phytochelatins and related peptides at the hanging mercury drop
electrode in the presence of cobalt(II) ions, Bioelectrochemistry
68 (2006) 14-21.
- I. Sestakova and T. Navratil Voltammetric methods in
metallothionein research, Bioinorganic Chemistry and Applications 3
(2005) 43-53.
- B. Yosypchuk, I. Sestakova and L. Novotny Voltammetric
determination of phytochelatins using copper solid amalgam
electrode, Talanta 59 (2003) 1253-1258.
- M. Dabrio, A.R. Rodriguez, G. Bordin, M.J. Bebianno, M. De Ley,
I. Sestakova, M. Vasak and M. Nordberg Recent developments in
quantification methods for metallothionein, Journal of Inorganic
Biochemistry 88 (2002) 123-134.
- H. Vodickova, V. Pacakova, I. Sestakova and P. Mader Analytical
methods for determination of metallothioneins, Chemicke Listy 95
(2001) 477-483.
- I. Sestakova and P. Mader Voltammetry on mercury and carbon
electrodes as a tool for studies of metallothionein interactions
with metal ions, Cellular and Molecular Biology 46 (2000)
257-267.
- R. Kizek, J. Vacek, L. Trnková, B. Klejdus and L. Havel
Application of catalytic reactions on a mercury electrode for
metallothionein electrochemical detection, Chem. Listy 98 (2004)
160-167.
- J. Petrlova, O. Blastik, R. Prusa, J. Kukacka, D. Potesil, R.
Mikelova, V. Adam, J. Zehnalek and R. Kizek Using of
electrochemical methods for studying of metallothionein content in
the human blood serum of a patient poisoned by lead and treated by
platinum, Biomedical Papers 149 (2005) 485-488.
- J. Petrlova, O. Blastik, O. Zitka, V. Adam, D. Potesil, R.
Mikelova, R. Prusa, M. Stiborova, L. Trnkova, J. Zehnalek and R.
Kizek An electrochemical study of metallothionein as a potential
tumour disease marker, Annals the Polisch Chemical Society in press
(2005).
- J. Petrlova, O. Blastik, V. Adam, R. Mikelova, D. Potesil, L.
Trnkova, R. Prusa and R. Kizek Detekce zeptomolarnich hladin
metalothioneinu chronopotenciometrickou rozpousteci analyzou na
rtutove elektrode, in: J. Zaloudik and R. Vyzula (Eds.), XXIX.
Brnenske onkologicke dny, Masarykuv onkologicky ustav v Brne, Brno,
Ceska republika, 2005, pp. 111-113.
- J. Petrlova, O. Blastik, R. Prusa, J. Kukacka, R. Mikelova, M.
Stiborova, B. Vojtesek, V. Adam, O. Zitka, T. Eckschlager and R.
Kizek Analýza obsahu metatothioneinu u pacientů se zhoubným nádorem
prsu, tlustého střeva a nebo melanomem, Klin. Onkol. 19 (2006)
58-62.
- J. Petrlova, D. Potesil, R. Mikelova, O. Blastik, V. Adam, L.
Trnkova, F. Jelen, R. Prusa, J. Kukacka and R. Kizek Attomole
voltammetric determination of metallothionein, Electrochim. Acta in
press (2006).
- R. Kizek, J. Vacek, V. Adam and B. Vojtesek Metallothionein – cisplatine and anticancer therapy, Klin. Biochem. Metab. 13 (2004) 72-78.
Datum přednesení příspěvku: 11. 5. 2006





