Konference: 2011 2. pražské mezioborové onkologické kolokvium
Kategorie: Genitourinární nádory
Téma: Prezentace
Číslo abstraktu: 003
Autoři: prof. MUDr. Jindřich Fínek, Ph.D.
Epidemiologie
Česká republika se v incidenci zhoubných novotvarů již dlouho udržuje na předních místech v Evropě. Ovšem jen u dvou diagnóz dosahuje naprostého prvenství, a to u karcinomu kolorekta u mužů a karcinomu ledvin. Pokud však vítězíme u kolorektálního karcinomu o prsa, pak naše trpké vítězství v incidenci karcinomu ledviny je o několik koňských délek (graf 1).
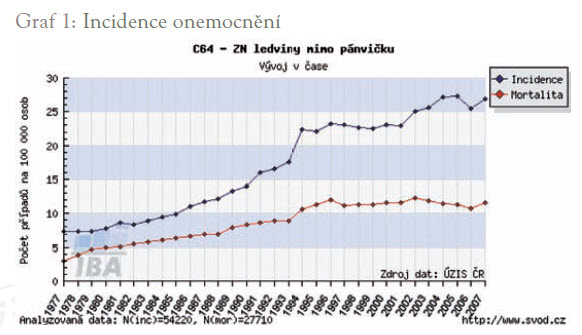
Maligní nádory ledvin tvoří 1 %-3 % všech zhoubných novotvarů, incidence tohoto onemocnění dosahuje svého vrcholu mezi 40. a 60. rokem věku. Konvenční světlobuněčný karcinom tvoří 70 % všech nádorů ledvin, u mužů se vyskytují zhoubné nádory ledvin dvakrát častěji než u žen. Toto onemocnění je často spojeno s chromozomálními aberacemi, delece krátkého raménka třetího chromozomu se vyskytuje u karcinomů ledvin sdružených s chorobou von Hippel-Lindau. V roce 2007 byla incidence zhoubného nádoru ledviny kromě pánvičky v České republice 26,92 a mortalita 11,55. V absolutních číslech bylo v roce 2007 hlášeno 2 795 těchto nádorů, zemřelo 1 199 nemocných.
Léčba světlobuněčného karcinomu ledviny
Chirurgická léčba představuje jedinou kurativní léčebnou metodu světlobuněčného karcinomu ledviny. Problémem je však časná diagnostika, kdy symptomy z nádorového bujení provázejí většinou již pokročilé, metastatické onemocnění. Adjuvantní pooperační radioterapie má význam pouze marginální, adjuvantní systémová léčba žádný. V léčbě generalizovaného karcinomu ledviny byla zkoušena řada léčebných postupů, ovšem s nevalnými výsledky. Budeme-li jejich efektivitu měřit prodloužením přežití nemocných, tak jeho statisticky významné prodloužení nepřinesla ani chemoterapie, ani kombinační schémata chemoterapie a cytokinů. Jediné schéma, které prodloužilo život nemocným, byla vysokodávkovaná imunoterapie bolusem interleukinu-2. Tato léčba byla ovšem zatížena velmi výraznou, mnohdy efektu neadekvátní, toxicitou.
Pozitivní změnu tohoto terapeutického nihilismu léčby generalizovaného karcinomu ledviny přinesly až klinické studie se sunitinibem a sorafenibem, bevacizumabem v kombinaci s interferonem alfa (IFN alfa), temsirolimem a everolimem.
Počty nemocných určených k systémové léčbě
Asi u 600 nemocných s karcinomem ledviny v České republice bylo onemocnění zjištěno v generalizovaném stavu, či u nich došlo k progresi dříve hlášeného onemocnění, mají dobrý performance status a jsou schopni profitovat ze systémové léčby.
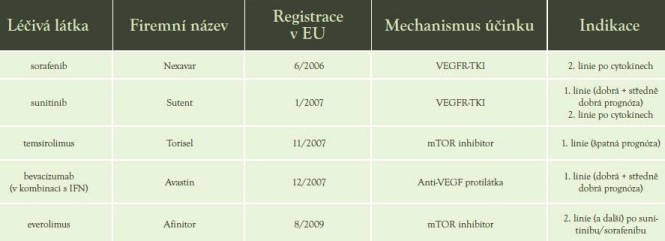
Za poslední necelé 4 roky se tedy objevilo na trhu 5 přípravků cílené léčby v indikaci terapie mRCC (tabulka 1). S novými možnostmi léčby nastává otázka, jak nejlépe nákladnou léčbu racionalizovat tak, aby přinášela co největší užitek pacientům a zároveň byla opodstatněná a dobře zdůvodnitelná. Vycházíme-li z doporučení EBM, základem pro rozhodování volby léčebné alternativy by měly být výsledky kontrolovaných klinických studií, které jsou také podkladem pro udělení registrace regulačními autoritami. Dalším vodítkem by měly být národní i mezinárodní doporučené léčebné postupy, které zohledňují výsledky klinických studií i schválené indikace.
Tabulka 1: Agens učené k léčbě mRCC
Vyjdeme-li z výše uvedených principů, podaří se nám zodpovědět následující otázky a dospět tak k poměrně racionálnímu rozhodujícímu schématu systémové léčby. Za kruciální otázky považujeme:
1. Jaká jsou kritéria posuzování účinnosti nové léčby a jak je interpretovat?
U pacientů s pokročilým nádorovým onemocněním jsou regulačními autoritami považovány za nejdůležitější parametry průkazu účinnosti (alespoň jeden musí být primární):(16)
2. Jaký lék volit v 1. linii léčby?
Dosud schválená léčiva na základě kontrolovaných klinických studií, ve kterých byla prokázána významně vyšší účinnost v porovnání s komparátorem (tj. dosud s jedinou dostupnou léčbou –cytokiny) jsou:
•sunitinib
•bevacizumab v kombinaci s IFN alfa
•temsirolimus
Sunitinib (Sutent©) ve fázi III klinického zkoušení v léčbě mRCC
Kontrolovaná randomizovaná klinická studie fáze III u pacientů s nepředléčeným mRCC(1,2)
Léčba:
sunitinib p.o. 50 mg/denně (režim 4/2 = 4 týdny léčba; 2 týdny bez léčby) versus IFN alfa s.c. (9 MIU 3x týdně) (tabulky 2, 3)
Tabulka 2: Porovnání léčby sunitinibem versus IFN alfa

*možné zkreslení cross-over designem (z IFN skupiny přešlo po progresi 33 % pacientů na léčbu sunitinibem a 32 % pac. na jinou VEGF-cílenou léčbu). Po cenzuře dat pacientů, u kterých se provedl cross-over z IFN na sunitinib (n = 25), byl medián OS pro sunitinib 26,4 měsíců a pro IFN alfa 20,0 měsíců, p = 0,036.
Tabulka 3: Charakteristika pac. dle prognostických kritérií (MSKCC) a performance statutu (ECOG):(1)
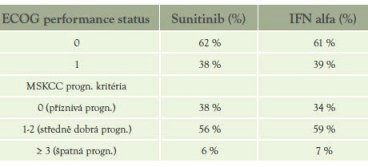
Účinnost prokázána napříč skupinami pacientů, nemocných se špatnou prognózou bylo však relativně málo.
Bezpečnost/nežádoucí účinky:(1,3,4)
Průjem (59 %), únava (73 %), zvracení (32 %), hypertenze (26 %), hand-foot syndrom (26 %), stomatitida (34 %), vyrážka (22 %), změna barvy kůže (26 %), hypotyreóza (12 %).
V této studii byla prokázána účinnost sunitinibu oproti IFN alfa v léčbě mRCC v prodloužení PFS, zvýšení ORR a prodloužení OS u ITT skupiny na hranici signifikance (p = 0,051).
Bevacizumab (Avastin©) v kombinaci s IFN alfa
Kontrolovaná randomizovaná klinická studie fáze III u pacientů s nepředléčeným mRCC (AVOREN)(5,6)
Léčba:
bevacizumab i.v.+ IFN alfa s.c. (10 mg/kg 1x/2 týdny + 9 MIU 3x týdně) versus IFN-alfa s.c. (9 MIU 3x týdně) (tabulky 4, 5)
Tabulka 4: Porovnání léčby bevacizumabem + IFN alfa versusIFN alfa

*možné zkreslení – po progresi povolen přechod na další VEGF-cílenou léčbu
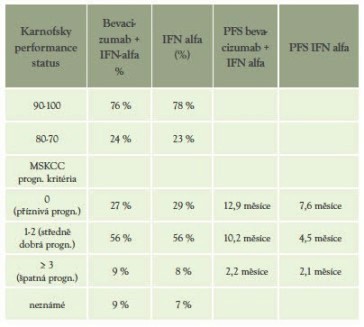
Tabulka 5: Charakteristika pacientů dle prognostických kritérií (MSKCC) a performance statutu (Karnofsky)(5)
Bezpečnost/nežádoucí účinky:((3,5)
Únava (33 %), proteinurie (18 %), hypertenze (26 %), anorexie (36 %), tromboembolické příhody (3 %)
Studie Avoren jasně prokázala superioritu kombinace bevacizumab a IFN alfa oproti IFN alfa statisticky signifikantním prodloužením PFS, vyšším ORR a nesignifikantním trendem k prodloužení OS (HR= 0,91, p = 0,33).
Temsirolimus (Torisel©) v léčbě mRCC
Kontrolovaná, randomizovaná, trojramenná klinická studie fáze III u pacientů s nepředléčeným mRCC u nemocných se špatnou prognózou
Léčba:
Temsirolimus 25 mg i.v. 1x týdně versustemsirolimus 15 mg i.v. 1x týdně + IFN-alfa 6 MIU s.c. 3x týdně versus IFN alfa (3 MIU, se zvýšením až na 18 MIU s.c. 3x týdně) (tabulka 6)
Vyšší účinnost prokázána v rameni se samotným temsirolimem(7,8)
Tabulka 6: Porovnání léčby temsirolimem versus
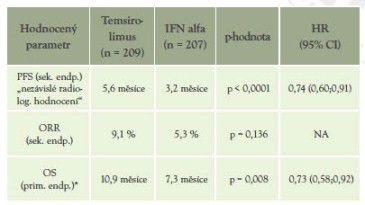
*stat. signif. rozdíl
Špatná prognóza definována jako přítomnost 3 nebo více ze 6 prognosticky rizikových faktorů:
(méně než 1 rok od stanovení diagnózy do randomizace, Karnofsky index 60 nebo 70, Hb pod spodní hranicí normy, hladina přepočteného vápníku více než 10 mg/dl, LDH > 1,5 násobek horní hranice normy, více než 1 orgán s metastázou)(7,8)
Bezpečnost/nežádoucí účinky:(7,8)
Stomatitida (20 %), únava (51 %), vyrážka (47 %), dušnost (28 %), kašel (26 %), infekce (27 %), otoky (27 %), hyperlipidémie (27 %), hypercholesterolemie (24 %), hyperglykémie (26 %).
Ve studii prokázána u nemocných ve špatné prognostické skupině účinnost temsirolimu signifikantním prodloužením OS a PFS.
Na základě výše uvedených dat lze stanovit následující racionální algoritmus léčby u pacientů s mRCC v 1. linii léčby (tabulka 7)
Tabulka 7: Prognóza onemocnění při léčbě sunitinibem nebo bevacizumabem + IFN alfa versus temsirolimem

3. Jaký postup volit ve druhé, popřípadě dalších liniích léčby mRCC?
Přes nesporný přínos cílené léčby v léčbě i mRCC dochází bohužel vždy po určité době ke vzniku rezistence na léčbu a u všech nemocných k progresi onemocnění.
Ve 2. linii léčby máme k dispozici již méně dat, jsou k dispozici pouze u dvou agens:
Everolimus (Afinitor©)
Randomizovaná, dvojitě slepá, placebem kontrolovaná studie u pacientů s metastazujícím renálním karcinomem, jejichž onemocnění progredovalo po nebo v průběhu předchozí linie léčby sunitinibem nebo sorafenibem. Byla povolena také předchozí léčba bevacizumabem a IFN alfa. Studie RECORD-(9,10,11)
Léčba:
everolimus 10 mg p.o. + BSCversus placebo + BSC (tabulka 8)
Tabulka 8: Porovnání léčby everolimem versus placebem
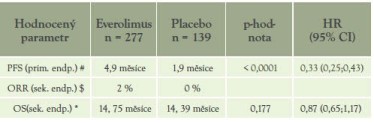
# 67% snížení rizika progrese nebo úmrtí
* zkresleno v důsledku cross-over designu povoleného při progresi v placebové větvi (umožněn přechod na everolimus)
$ nicméně výrazné ovlivnění SD (stabilizace onemocnění) 67 % everolimus vs. 32 % placebo
Charakteristika pacientů dle prognostických kritérií (MSKCC) a předchozí léčby(9,11) (tabulka 9)
Tabulka 9: Porovnání na základě prognózy a předchozí léčby
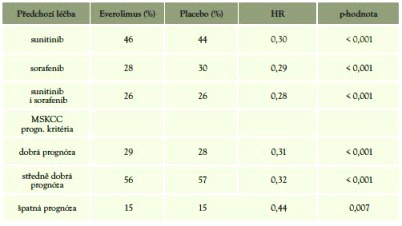
Statisticky signifikantní rozdíl v PFS ve všech prognostických skupinách i skupinách nemocných rozdělených dle předchozí léčby
Bezpečnost/nežádoucí účinky(10,11)
Nutnost přerušení léčby: 7 % sorafenib vs. 0 % placebo
Stomatitida (37 %), vyrážka (29 %), únava (30 %), pneumonitida (10 %), infekce (24 %), otoky (24 %), hyperglykémie (12 %), hypercholesterolemie (20 %), hyperlipidemie (15 %), anémie (37 %) U everolimu byla prokázána účinnost ve 2. linii (3. linii) po předchozí léčbě sunitinibem, sorafenibem nebo oběma signifikantním prodloužením PFSA.
Sorafenib (NEXAVAR©)
Randomizovaná, placebem kontrolovaná studie fáze III u pacientů po selhání předchozí léčby cytokiny (studie TARGET)(12,13)
Léčba:
sorafenib 400 mg p.o. 2x týdně versus placebo (tabulky 10, 11)
Tabulka 10: porovnání léčby sorafenibem versusplacebem
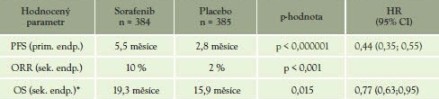
*nebylo dosaženo statistické významnosti; možné zkreslení cross-over designem, který umožněn po 1. interim analýze (ani v době 1. interim analýzy, ještě nezkreslené cross-over designem, nebylo dosaženo statisticky signifikantního rozdílu)
Tabulka 11: Charakteristika pacientů dle prognostických skupin a předchozí léčby
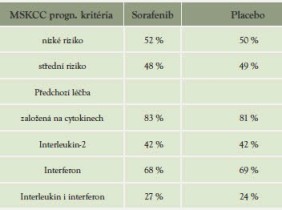
U všech podskupin signifikantní prodloužení PFS
Bezpečnost/Nežádoucí účinky(12)
Nutnost přerušení léčby: 21 % sorafenib vs. 6 % placebo (p < 001)
Průjem (43 %), únava (37 %), zvracení (16 %), hypertenze (17 %), hand-foot syndrom (30 %), vyrážka (40 %), alopecie (27 %)
U sorafenibu byla prokázána účinnost oproti placebu ve 2. linii léčby mRCC po selhání cytokinů.
Výsledky další randomizované studie fáze II podávání sorafenibu u nepředléčených pacientů nepodporují podávání sorafenibu v 1. linii léčby(14)
Léčba:
sorafenib 400 mg 2x denně versusIFN 9 MIU 3x týdně (po progresi onemocnění možnost přechodu z IFN na sorafenib nebo zvýšení dávky na 600 mg 2x denně) (tabulka 12)
Tabulka 12: porovnání léčby sorafenibem a IFN

Neprokázána účinnost sorafenibu v 1. linii (nebyl prokázán statisticky signifikantní rozdíl v PFS ani ORR v porovnání s IFN)
Tabulka 13 Výsledky poolované analýzy dvou jednoramenných studií se sunitinibem ve 2. linii mRCC po selhání IFN-alfa

Sunitinib (Sutent©)
2 jednoramenné studie fáze II ve 2. linii po selhání cytokinů (n = 105+63). Na základě těchto studií byl sunitinib v roce 2006 zaregistrovaný v indikaci mRCC (tabulka 13).
Na základě výše uvedených dat lze stanovit následující racionální algoritmus léčby u pacientů s mRCC ve 2. linii léčby (tabulka 14)
Tabulka 14 2. Linie léčby u pacientů s mRCC

Poznámka: Data pro 2. linii po selhání bevacizumabu + IFN alfa nejsou k dispozici. Nejsou dostupná data prokazující účinnost sorafenibu v 1. linii.(12,13,14)
4. Jak nahlížet na sekvenční léčbu sunitinib - sorafenib a vice versa?
Vezmeme-li v úvahu časovou posloupnost, s jakou byla postupně udělována registrace na základě výsledků klinických studií, a příchod nových cílených léků na trh, je zcela pochopitelné, že po selhání jedné léčby se pacientům nabízela další alternativní léčba, a to i přes neexistenci dat EBM nejvyššího stupně (kontrolované klinické studie).
Po selhání sunitinibu tak byl pacientům podáván sorafenib a naopak, přestože nebyly dostupné kontrolované prospektivní studie, které by podporovaly toto sekvenční podávání. Přesto byl jistě tento postup v dané době správný a pro pacienty přínosný.
V 8/2009 však byl registrován a v USA i Evropě postupně uváděn na trh everolimus, u kterého byla v placebem kontrolované klinické studii fáze III prokázána účinnost ve 2. linii léčby po selhání VEGFR-TKI (viz výše).
Everolimus tedy získal na základě průkazu EBM své specifické místo ve 2. linii léčby po selhání sunitinibu nebo sorafenibu (popř. právě vzhledem k dřívější praxi podávání obou těchto léčiv v sekvenci i místo ve 3. linii po předchozím podání obou těchto VEGFR-TKI).
Jaké jsou tedy hlavní kontroverze podávání sekvenční léčby sunitinib (event. sorafenib)→everolimus vesus sunitinib → sorafenib(sorafenib → sunitinib)?
Stručný souhrn studie „diLorenzo“(15)
Prospektivní, otevřená, nerandomizovaná, multicentrická studie fáze II podávání sorafenibu po selhání sunitinibu
Výsledky
Závěr
Na základě výše uvedených dat by po selhání léčby sunitinibem (popř. sorafenibem) měl být podán everolimus.
Pro podávání sekvence VEGFR-TKIs nejsou dostupná relevantní data.
5. Jaký je tedy na základě klinických studií fáze III racionální algoritmus léčby pokročilého či metastatického světlobuněčného renálního karcinomu?
Na základě výše uvedených údajů opírajících se o výsledky kontrolovaných, randomizovaných, prospektivních klinických studií, jež vedly k udělení registrace v příslušných indikacích, lze doporučit tento algoritmus léčby mRCC (tabulka 15)
Tabulka 15: Doporučená léčba mRCC
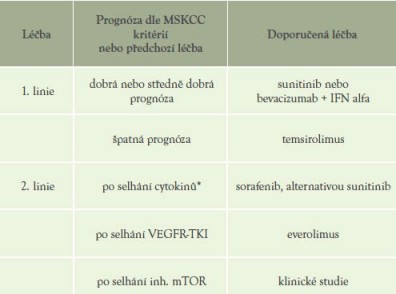
*Vzhledem k dostupné účinnější léčbě by léčba cytokiny měla být postupně opouštěna. U nově diagnostikovaných pacientů již není opodstatnění pro jejich podávání.
Závěr
Generalizovaný světlobuněčný karcinom se stal cílem mnoha studií s biologickými agens, které vedly k registraci 5 nových léků v boji s touto chorobou. Další budou přicházet, tím vyvstane potřeba správného postavení preparátů v algoritmu léčby pro dosažení co nejvyššího benefitu pro nemocného. Snažili jsme se tento algoritmus najít na podkladě studií.
Léčebná agens v boji s mRC:
Bevacizumab (Avastin ®) je protilátka proti vaskulárnímu endoteliálnímu růstovému faktoru (VEGF), který je nejdůležitějším proangiogenním faktorem ve vývoji nádoru. Bevacizumab je humanizovaná monoklonální protilátka proti VEGF, váže se na VEGF, a zabraňuje tak interakci mezi VEGF a tyrosinkinázovými receptory VEGFR 1 a VEGFR 2. Jeho výhodou je neexistence predikátoru účinnosti a prokázání účinnosti v léčbě většiny solidních nádorů.
Temsirolismus (Torisel®) je selektivní inhibitor mTOR (savčí rapamycinový cílový receptor). Temsirolimus se váže na intracelulární protein (FKPB-12) a komplex protein-temsirolimus a inhibuje aktivaci mTOR, který kontroluje buněčné dělení. Inhibice aktivity mTOR vede k blokádě růstu léčených nádorových buněk ve fázi G1 v důsledku selektivního narušení translace regulačních proteinů buněčného cyklu, jako jsou např. D-cykliny, c-myc a ornitin dekarboxyláza. Temsirolimus uplatňuje svůj účinek vytvořením komplexu s FKBP-12 a mTOR. Když se mTOR naváže na komplex, jeho schopnost fosforylovat a tím kontrolovat aktivitu translačních proteinů (4E-BP1 a S6K, obě v metabolické cestě P13 kinázy/AKT směrem dolů od mTOR), které kontrolují buněčné dělení, je blokována.
Kromě regulace proteinů buněčného cyklu, mTOR umí regulovat translaci hypoxií indukovatelných faktorů, HIF-1 a HIF-2 alfa. Tyto transkripční faktory regulují schopnost nádoru adaptovat se na hypoxické mikroprostředí a produkovat angiogenní faktory, jako např. vaskulární endoteliální růstový faktor (VEGF). Protinádorový účinek temsirolimu částečně využívá své schopnosti potlačovat hladiny HIF a VEGF v nádoru a jeho mikroprostředí, čímž se zpomaluje tvorba nových cév.
Temsirolimus jako jediný prokázal signifikantně vyšší účinnost (PFS, OS) než IFN alfa u specifické skupiny pacientů s mRCC – u pacientů s vysokým rizikem (3 a více rizikových prognostických faktorů).
Sunitinib malát (Sutent ®) je inhibitor celé řady tyrosinkináz, tedy enzymů, které hrají klíčovou úlohu v procesu buněčné proliferace. Jedná se především o tyrosinkinázy asociované s receptory pro destičkový růstový faktor (PDGFR α a β) a vaskulární endoteliální růstový faktor (VEGFR 1, 2 a 3). Zmiňován je však i inhibiční účinek na receptory pro faktor kmenových buněk (KIT), Fms-like tyrosinázu-3 (FLT3), kolonie stimulující faktor typu 1 (CSF-1R) a neurotrofický faktor odvozený od gliových buněk (RET). Tato inhibice ve výsledku působí zpomalení novotvorby cév, zpomalení růstu nádoru a snížení rizika vzniku metastáz.
Sunitinib se tak stal v první linii léčby novým standardem v léčbě metastatického karcinomu ledviny a jeho podání je zahrnuto do odborných doporučení Evropské urologické spole nosti (EAU) i doporučení NCCN. U všech rizikových skupin je výrazně účinnější než IFN alfa, léčeným nemocným zvyšuje kvalitu života.
Sorafenib (Nexavar®)je multikinázový inhibitor, který snižuje in vitro proliferaci nádorových buněk. Sorafenib byl původně syntetizován jako inhibitor Raf kinázy. Jedná se o multikinázový inhibitor, jehož spektrum účinku zahrnuje rovněž inhibici angiogenních faktorů. Jedná se o orální lék, jehož injekční forma nebyla zatím připravena. Po perorálním podání sorafenibu se dosahuje maximální plazmatické koncentrace za 3 hodiny, další nárůst byl pozorován po 10 hodinách, což svědčí pro reabsorbci ze střeva. Pokud byl sorafenib podán s tučným jídlem, jeho absorpce se snížila o 30 %. Sorafenib je metabolizován primárně játry. Při perorálním podání 100 mg roztoku sorafenibu bylo 96 % látky vyloučeno během 14 dní, přitom se 77 % dávky vyloučilo stolicí a 19 % močí.
Everolimus (Afinitor ©)
RAD001 (everolimus, Afinitor) je perorální mTOR inhibitor, aktivní derivát rapamycinu se širokou protinádorovou aktivitou. mTOR je hlavním spínačem buněčného růstu a proliferace ve zdravých buňkách. Deregulace signální cesty zprostředkované mTOR způsobuje u nádorového onemocnění ztrátu kontroly růstu. mTOR reguluje reakce na změny buněčného prostředí, buněčný růst a proliferaci buněk, abiogenezi, transkripci genů, opravy poškozené DNA, antiestrogeny.
Everolimus je perorální mTOR inhibitor, který:
Everolimus je první a jediná průkazná terapie, která efektivně léčí pacienty s mRCC, kteří progredovali po anti-VEGF léčbě.
Everolimus významně snižuje riziko progrese onemocnění, a to bez zhoršení kvality života.
Literatura:
doc. MUDr. Jindřich Fínek, Ph.D.Onkologické a radioterapeutické oddělení FN Plzeň e-mail: finek@finek.cz
Česká republika se v incidenci zhoubných novotvarů již dlouho udržuje na předních místech v Evropě. Ovšem jen u dvou diagnóz dosahuje naprostého prvenství, a to u karcinomu kolorekta u mužů a karcinomu ledvin. Pokud však vítězíme u kolorektálního karcinomu o prsa, pak naše trpké vítězství v incidenci karcinomu ledviny je o několik koňských délek (graf 1).

Maligní nádory ledvin tvoří 1 %-3 % všech zhoubných novotvarů, incidence tohoto onemocnění dosahuje svého vrcholu mezi 40. a 60. rokem věku. Konvenční světlobuněčný karcinom tvoří 70 % všech nádorů ledvin, u mužů se vyskytují zhoubné nádory ledvin dvakrát častěji než u žen. Toto onemocnění je často spojeno s chromozomálními aberacemi, delece krátkého raménka třetího chromozomu se vyskytuje u karcinomů ledvin sdružených s chorobou von Hippel-Lindau. V roce 2007 byla incidence zhoubného nádoru ledviny kromě pánvičky v České republice 26,92 a mortalita 11,55. V absolutních číslech bylo v roce 2007 hlášeno 2 795 těchto nádorů, zemřelo 1 199 nemocných.
Léčba světlobuněčného karcinomu ledviny
Chirurgická léčba představuje jedinou kurativní léčebnou metodu světlobuněčného karcinomu ledviny. Problémem je však časná diagnostika, kdy symptomy z nádorového bujení provázejí většinou již pokročilé, metastatické onemocnění. Adjuvantní pooperační radioterapie má význam pouze marginální, adjuvantní systémová léčba žádný. V léčbě generalizovaného karcinomu ledviny byla zkoušena řada léčebných postupů, ovšem s nevalnými výsledky. Budeme-li jejich efektivitu měřit prodloužením přežití nemocných, tak jeho statisticky významné prodloužení nepřinesla ani chemoterapie, ani kombinační schémata chemoterapie a cytokinů. Jediné schéma, které prodloužilo život nemocným, byla vysokodávkovaná imunoterapie bolusem interleukinu-2. Tato léčba byla ovšem zatížena velmi výraznou, mnohdy efektu neadekvátní, toxicitou.
Pozitivní změnu tohoto terapeutického nihilismu léčby generalizovaného karcinomu ledviny přinesly až klinické studie se sunitinibem a sorafenibem, bevacizumabem v kombinaci s interferonem alfa (IFN alfa), temsirolimem a everolimem.
Počty nemocných určených k systémové léčbě
Asi u 600 nemocných s karcinomem ledviny v České republice bylo onemocnění zjištěno v generalizovaném stavu, či u nich došlo k progresi dříve hlášeného onemocnění, mají dobrý performance status a jsou schopni profitovat ze systémové léčby.
Za poslední necelé 4 roky se tedy objevilo na trhu 5 přípravků cílené léčby v indikaci terapie mRCC (tabulka 1). S novými možnostmi léčby nastává otázka, jak nejlépe nákladnou léčbu racionalizovat tak, aby přinášela co největší užitek pacientům a zároveň byla opodstatněná a dobře zdůvodnitelná. Vycházíme-li z doporučení EBM, základem pro rozhodování volby léčebné alternativy by měly být výsledky kontrolovaných klinických studií, které jsou také podkladem pro udělení registrace regulačními autoritami. Dalším vodítkem by měly být národní i mezinárodní doporučené léčebné postupy, které zohledňují výsledky klinických studií i schválené indikace.
Tabulka 1: Agens učené k léčbě mRCC

Vyjdeme-li z výše uvedených principů, podaří se nám zodpovědět následující otázky a dospět tak k poměrně racionálnímu rozhodujícímu schématu systémové léčby. Za kruciální otázky považujeme:
- Jaká jsou kritéria posuzování účinnosti nové léčby a jaká je
jejich validita?
- Jaký lék volit v 1. linii léčby?
- Jaký lék volit ve 2. (popř. 3. linii) léčby?
- Jak nahlížet na sekvenční léčbu sunitinib → sorafenib a vice
versa?
- Jaký je tedy výsledný racionální algoritmus léčby mRCC?
1. Jaká jsou kritéria posuzování účinnosti nové léčby a jak je interpretovat?
U pacientů s pokročilým nádorovým onemocněním jsou regulačními autoritami považovány za nejdůležitější parametry průkazu účinnosti (alespoň jeden musí být primární):(16)
- a) PFS (progression free survival)
Jedná se o nejvýznamnější parametr, u všech výše uvedených léčiv ve studii fáze III (kromě temsirolimu) prokázán statisticky signifikantní rozdíl oproti kontrolní skupině; odráží stadium léčby a prognózu onemocnění ldelší PFS v 1. linii léčby než ve 2. linii a u pacientů s dobrou/středně dobrou prognózou versus špatnou prognózou. - b) OS (overall survival
Regulačními autoritami je OS považováno za velmi důležitý ukazatel účinnosti, nicméně vzácně je ve studiích dosaženo statisticky významného rozdílu vzhledem ke cross-over designu povolovanému z etických důvodů po selhání léčby kontrolním léčivem nebo placebem. Z výše uvedených léčiv byl statisticky signifikantní rozdíl v OS prokázán pouze ve studii s temsirolimem.
Dalším (sekundárním) parametrem účinnosti je:
- c) ORR (objective response rate, úplná+částečná odpověď), hodnoceno za použití RECIST kritérií, samotný ORR však nestačí k průkazu účinnosti.
2. Jaký lék volit v 1. linii léčby?
Dosud schválená léčiva na základě kontrolovaných klinických studií, ve kterých byla prokázána významně vyšší účinnost v porovnání s komparátorem (tj. dosud s jedinou dostupnou léčbou –cytokiny) jsou:
•sunitinib
•bevacizumab v kombinaci s IFN alfa
•temsirolimus
Sunitinib (Sutent©) ve fázi III klinického zkoušení v léčbě mRCC
Kontrolovaná randomizovaná klinická studie fáze III u pacientů s nepředléčeným mRCC(1,2)
Léčba:
sunitinib p.o. 50 mg/denně (režim 4/2 = 4 týdny léčba; 2 týdny bez léčby) versus IFN alfa s.c. (9 MIU 3x týdně) (tabulky 2, 3)
Tabulka 2: Porovnání léčby sunitinibem versus IFN alfa

*možné zkreslení cross-over designem (z IFN skupiny přešlo po progresi 33 % pacientů na léčbu sunitinibem a 32 % pac. na jinou VEGF-cílenou léčbu). Po cenzuře dat pacientů, u kterých se provedl cross-over z IFN na sunitinib (n = 25), byl medián OS pro sunitinib 26,4 měsíců a pro IFN alfa 20,0 měsíců, p = 0,036.
Tabulka 3: Charakteristika pac. dle prognostických kritérií (MSKCC) a performance statutu (ECOG):(1)

Účinnost prokázána napříč skupinami pacientů, nemocných se špatnou prognózou bylo však relativně málo.
Bezpečnost/nežádoucí účinky:(1,3,4)
Průjem (59 %), únava (73 %), zvracení (32 %), hypertenze (26 %), hand-foot syndrom (26 %), stomatitida (34 %), vyrážka (22 %), změna barvy kůže (26 %), hypotyreóza (12 %).
V této studii byla prokázána účinnost sunitinibu oproti IFN alfa v léčbě mRCC v prodloužení PFS, zvýšení ORR a prodloužení OS u ITT skupiny na hranici signifikance (p = 0,051).
Bevacizumab (Avastin©) v kombinaci s IFN alfa
Kontrolovaná randomizovaná klinická studie fáze III u pacientů s nepředléčeným mRCC (AVOREN)(5,6)
Léčba:
bevacizumab i.v.+ IFN alfa s.c. (10 mg/kg 1x/2 týdny + 9 MIU 3x týdně) versus IFN-alfa s.c. (9 MIU 3x týdně) (tabulky 4, 5)
Tabulka 4: Porovnání léčby bevacizumabem + IFN alfa versusIFN alfa

*možné zkreslení – po progresi povolen přechod na další VEGF-cílenou léčbu
Tabulka 5: Charakteristika pacientů dle prognostických kritérií (MSKCC) a performance statutu (Karnofsky)(5)

Bezpečnost/nežádoucí účinky:((3,5)
Únava (33 %), proteinurie (18 %), hypertenze (26 %), anorexie (36 %), tromboembolické příhody (3 %)
Studie Avoren jasně prokázala superioritu kombinace bevacizumab a IFN alfa oproti IFN alfa statisticky signifikantním prodloužením PFS, vyšším ORR a nesignifikantním trendem k prodloužení OS (HR= 0,91, p = 0,33).
Temsirolimus (Torisel©) v léčbě mRCC
Kontrolovaná, randomizovaná, trojramenná klinická studie fáze III u pacientů s nepředléčeným mRCC u nemocných se špatnou prognózou
Léčba:
Temsirolimus 25 mg i.v. 1x týdně versustemsirolimus 15 mg i.v. 1x týdně + IFN-alfa 6 MIU s.c. 3x týdně versus IFN alfa (3 MIU, se zvýšením až na 18 MIU s.c. 3x týdně) (tabulka 6)
Vyšší účinnost prokázána v rameni se samotným temsirolimem(7,8)
Tabulka 6: Porovnání léčby temsirolimem versus

*stat. signif. rozdíl
Špatná prognóza definována jako přítomnost 3 nebo více ze 6 prognosticky rizikových faktorů:
(méně než 1 rok od stanovení diagnózy do randomizace, Karnofsky index 60 nebo 70, Hb pod spodní hranicí normy, hladina přepočteného vápníku více než 10 mg/dl, LDH > 1,5 násobek horní hranice normy, více než 1 orgán s metastázou)(7,8)
Bezpečnost/nežádoucí účinky:(7,8)
Stomatitida (20 %), únava (51 %), vyrážka (47 %), dušnost (28 %), kašel (26 %), infekce (27 %), otoky (27 %), hyperlipidémie (27 %), hypercholesterolemie (24 %), hyperglykémie (26 %).
Ve studii prokázána u nemocných ve špatné prognostické skupině účinnost temsirolimu signifikantním prodloužením OS a PFS.
Na základě výše uvedených dat lze stanovit následující racionální algoritmus léčby u pacientů s mRCC v 1. linii léčby (tabulka 7)
Tabulka 7: Prognóza onemocnění při léčbě sunitinibem nebo bevacizumabem + IFN alfa versus temsirolimem

3. Jaký postup volit ve druhé, popřípadě dalších liniích léčby mRCC?
Přes nesporný přínos cílené léčby v léčbě i mRCC dochází bohužel vždy po určité době ke vzniku rezistence na léčbu a u všech nemocných k progresi onemocnění.
Ve 2. linii léčby máme k dispozici již méně dat, jsou k dispozici pouze u dvou agens:
- Everolimus (po selhání sunitinibu nebo sorafenibu nebo
obou)
- Sorafenib nebo sunitinib (po selhání cytokinů)
Everolimus (Afinitor©)
Randomizovaná, dvojitě slepá, placebem kontrolovaná studie u pacientů s metastazujícím renálním karcinomem, jejichž onemocnění progredovalo po nebo v průběhu předchozí linie léčby sunitinibem nebo sorafenibem. Byla povolena také předchozí léčba bevacizumabem a IFN alfa. Studie RECORD-(9,10,11)
Léčba:
everolimus 10 mg p.o. + BSCversus placebo + BSC (tabulka 8)
Tabulka 8: Porovnání léčby everolimem versus placebem

# 67% snížení rizika progrese nebo úmrtí
* zkresleno v důsledku cross-over designu povoleného při progresi v placebové větvi (umožněn přechod na everolimus)
$ nicméně výrazné ovlivnění SD (stabilizace onemocnění) 67 % everolimus vs. 32 % placebo
Charakteristika pacientů dle prognostických kritérií (MSKCC) a předchozí léčby(9,11) (tabulka 9)
Tabulka 9: Porovnání na základě prognózy a předchozí léčby

Statisticky signifikantní rozdíl v PFS ve všech prognostických skupinách i skupinách nemocných rozdělených dle předchozí léčby
Bezpečnost/nežádoucí účinky(10,11)
Nutnost přerušení léčby: 7 % sorafenib vs. 0 % placebo
Stomatitida (37 %), vyrážka (29 %), únava (30 %), pneumonitida (10 %), infekce (24 %), otoky (24 %), hyperglykémie (12 %), hypercholesterolemie (20 %), hyperlipidemie (15 %), anémie (37 %) U everolimu byla prokázána účinnost ve 2. linii (3. linii) po předchozí léčbě sunitinibem, sorafenibem nebo oběma signifikantním prodloužením PFSA.
Sorafenib (NEXAVAR©)
Randomizovaná, placebem kontrolovaná studie fáze III u pacientů po selhání předchozí léčby cytokiny (studie TARGET)(12,13)
Léčba:
sorafenib 400 mg p.o. 2x týdně versus placebo (tabulky 10, 11)
Tabulka 10: porovnání léčby sorafenibem versusplacebem

*nebylo dosaženo statistické významnosti; možné zkreslení cross-over designem, který umožněn po 1. interim analýze (ani v době 1. interim analýzy, ještě nezkreslené cross-over designem, nebylo dosaženo statisticky signifikantního rozdílu)
Tabulka 11: Charakteristika pacientů dle prognostických skupin a předchozí léčby

U všech podskupin signifikantní prodloužení PFS
Bezpečnost/Nežádoucí účinky(12)
Nutnost přerušení léčby: 21 % sorafenib vs. 6 % placebo (p < 001)
Průjem (43 %), únava (37 %), zvracení (16 %), hypertenze (17 %), hand-foot syndrom (30 %), vyrážka (40 %), alopecie (27 %)
U sorafenibu byla prokázána účinnost oproti placebu ve 2. linii léčby mRCC po selhání cytokinů.
Výsledky další randomizované studie fáze II podávání sorafenibu u nepředléčených pacientů nepodporují podávání sorafenibu v 1. linii léčby(14)
Léčba:
sorafenib 400 mg 2x denně versusIFN 9 MIU 3x týdně (po progresi onemocnění možnost přechodu z IFN na sorafenib nebo zvýšení dávky na 600 mg 2x denně) (tabulka 12)
Tabulka 12: porovnání léčby sorafenibem a IFN

Neprokázána účinnost sorafenibu v 1. linii (nebyl prokázán statisticky signifikantní rozdíl v PFS ani ORR v porovnání s IFN)
Tabulka 13 Výsledky poolované analýzy dvou jednoramenných studií se sunitinibem ve 2. linii mRCC po selhání IFN-alfa

Sunitinib (Sutent©)
2 jednoramenné studie fáze II ve 2. linii po selhání cytokinů (n = 105+63). Na základě těchto studií byl sunitinib v roce 2006 zaregistrovaný v indikaci mRCC (tabulka 13).
Na základě výše uvedených dat lze stanovit následující racionální algoritmus léčby u pacientů s mRCC ve 2. linii léčby (tabulka 14)
Tabulka 14 2. Linie léčby u pacientů s mRCC

Poznámka: Data pro 2. linii po selhání bevacizumabu + IFN alfa nejsou k dispozici. Nejsou dostupná data prokazující účinnost sorafenibu v 1. linii.(12,13,14)
4. Jak nahlížet na sekvenční léčbu sunitinib - sorafenib a vice versa?
Vezmeme-li v úvahu časovou posloupnost, s jakou byla postupně udělována registrace na základě výsledků klinických studií, a příchod nových cílených léků na trh, je zcela pochopitelné, že po selhání jedné léčby se pacientům nabízela další alternativní léčba, a to i přes neexistenci dat EBM nejvyššího stupně (kontrolované klinické studie).
Po selhání sunitinibu tak byl pacientům podáván sorafenib a naopak, přestože nebyly dostupné kontrolované prospektivní studie, které by podporovaly toto sekvenční podávání. Přesto byl jistě tento postup v dané době správný a pro pacienty přínosný.
V 8/2009 však byl registrován a v USA i Evropě postupně uváděn na trh everolimus, u kterého byla v placebem kontrolované klinické studii fáze III prokázána účinnost ve 2. linii léčby po selhání VEGFR-TKI (viz výše).
Everolimus tedy získal na základě průkazu EBM své specifické místo ve 2. linii léčby po selhání sunitinibu nebo sorafenibu (popř. právě vzhledem k dřívější praxi podávání obou těchto léčiv v sekvenci i místo ve 3. linii po předchozím podání obou těchto VEGFR-TKI).
Jaké jsou tedy hlavní kontroverze podávání sekvenční léčby sunitinib (event. sorafenib)→everolimus vesus sunitinib → sorafenib(sorafenib → sunitinib)?
- Průkaz účinnosti na základě placebem kontrolované studie fáze
III podávání everolimu po selhání předchozí léčby VEGFR-TKI (studie
RECORD – viz výše). Na základě této studie udělena registrace EMEA
(i FDA) v dané indikaci, což se promítlo do významných lokálních i
mezinárodních doporučených postupů.
- Naopak neexistuje průkaz účinnosti sekvenčního podávání sun
(sor)→ sor (sun):
- dosud neprovedena žádná kontrolovaná prospektivní studie tohoto
sekvenčního podání;
- dostupné jsou pouze retrospektivní údaje;
- jediná prospektivní studie z roku 2009(15) *prokazuje pouze omezenou účinnost podání sorafenibu po sunitinibu.
- dosud neprovedena žádná kontrolovaná prospektivní studie tohoto
sekvenčního podání;
- Dále můžeme vzít v úvahu též potenciální možnost oddálení vzniku rezistence při střídání odlišného mechanismu účinku a s tím též související odlišný profil nežádoucích účinků VEGFR-TKIs a mTOR-inhibitoru.
Stručný souhrn studie „diLorenzo“(15)
Prospektivní, otevřená, nerandomizovaná, multicentrická studie fáze II podávání sorafenibu po selhání sunitinibu
Výsledky
- ORR 9,6 % (95% CI, 5 %-17 %)
- Medián TTP=3,7 měsíce
- Medián OS=7,4 měsíce
- Progrese onemocnění po 16 týdnech u 81 % pacientů
Závěr
- Sorafenib byl u pacientů s mRCC refrakterních na sunitinib
dobře tolerován, ale prokázána jen omezená účinnost.
- Rezistence na sorafenib není zcela překonána sekvenčním podáním sunitinibu; zdá se, že lepší volbou pro překonání rezistence na antiangiogenní léčbu je blokáda mTOR.
Na základě výše uvedených dat by po selhání léčby sunitinibem (popř. sorafenibem) měl být podán everolimus.
Pro podávání sekvence VEGFR-TKIs nejsou dostupná relevantní data.
5. Jaký je tedy na základě klinických studií fáze III racionální algoritmus léčby pokročilého či metastatického světlobuněčného renálního karcinomu?
Na základě výše uvedených údajů opírajících se o výsledky kontrolovaných, randomizovaných, prospektivních klinických studií, jež vedly k udělení registrace v příslušných indikacích, lze doporučit tento algoritmus léčby mRCC (tabulka 15)
Tabulka 15: Doporučená léčba mRCC

*Vzhledem k dostupné účinnější léčbě by léčba cytokiny měla být postupně opouštěna. U nově diagnostikovaných pacientů již není opodstatnění pro jejich podávání.
Závěr
Generalizovaný světlobuněčný karcinom se stal cílem mnoha studií s biologickými agens, které vedly k registraci 5 nových léků v boji s touto chorobou. Další budou přicházet, tím vyvstane potřeba správného postavení preparátů v algoritmu léčby pro dosažení co nejvyššího benefitu pro nemocného. Snažili jsme se tento algoritmus najít na podkladě studií.
Léčebná agens v boji s mRC:
Bevacizumab (Avastin ®) je protilátka proti vaskulárnímu endoteliálnímu růstovému faktoru (VEGF), který je nejdůležitějším proangiogenním faktorem ve vývoji nádoru. Bevacizumab je humanizovaná monoklonální protilátka proti VEGF, váže se na VEGF, a zabraňuje tak interakci mezi VEGF a tyrosinkinázovými receptory VEGFR 1 a VEGFR 2. Jeho výhodou je neexistence predikátoru účinnosti a prokázání účinnosti v léčbě většiny solidních nádorů.
Temsirolismus (Torisel®) je selektivní inhibitor mTOR (savčí rapamycinový cílový receptor). Temsirolimus se váže na intracelulární protein (FKPB-12) a komplex protein-temsirolimus a inhibuje aktivaci mTOR, který kontroluje buněčné dělení. Inhibice aktivity mTOR vede k blokádě růstu léčených nádorových buněk ve fázi G1 v důsledku selektivního narušení translace regulačních proteinů buněčného cyklu, jako jsou např. D-cykliny, c-myc a ornitin dekarboxyláza. Temsirolimus uplatňuje svůj účinek vytvořením komplexu s FKBP-12 a mTOR. Když se mTOR naváže na komplex, jeho schopnost fosforylovat a tím kontrolovat aktivitu translačních proteinů (4E-BP1 a S6K, obě v metabolické cestě P13 kinázy/AKT směrem dolů od mTOR), které kontrolují buněčné dělení, je blokována.
Kromě regulace proteinů buněčného cyklu, mTOR umí regulovat translaci hypoxií indukovatelných faktorů, HIF-1 a HIF-2 alfa. Tyto transkripční faktory regulují schopnost nádoru adaptovat se na hypoxické mikroprostředí a produkovat angiogenní faktory, jako např. vaskulární endoteliální růstový faktor (VEGF). Protinádorový účinek temsirolimu částečně využívá své schopnosti potlačovat hladiny HIF a VEGF v nádoru a jeho mikroprostředí, čímž se zpomaluje tvorba nových cév.
Temsirolimus jako jediný prokázal signifikantně vyšší účinnost (PFS, OS) než IFN alfa u specifické skupiny pacientů s mRCC – u pacientů s vysokým rizikem (3 a více rizikových prognostických faktorů).
Sunitinib malát (Sutent ®) je inhibitor celé řady tyrosinkináz, tedy enzymů, které hrají klíčovou úlohu v procesu buněčné proliferace. Jedná se především o tyrosinkinázy asociované s receptory pro destičkový růstový faktor (PDGFR α a β) a vaskulární endoteliální růstový faktor (VEGFR 1, 2 a 3). Zmiňován je však i inhibiční účinek na receptory pro faktor kmenových buněk (KIT), Fms-like tyrosinázu-3 (FLT3), kolonie stimulující faktor typu 1 (CSF-1R) a neurotrofický faktor odvozený od gliových buněk (RET). Tato inhibice ve výsledku působí zpomalení novotvorby cév, zpomalení růstu nádoru a snížení rizika vzniku metastáz.
Sunitinib se tak stal v první linii léčby novým standardem v léčbě metastatického karcinomu ledviny a jeho podání je zahrnuto do odborných doporučení Evropské urologické spole nosti (EAU) i doporučení NCCN. U všech rizikových skupin je výrazně účinnější než IFN alfa, léčeným nemocným zvyšuje kvalitu života.
Sorafenib (Nexavar®)je multikinázový inhibitor, který snižuje in vitro proliferaci nádorových buněk. Sorafenib byl původně syntetizován jako inhibitor Raf kinázy. Jedná se o multikinázový inhibitor, jehož spektrum účinku zahrnuje rovněž inhibici angiogenních faktorů. Jedná se o orální lék, jehož injekční forma nebyla zatím připravena. Po perorálním podání sorafenibu se dosahuje maximální plazmatické koncentrace za 3 hodiny, další nárůst byl pozorován po 10 hodinách, což svědčí pro reabsorbci ze střeva. Pokud byl sorafenib podán s tučným jídlem, jeho absorpce se snížila o 30 %. Sorafenib je metabolizován primárně játry. Při perorálním podání 100 mg roztoku sorafenibu bylo 96 % látky vyloučeno během 14 dní, přitom se 77 % dávky vyloučilo stolicí a 19 % močí.
Everolimus (Afinitor ©)
RAD001 (everolimus, Afinitor) je perorální mTOR inhibitor, aktivní derivát rapamycinu se širokou protinádorovou aktivitou. mTOR je hlavním spínačem buněčného růstu a proliferace ve zdravých buňkách. Deregulace signální cesty zprostředkované mTOR způsobuje u nádorového onemocnění ztrátu kontroly růstu. mTOR reguluje reakce na změny buněčného prostředí, buněčný růst a proliferaci buněk, abiogenezi, transkripci genů, opravy poškozené DNA, antiestrogeny.
Everolimus je perorální mTOR inhibitor, který:
- inhibuje proliferaci nádorových i endoteliálních buněk;
- má širokou protinádorovou aktivitu, antiangiogenní účinky;
- vyvolává in vivo aktivitu u různých druhů nádorů: plíce, střevo, slinivka a epidermoidální nádory a melanom;
- potenciuje apoptózu indukovanou chemoterapií poškozující DNA;
- posiluje účinek chemoterapie a ozařování.
Everolimus je první a jediná průkazná terapie, která efektivně léčí pacienty s mRCC, kteří progredovali po anti-VEGF léčbě.
Everolimus významně snižuje riziko progrese onemocnění, a to bez zhoršení kvality života.
Literatura:
- Motzer et al. Sunitinib versus Interferon alfa in metastatic
renal cell carcinoma. N Engl J Med. Jan/2007.
- Motzer et al. Overall survival and updated results for Sunitin
compared with interferon alfa in patiens with metastatic renal cell
carcinoma. J Clin Oncol. Aug/2009.
- Mude s et al. Vascular endothelial growth factor and mTOR
pathways in renal cell carcinoma: differences and synergie of two
targeted mechanisms. BJUI. July 2009.
- Sutent SPC (12/2009).
- Escudier et a . Bevacizumab plus interferon alfa-2a for
treatment of metastatic renal cell carcinoma: randomised, double
blind phase III trial. Lancet.Dec/2007.
- Avastin. SPC (9/2009).
- Hudes et al. Temsirolimus, Interferon alfa, or both for
advanced renal cell carcinoma. N Engl J Med. May/2007.
- Torisel, SPC (2/2010).
- Motzer et al. Efficacy of everolimus in advanced renal cell
carcinoma:a double-blind, randomised, placebo-controlled phase III
trial. Lancet. July/2008.
- Afinitor. SPC (10/2009).
- Afinitor. EMEA Public Assessment Report, EMEA website:
http://www.ema.europa.eu/humandocs/PDFs/EPAR/afinitor/H-1038-en6.pdf.
- Escudier et al. Sorafenib in advanced clear-cell renal-cell
carcinoma. N Engl J Med. Jan/2007.
- Nexavar SPC (12/2009).
- Escudier, Szczylik et al. Randomised phase II trial of
first-line treatment with sorafenib vs interferon alfa-2a in
patiens with metastatic renal cell carcinoma. J Clin Oncol,
2009.
- diLorenzo et al. Phase II study of sorafenib in patiens with
sunitinib-refractory metastatic renal cell cancer. J Clin Oncol.
Aug/2009.
- EMEA Guideline on the evaluation of anticancer medicinal products in man http://www.ema.europa.eu/pdfs/human/ewp/020595en.pdf.
doc. MUDr. Jindřich Fínek, Ph.D.Onkologické a radioterapeutické oddělení FN Plzeň e-mail: finek@finek.cz
Datum přednesení příspěvku: 22. 8. 2011





