Konference: 2010 XXXIV. Brněnské onkologické dny a XXIV. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: Postery
Číslo abstraktu: 222p
Autoři: MVDr. Jan Hraběta; Ing. Soňa Křížková, Ph.D.; doc., RNDr. Michal Masařík, Ph.D.; prof. MUDr. Tomáš Eckschlager, CSc.; prof. RNDr. Marie Stiborová, DrSc.; MUDr. Lucia Trnková; doc.Ing. Jaromír Hubálek, Ph.D.; doc.Ing. René Kizek, Ph.D.
Chemoterapie je velmi významnou součástí léčby
zhoubných nádorů. Jednou z velkých nevýhod chemoterapie jsou její
často poměrně rozsáhlé vedlejší účinky (Brigger et al.; Dhalla et
al.; Fink et al.; Lasic; Szakacs et al.; Weiss). Cílem je vyvinout
chemoterapeutická léčiva s nízkou toxicitou, což není snadným
úkolem. Nověji je pozornost také věnována individuálnímu přístupu v
chemoterapii. Individualizace terapie pak vyžaduje navržení a
aplikaci technologií snadné, rychlé a levné detekce koncentrace
léčiva. Největšího pokroku v individualizaci dávkování léčiv bylo
dosaženo v oblasti aplikace inzulinu a monitorování hladiny
glykémie. Chemoterapeutika mají různá místa svého biologického
účinku jedním z míst jsou interkalace do struktury DNA.
Protinádorovýúčinek je založen na vazbě interkalačních činidel do
jejich struktury. Vazbou do molekuly DNA není umožněno polymeráze
zabezpečit replikaci nebo transkripci. Oba tyto děje jsou pro buňku
velmi významné. Interkalační činidla jsou většinou planární
molekuly, které s dusíkatými bazemi DNA vytváří vodíkové můstky,
případně iontové interakce či koordinační vazby. Pro léčbu
nádorových onemocnění je v léčebných protokolech vyžíván
doxorubicin. Doxorubicin byl izolován jako protinádorové
antibiotikum. Jeho nevýhodou je však horší rozpustnost ve vodném
prostředí, proto se v současnosti hledají postupy jak doxorubicin
lépe aplikovat (lipidové kapsle). Pro sledování interakcí a vztahu
proteinů, nukleových kyselin a nízkomolekulárních látek je
využívána celá baterie analytických technik a postupů. Současné
technologie se zaměřují především na aplikace hmotnostní
spektrometrie MALDI a SELDI či tandemové detekce MS/MS. Nevýhody
těchto postupů jsou především v nezbytné úpravě vzorku před jeho
vlastní analýzou. Další velmi intenzivně rozvíjenou oblastí jsou
techniky array technologií zaměřené na sledování expresní profilů,
kde finanční náklady na provoz jsou vysoké a reprodukovatelnost
analýz je stále intenzivně zkoumána. V rámci těchto technik nachází
uplatnění elektrochemická detekce (Huska et al.; Huska et al.;
Masarik et al.; Prusa et al.).
EXPERIMENTÁLNÍ ČÁST
Materiál a metody
Elektrochemická analýza: Elektrochemické měření
bylo prováděno na přístroji Autolab (EcoChemie, Nizozemí) ve
spojení s VA-Stand 663 (Metrohm, Švýcarsko) v ťříelektrodovém
zapojení. Jako pracovní elektroda byla použita visící rtuťová
kapková elektroda - HMDE (plocha Hg kapky = 0,4 mm2),
referenční elektroda (Ag/AgCl, 3M KCl) a uhlíková tyčinka jako
pomocná elektroda. Všechna elektrochemická měření byla provedena v
acetátovém pufru pH = 4 který, byl připravován ze zásobních roztoků
0,2 M kyseliny octové a 0,1 M octanu sodného, technikou SWV
voltametrie při frekvenci 120 Hz.
Neuroblastomové buněčné linie: UKF-NB-3
neuroblastomové linie byly odvozeny z metastáz neuroblastomu do
kostní dřeně a byly získány od J. Cinatl (J. W. Goethe University,
Frankfurt, Germany). K doxorubicinu resistentní linie byla získána
inkubací buněk s postupně rostoucími koncentracemi doxorubicinu.
Byly následně označeny jako UKF-NB-3 (DOXO). Buňky byly kultivovány
v DMEM médiu s přídavkem 5% fetálního séra a pasážovány v intervalu
po čtyřech dnech. Kultivace probíhala v inkubátoru při 37 °C a 5%
CO2. DNA byla izolována obvyklým postupem
(fenol/chloroformovou extrakcí) z buněčných linií běžným
postupem.
Výsledky a diskuse
Naše hlavní pozornost se zaměřila na sledování
interakce protinádorového léčiva doxorubicinu s nukleovými
kyselinami. Velmi dobré redoxní vlastnosti doxorubicinu umožnují
jeho snadné stanovení pomocí DPV (y = 596x + 14, R2 = 0.9921, s
limitem detekce v subnanomolárních koncentracích). V našich
experimentach bylo zjištěno, že interkalovaný doxorubicin snižuje
pozorovaný redoxní signál CA (cytosin/adenin) dsDNA, ale také
poskytuje redoxní signál DOXO při potenciálu kolem -0.35 V.
Předpokládá se, že interkalační činidla jsou transportována mezi
řetězce nukleové kyseliny kde dochází ke vzniku vodíkových případně
koordinačních vazeb. Změny, které takto interkalované činidlo na
molekule DNA způsobí mohou vést k zastavení replikace případně
transkripce. O kovaletntních vazbách s bazemi takových činidel je
známo velmi málo, ale jak naznačují některé experimentální práce
lze očekávat jejich vznik především na molekule guaninu. V našem
experimentu jsme se pokusili sledovat interkalace doxorubicinu do
molekuly DNA. Molekula dsDNA na povrchu elektrody vytvoří
uspořádanou vrstvu, která může reagovat s interkalačním činidlem
(doxorubicinem). DNA modifikovaná elektroda je zbavena nenavázaných
molekul DNA a pře nesena do roztoku obsahujícího doxorubicin. Po
proběhlé interakci je nespecificky vázaný doxorubicin z povrchu
elektrody odmyt. DNA s interkalovaným doxorubicinem je přenesena do
základního elektrolytu kde probíhá vlastní elektrochemické měření.
Z výsledků je zřejmá vyšší variabilita (kolem 15 %) způsobená
především velmi obtížně definovanými podmínkami na povrchu pracovní
elektrody při tvorbě různých nepříliš dobře definovaných
povrchových vrstev. I přes tyto nepříznivé faktory bylo možné
pozorovat pokles signálu CA v molekule dsDNA (směrnice -2.4x) a
nárůst redoxního signálu DOXO (směrnice 14.3x) v průběhu
interkalačního experimentu. Z výsledku je jasně patrné, že
interkalace doxorubicinu do molekuly dsDNA na elektrodě je rychlá,
avšak výraznější změna je pozorována až po 4 minutách
interakce.
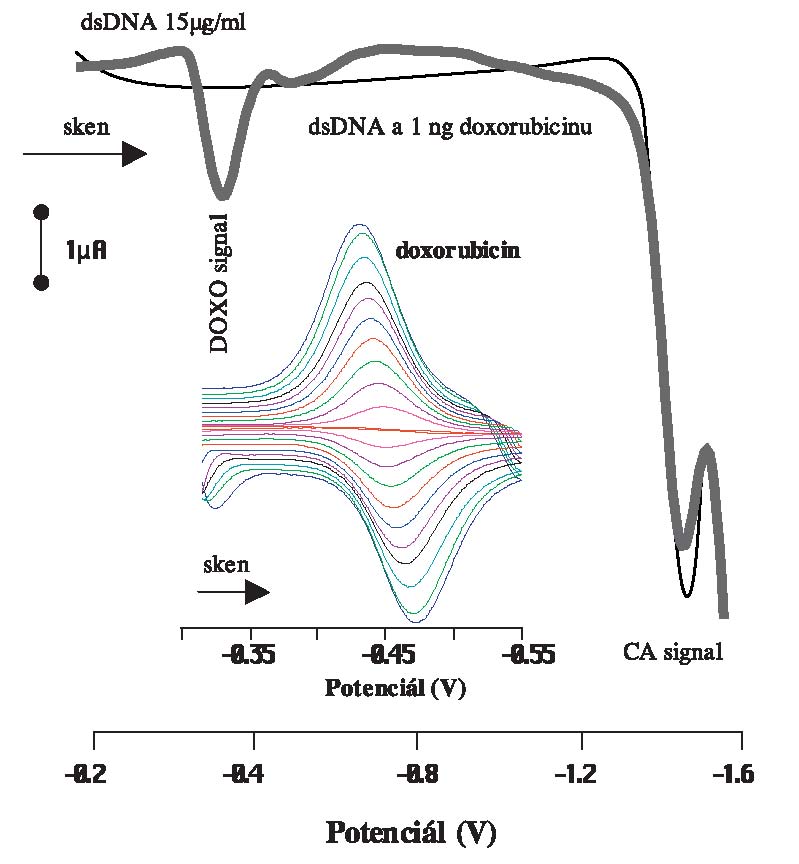
Obr. 1
Elektrochemický (CV) záznam doxorubicinu při
různých rychlostech polarizace.
Signál dsDNA bez kovalentně vázaného doxorubicinu (tenká čára) a s
kovalentně vázaným doxorubicinem (tlustá čára).
Sledování interkalovaných molekul do struktury
nukleové kyseliny není přiliš mnoho a v řadě případů naráží na
velmi složité technické a materiální vybavení. V našem experimentu
jsme se pokusili navrhnout jednoduchý postup jak rozpoznat změny v
DNA s interkalovaným a neinterkalovaným doxorubicinem. Pro tento
experimentální účel bylo využito savčích buněčných kultur, které
byly vystaveny působení doxorubicinu. Před vlastní elektrochemickou
analýzou byla z buněk izolována DNA. Izolační postup zajišťuje, že
pro analýzu byla použita pouze DNA, která obsahuje interkalovaný
doxorubicin. DNA neuroblastomových buněk kultivovaných v
přítomnosti doxorubicinu byla izolována stejným způsobem jako u
kontrolní skupiny. Získané závislosti jsou rozdílné především při
sledování změny signálu u nízké koncentrace dsDNA. Interkalovaný
doxorubicin snižuje redoxní signály CA dsDNA a pravděpodobně také
dochází k dalším strukturním změnám, které se projevují v různé
tvorbě vrstev na povrchu pracovní elektrody. Na SW voltamogramech
byl pozorován kromě signálu CA dsDNA také signál odpovídající
doxorubicinu. Signál doxorubicinu s narůstající aplikovanou
koncentrací vzrůstal.
Závěr
Jak bylo demonstrováno elektrochemické metody je
možné použít pro sledování interkalačních změn doxorubicinu do
molekuly DNA.
Poděkování
Práce byla podporována grantovým výzkumnými
projekty: GAČR NANIMEL 102/08/1546, GAČR P301/10/0356, Výzkumným
centrem BIO-ANAL-MED LC06035 a GA AVIAA401990701.
Literatura
- Brigger, I., et al., (2002): Nanoparticles in cancer therapy and diagnosis. Advanced Drug Delivery Reviews, 54: 631-651.
- Dhalla, N. S., et al., (2000): Role of oxidative stress in cardiovascular diseases. Journal of Hypertension, 18: 655-673.
- Fink, D., et al., (1998): The role of DNAmismatch repair in drug resistance. Clinical Cancer Research, 4: 1-6.
- Huska, D., et al., (2009): Square-Wave Voltammetry as a Tool for Investigation of Doxorubicin Interactions with DNA Isolated from Neuroblastoma Cells. Electroanalysis, 21: 487-494.
- Huska, D., et al., (2009): Electrochemical and computational study of doxorubicin interactions with DNA. Febs Journal, 276: 109-109.
- Lasic, D. D., (1998): Novel applications of liposomes. Trends in Biotechnology, 16: 307-321.
- Masarik, M., et al., (2009): Doxorubicin and genomic DNA, new insights in drug-nucleic acids interactions. International Journal of Molecular Medicine, 24: 277.
- Prusa, R., et al., (2009): In vivo and in vitro electrochemical investigation of doxorubicin/ellipticine interaction with DNA. Clinical Chemistry, 55: A217-A217.
- Szakacs, G., et al., (2006): Targeting multidrug resistance in cancer. Nature Reviews Drug Discovery, 5: 219-234.
- Weiss, R. B., (1992): THE ANTHRACYCLINES - WILL WE EVER FIND A BETTER DOXORUBICIN. Seminars in Onco-logy, 19: 670-686
Datum přednesení příspěvku: 22. 4. 2010





