Konference: 2004 XXVIII. Brněnské onkologické dny a XVIII. Konference pro sestry a laboranty
Kategorie: Onkologická diagnostika
Téma: Molekulární a laboratorní diagnostika nádorů
Číslo abstraktu: 25
Autoři: Mgr. David Potěšil; J. Zelená; Jan Vacek; M. Brázdová; Mgr. Jitka Petrlová, Ph.D.; P. Češková; P. Lubal; doc.Ing. René Kizek, Ph.D.
p53; elektrochemická detekce; průtoková injekční analýza; FIA; denaturace; nativní protein
Protein p53 je nádorový supresor, jehož primární funkcí je kontrola buněčného cyklu a programované buněčné smrti v reakci na poškození DNA. V naší práci jsme se zaměřili na analýzu proteinu p53 pomocí průtokové injekční analýzy (FIA) ve spojení s elektrochemickým detektorem. Stanovení je založeno na měření oxidačních signálů proteinu p53 při konstantním potenciálu elektrody. Na jednotlivé elektrody jsme aplikovali potenciál v rozsahu 200–900 mV. Nejvyšší proudové odezvy jsme zazna-menali při potenciálu 900 mV. Limit detekce uvedené metody byl stanoven jako 400 ng/ml. Kalibrač ní křivka byla lineární (y = 1,1682x – 0,0101; R2 = 0,9998). Vyvinutá metodika přispívá k možnostem detekce jak nativní tak denaturované formy proteinu p53.
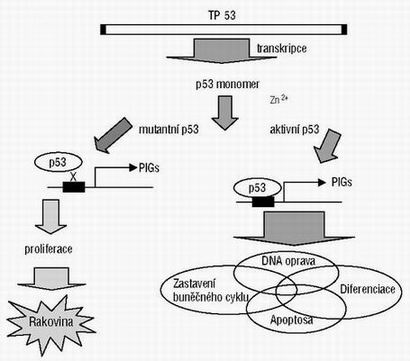
Obrázek 1
Zjednodušené schéma biologické funkce proteinu p53.
PIGs: proteinem indukované geny
1. Úvod
Důležitý nádorový supresorový gen je p53, který kóduje protein o molekulové hmotnosti 53 kDa. Množství proteinu p53 v buň ce je za běžných podmínek udržováno na nízké hladině. Tato nízká koncentrace souvisí s poměrně rychlou degradací proteinu p53 proteasomem 26S za účasti zpětného regulátoru – proteinu MDM2. Při buněčném stresu, jako např. UV záření, genotoxické látky, těžké kovy a podobně, dochází k poškození primární struktury DNA. Poškození DNA vyvolá blokaci degradační dráhy proteinu p53, čímž dojde knárůstu množství proteinu v buň ce. Normální funkční protein p53 je tetramer. Pro správnou funkci tohoto nádorového supresoru je nezbytná vazba atomu zinku v jeho centrální doméně. Funkční tetramer p53 se váže na specifickou sekvenci DNA (p53CON) prostřednictvím tzv. centrální domény. Protein p53 hraje v buň ce roli obecného transkripčního faktoru, který reguluje transkripci mnoha genů, ať již v pozitivním či negativním slova smyslu. Tímto způsobem je protein p53 schopen pozastavení buněčného cyklu a následné reparace poškozené DNA. Pokud je poškození DNA rozsáhlé a není možná oprava, je protein schopen spustit cestu programované buněčné smrti – apoptosy. Je známo, že v proteinu p53 se objevuje velká rozmanitost mutací. Tyto mutace nemusí bezpodmínečně vést k disfunkci proteinu p53. Bylo potvrzeno, že záleží na lokalizaci bodové mutace přičemž mutace mohou vznikat v centrální doméně v místě vazby na DNA (strukturní) a v částech stabilizujícím vazbu p53 na DNA (kontaktní).
Strukturní mutace můžeme rozdělit na mutace v centrální oblasti proteinu, znemožň ují vazbu atomu zinku a tím vytvoření korektní konformace proteinu, a mutace v tetramerizační doméně. Díky kontaktním mutacím v centrální doméně, v místě aminokyselin přímo se podílející na vazbě s DNA, ztrácí protein schopnost vazby. Je známo, že mutace genu p53 je nejčastější (více než z poloviny celkového počtu) mutací nalezenou ve zhoubných nádorech člověka. Z tohoto vyplývá důležitost rozlišení normální a mutované formy proteinu p53 při studiu proliferace buněk (obr. 1).
Nejběžnější metodou studia proteinu p53 je SDS PAGE elektroforéza. Tato metoda má však několik nevýhod, mezi které patří značná časová náročnost, umocněná složitou přípravou vzorku. Z analytického hlediska není gelová metoda dostatečně citlivá a kvantifikace stanovení proteinu p53 nebyla doposud vůbec systematicky studována. Pro detekci proteinu p53 se využívá barvení Coomasie blue a stříbrem. Vyšší citlivosti lze dosáhnout pomocí imunochemické detekce. Z těchto důvodu je věnována stále větší pozornost hledání vhodnější metody, která by rychleji a efektivněji stanovila i velmi malá množství proteinu za krátký čas a bez zdlouhavé přípravy vzorku. V posledních letech se objevilo několik prací, které se věnovali stanovení proteinu p53 elektrochemickými metodami. Cílem této práce je studium proteinu p53 pomocí průtokové injekční analýzy s elektrochemickým vícekanálovým detektorem (FIA-ED).
Experimentální část
Materiál a metody
Chemikálie
Protein p53 byl purifikován z eukaryotického expresní systému hmyzích buněk Sf6 transfekovaných bakulovirovým vektorem. Ostatní chemikálie byly zakoupeny od firmy Sigma Aldrich Chemical Corp. (USA). Všechny roztoky byly připravovány v ACS deionizované vodě (Sigma Aldrich). Pracovní roztoky proteinu byly připravovány ze zásobního roztoku (0,7 mg/ml), který byl uchováván při –20°C. Denaturace proteinu p53 byla prováděna 4 M močovinou po dobu 24 h.
FIA-ED
FIA-ED systém byl složen ze dvou chromatografických pump (Model 582, ESA, USA), 1 m dlouhé reakční smyčky a osmikanálového CoulArray elektrochemického detektoru (Model 5600A, ESA, USA). Detektor je složen z průtočné analytické komůrky (Model 6210, ESA, USA) obsahující referenční, pomocnou (Pd) a osm porézních grafitových elektrod. Čištění povrchu elektrod od produktů elektrolýzy bylo prováděno elektrochemicky vkládáním pozitivních potenciálu na všechny elektrody (1 V) za vyššího průtoku mobilní fáze (1 ml/min). V samostatném modulu je uložena reakční smyčka, elektrochemický detektor, prostor je termostatovaný (30°C). mVzorek (5 l) byl injektován manuálně přes dávkovací ventil.
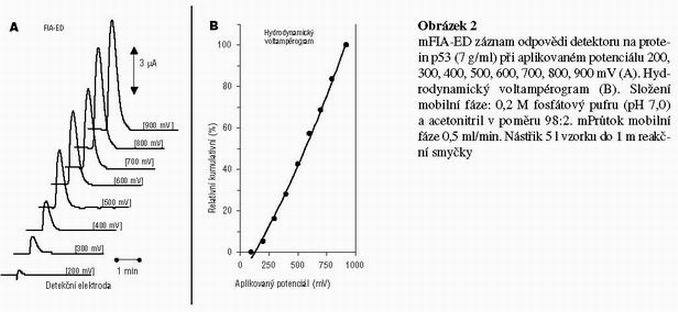
Výsledky a diskuse
Protein p53 je v posledních letech intenzivně studován především ve spojitosti se vznikem rakoviny. Je tedy snaha vyvíjet vhodné analytické nástroje, které by umožnily detekci nízkých koncentrací a rozšířily naše znalosti týkající se biochemických, biofyzikálních a chemických vlastností proteinu (denaturace, chemická modifikace, vazba na DNA atd.). V prezentovaném článku jsou popsány výsledky naší práce týkající se studia elektrochemického chování p53. K studiu elektrochemických vlastností proteinu jsme použili osmi-elektrodový detektor CoulArray, který byl součástí průtokového systému (FIA).
Optimalizace stanovení proteinu p53 pomocí FIA-ED
Pro studium nativního proteinu je potřebné zajistit vhodné vodné prostředí. Z toho důvodu jsme jako FIA mobilní fázi použili 2 M fosfátový pufr (pH 7,0). V tomto pufrovaném prostředí jsme získali velmi dobře vyvinuté elektrochemické signály. Zajímalo nás, zda přítomnost acetonitrilu (ACN) ovlivní proudovou odpověď detektoru. Je známo, že ACN je často používanou součástí mobilní fáze při HPLC separaci, proto je důležité znát jeho vliv na elektrodový děj probíhající v elektrochemickém detektoru. Z tohoto důvodu jsme hledali vhodný poměr pufru a ACN. Nejlépe vyvinutý signál jsme získali při použití mobilní fáze složené z 98% fosfátového pufru a 2% acetonitrilu. Negativní vliv vyšší koncentrace ACN na studovaný signál proteinu je pravděpodobně způsoben změnou struktury p53. Významným parametrem pro získání maximální odezvy na elektrochemického detektoru je celkový průtok mobilní fáze. Testovali jsme průtok mobilní fáze v rozsahu od 0,1 do 0,8 ml/min. Maximální odezvy jsme získali při průtoku 0,5 ml/min. Při vyšším průtoku se již odezva postupně snižuje na 88-74% maxima a to pravděpodobně díky menšímu času prekoncentrace proteinu na povrchu pracovních elektrod.
Dále byl studován vliv aplikovaného potenciálu na pracovní elektrody detektoru. Pro nalezení maximální odpovědi elektrochemického detektoru bylo na grafitové porézní elektrody detektoru vkládán potenciál 200, 300, 400, 500, 600, 700, 800 a 900 mV. Proudová odpověď na jednotlivých elektrodách detektoru je ukázána na obrázku 2A. Pro volbu vhodného analytického potenciálu vycházíme z hydrodynamického voltampérogramu, viz. Obr. 2B. Pro měření jednotlivých vzorků se volí potenciál z oblasti největšího proudového rozdílu a nejmenšího potenciálového rozdílu. Tomuto kriteriu nejlépe vyhovoval potenciál 900 mV vkládaný na poslední elektrodu detektoru (Obr. 2B).
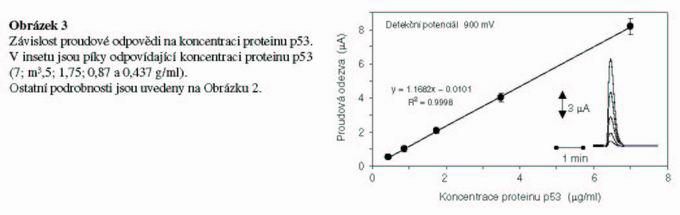
Dalším krokem naší práce bylo sestrojit kalibrační křivku. Závislost proudové odezvy elektrochemického detektoru na koncentraci byla lineární a relativní střední chyba (R.S.D.) se pohybovala kolem 4-7% (n= 5). Rovnice kalibrační přímky a hodnota spolehlivosti naměřené proudové závislosti byla y = 1,1682x – 0,0101; R2 = 0,9998 (Obr. 3). Na insetu v obrázku 3 jsou ukázány signály (detekční potenciál 900 mV) při rozdílných koncentracích p53. Limit detekce proteinu p53 byl stanoven jako 400 ng/ml.
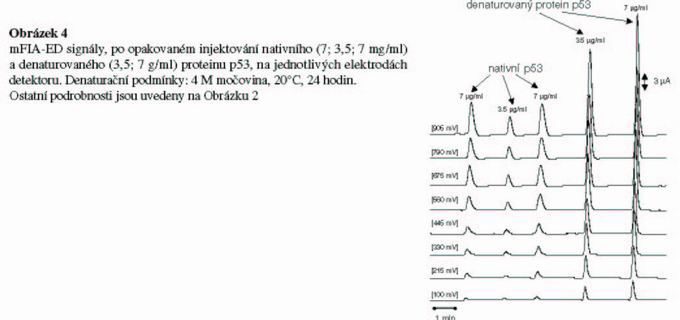
Rozlišení nativní a denaturované formy
Studium denaturace proteinů má značný biologický význam. Denaturovaná forma proteinu p53 je neaktivní, neboť denaturací dochází ke změně struktury proteinu. Studium nativní, denaturované a také mutantních forem proteinu se provádí většinou pomocí gelové elektroforézy, ale i fluorescenčními metodami. Protein p53 byl v našem případě denaturován chemicky 4 M roztokem močoviny po dobu 24 hodin při teplotě 20°C. Močovina na detektoru poskytovala zanedbatelný signál oproti mproudové odezvě samotného proteinu (přibližně 1% signálu 7 g/ml denaturovaného proteinu). Denaturovaný protein p53 nám poskytl 3x vyšší elektrochemickou odpověď než signál nedenaturovaného proteinu. Za studovaný signál na elektrochemickém detektoru pravděpodobně odpovídá oxidace aminokyselin tyrosinu a tryptofanu. Molekula proteinu p53 obsahuje 9 tyrosinů a 4 tryptofany z celkového počtu 363 aminokyselin. Denaturací proteinu pravděpodobně dochází k rozvinutí prostorové struktury proteinu a zlepšení jeho interakce s povrchem elektrody. Předpokládáme, ž e tuto novou metodu budeme moci uplatnit při studiu změ ny konformace a tvorby agregátů proteinu p53.
Závěr
Protein p53 je posledních několika letech intenzivně studovaným biomolekulou. Nejčastěji používanou metodou ke studiu jeho denaturačních změn je gelová elektroforéza. V tomto článku představujeme novou elektrochemickou metodu, která
umožňuje rychlé a snadné stanovení koncentrace (limit detekce na 5 l nástřik byl 2 ng proteinu) a denaturačních změn proteinu p53.
Poděkování
Práce na této publikaci byla financována z dlouhodobého záměru Agronomické fakulty MZLU č. 4321 00001, Grantu 525/04/P132
od GA ČR a IGA MZLU 3/2004.
Literatura
- BOSARI, S., A. MARCHETTI, F. BUTTIATTA, D. GRAZIANI, G. BORSANI
et al., 1995 Detection of p53 mutations by single-strand
conformation polymorphisms (SSCP) gel-electrophoresis – a
comparative study of radioacitive and nonradioactive silver stained
SSCP analysis. Diagn. Mol. Pathol. 4: 249-255.
- BRAZDA, V., J. PALECEK, S. POSPISILOVA, B. VOJTESEK and E.
PALECEK, 2000 Specific modulation of p53 binding to consensus
sequence within supercoiled DNA by monoclonal antibodies. Biochem.
Biophys. Res. Commun. 267: 934-939.
- BRAZDOVA, M., R. KIZEK, L. HAVRAN and E. PALECEK, 2002
Determination of glutathione-S-transferase traces in preparations
of p53 C-terminal domain (aa320-393). Bioelectrochemistry 55:
115-118.
- BULLOCK, A. N., J. HENCKEL, B. S. DEDECKER, C. M. JOHNSON, P.
V. NIKOLOVA et al., 1997 Thermodynamic stability of wild-type and
mutant p53 core domain. Proc. Natl. Acad. Sci. USA 94.
- EL-DEIRY, W. S., S. E. KERN, J. A. PIETENPOL, K. W. KINZLER and
B. VOGELSTEIN, 1992 Definition of a consensus binding-site for p53.
Nat. Genet. 1: 45.
- ELLEDGE, R. M., and W. H. LEE, 1995 Life and death by p53.
BioEssays 17: 923.
- FOJTA, M., T. KUBICAROVA, B. VOJTESEK and E. PALECEK, 1999
Effect of p53 protein redox states on binding to supercoiled and
linear DNA. J. Biol. Chem. 274: 25749-25755.
- HAINAUT, P., T. SOUSSI, B. SHOMER, M. HOLLSTEIN, M. GREENBLATT
et al., 1997 Database of p53 gene somatic mutations in human tumors
and cell lines: Updated compilation and future prospects. Nucleic
Acids Res. 25.
- ISHIMARU, D., L. R. ANDRADE, L. S. P. TEIXEIRA, P. A. QUESADO,
L. M. MAIOLINO et al., 2003 Fibrillar aggregates of the sumor
suppressor p53 core domain. Biochemistry 42: 9022-9027.
- JAGELSKA, E., V. BRAZDA, POSPISILOVA, B. VOJTESEK and E.
PALECEK, 2002 New ELISA technique for analysis of p53 protein/DNA
binding properties. J. Immunol. Methods 267: 227-235.
- LANE, D. P., 1992 Cancer – p53, guardian of the genome. Nature
358: 15.
- NISHIOKA, H., Y. HIASA, I. HAYASHI, Y. KITAHORI, N. KONISHI et
al., 1993 Immunohistochemical detection of p53 oncoprotein in human
oral squamous cell carcinomas and leukoplakias-comparison with
proliferating cell nuclear antigen staining and corrrelation with
clinicopathological findings. Oncology 50: 426-429.
- PALECEK, E., M. BRAZDOVA, H. CERNOCKA, D. VLK, V. BRAZDA et
al., 1999 Effect of transition metals on binding of p53 protein to
supercoiled DNA and to consensus sequence in DNA fragments.
Oncogene 18: 3617.
- SMITH, M. L., I. T. CHEN, Q. ZHAN, I. BAE, C. Y. CHEN et al.,
1994 Interaction of the p53-regulated protein GADD45
with proliferating cell nuclear antigen. Science 266: 1376. - TERVAHAUTA, A. I., S. M. SYRJANEN, R. MANTYJARVI and K. J.
SYRJANEN, 1994 Detection of p53 protein and Ki-67 proliferation
antigen in human papiloma virus (HPV) positive and HPV-negative
cervical lesions by immunohistochemical double-stainning.
Cytopathology 5: 282-293.
- WARTELL, R. M., S. HOSSEINI, S. POWELL and J. ZHU, 1998
Detecting single base substitutions, mismatches and
bulges in DNA by temperature gradient gel electrophoresis and related methods. J. Chromatogr. A 806.
Datum přednesení příspěvku: 26. 5. 2004





