Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: Analýza regulací v nádorech
Číslo abstraktu: 205p
Autoři: Mgr. Diana Grochová; MUDr. Jana Vaňková; prof. RNDr. Jana Šmardová, CSc.
Nádorový supresor p53 je sekvenčně specifický transkripční faktor, který zajišťuje odpověď buňky na buněčný stres a poškození DNA tím, že aktivuje expresi řady cílových genů. Výsledkem této aktivace je ovlivnění regulace důležitých buněčných procesů jako je apoptóza nebo zástava buněčného cyklu. Bylo zjištěno, že u více než poloviny všech lidských nádorů se nachází mutace v genu p53. Většina těchto mutací se vyskytuje v DNA vazebné doméně proteinu p53 a ovlivňuje tak jeho sekvenčně specifickou DNA vazebnou aktivitu.
Funkční analýza separovaných alel v kvasinkách
Pro analýzu statutu p53 v nádorové tkáni se využívá řada technik, mezi něž patří funkční analýza separovaných alel v kvasinkách FASAY (functional analysis of separated alleles in yeast) (Flaman et al. 1995). Je to citlivá, semikvantitativní metoda, která na základě zbarvení kvasinkových kolonií exprimujících lidský protein p53 rozeznává kolonie obsahující funkční protein p53 (bílé kolonie) od kolonií s nefunkční formou proteinu p53 (červené kolonie). Tato metoda také umožňuje rozeznat mutace, které vedou pouze k částečné inaktivaci proteinu p53, např. teplotně senzitivní mutace (růžové kolonie) (Šmardová et al. 2004).
Soubor teplotně závislých mutantů p53
Pomocí metody FASAY jsme analyzovali status proteinu p53 u různých typů nádorů. Identifikovali jsme 22 různých teplotně závislých mutací, kde většina z nich (91%) spadá do DNA vazebné domény proteinu p53 (Tabulka 1). U těchto 22 teplotně závislých p53 mutantů jsme dále analyzovali jejich funkční a strukturní vlastnosti: studovali jsme transaktivační schopnosti jednotlivých mutantů p53 ve vztahu k teplotě kultivace a k sekvenci různých responzivních elementů (p21, bax a RGC) a pomocí imunoprecipitace s konformačně specifickými protilátkami jsme analyzovali konformační vlastnosti těchto mutantů při různých teplotách.
Tabulka 1
Přehled teplotně závislých mutantů p53 a kontrol.
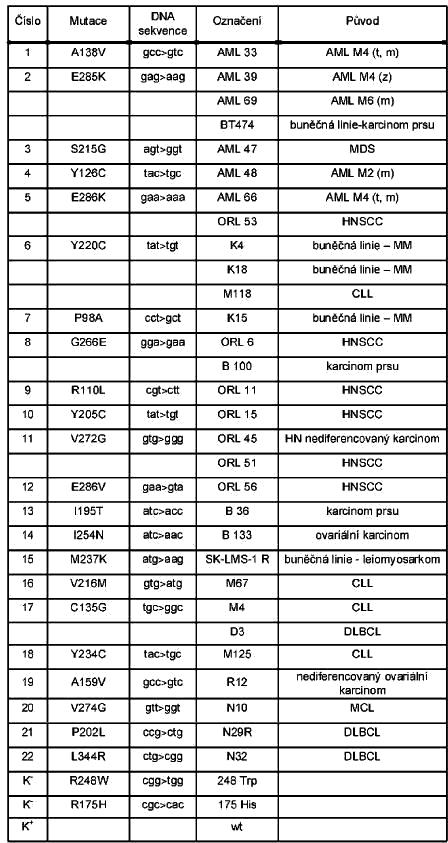
AML akutní myeloidní leukémie
MDS myelodysplastický syndrom
HNSCC spinocelulární karcinom hlavy a krku
CLL chronická lymfoidní leukémie
MM maligní melanom
DLBCL difúzní velkobuněčný B-lymfom
MCL lymfom plášťové zóny (Mantle lymfom)
K– „hot spot“ mutant (plně inaktivní)
K+ standardní p53 protein
Efekt Amifostinu na transkripční aktivitu p53 mutantů
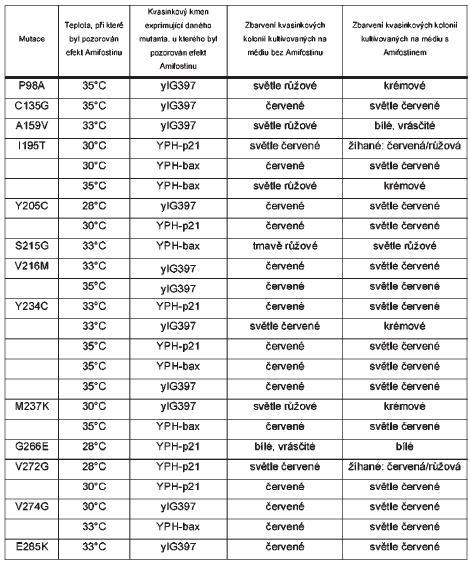
Kvasinkového expresního systému jsme dále využili při studiu efektu Amifostinu na transkripční aktivitu p53 mutantů. Amifostin (S-2[3-aminopropylamino-] ethyl phosphorothioic acid, WR2721, Ethyol) je radioa chemoprotektivní látka, která je klinicky využívána při snižování vedlejších efektů různých druhů nádorových terapeutik. In vivo je WR2721 konvertována na aktivní defosforylovanu formu WR1065 pomocí alkalické fosfatázy. WR1065 chrání nenádorovou tkáň před poškozením DNA tím, že vychytává volné kyslíkové radikály a neutralizuje účinek aktivních derivátů antineoplastických látek. Molekulární mechanismus, jakým Amifostin selektivně chrání nenádorovou tkáň, je zatím neznámá, ale předpokládá se, že nenádorová tkáň vzhledem k vyššímu obsahu alkalické fosfatázy může efektivněji přeměnit WR2721 na jeho aktivní formu než většina typů nádorové tkáně, která obsahuje nižší hladiny alkalické fosfatázy (Pluquet et al. 2003). Bylo prokázáno, že Amifostin indukuje DNA vazebnou aktivitu standardního typu proteinu p53 a zcela nebo částečně obnovuje transaktivační schopnosti některých teplotně senzitivních mutantů exprimovaných za nepermisivních podmínek, což je také jednou z příčin jeho protektivních účinků (Maurici et al. 2001). Efekt Amifostinu jsme analyzovali u všech 22 teplotně závislých p53 mutantů exprimovaných ve třech různých kvasinkových kmenech (s responzivními elementy p21, bax a RGC) při teplotách 25°C, 28°C, 30°C, 33°C a 35°C. Kvasinky rostly paralelně na médiu s Amifostinem a bez Amifostinu a jeho účinek se projevil ve změně zbarvení kvasinkových kolonií. Tato změna byla nejlépe pozorována při kultivační teplotě 33°C, kde kvasinkové kolonie rostoucí bez Amifostinu vykazovaly červený fenotyp a kolonie rostoucí na médiu s Amifostinem růžový nebo bílý, což naznačovalo reaktivaci proteinu p53. Tento efekt byl pozorován pouze u některých mutantů p53 (E285K, S215G, P98A, G266E, Y205C, V272G, I195T, M237K, C135G, V216M, Y234C, A159V, V274G) a tito p53 mutanti se navíc lišili v odpovědi na účinek působení Amifostinu vzhledem k různým promotorům (p21, bax, RGC). Celkově největší efekt reaktivace po působení Amifostinu byl pozorován u mutantů p53 exprimovaných v kvasinkovém kmeni s responzivním elementem RGC (Tabulka 2).
Závěr
Výsledky naší práce ukazují, že protein p53 je konformačně velice flexibilní a jeho funkci lze reaktivovat pomocí malých molekul jako je Amifostin. Při identifikaci takovýchto látek, které reaktivují transaktivační schopnosti proteinu p53 a mohou tak sloužit jako potenciální terapeutika, může být využita kvasinková funkční analýza. Navíc detailnější analýza funkčních a strukturních vlastností mutantů p53 a jejich podrobná stratifikace mohou být užitečné pro lepší pochopení účinků specifických mutantů na procesy vedoucí k transformaci nádorové buňky.
Literatura
- Flaman JM, Frebourg T, Moreau V, Charbonnier F, Martin C,
Chappuis P, Sappino AP, Limacher JM, Bron L, Benhattar J, Tada M,
Van Meir EG, Estreicher A, Iggo RD. Proc. Natl. Acad. Sci.
USA 92 (1995) 3963-3967.
- Šmardová J, Šmarda J, Koptíková J. Biol.listy 69 (2004)
191-214.
- Pluquet O, North S, Bhoumik A, Dimas K, Ronai Z, Hainaut P.
J Biol Chem. 278(14) (2003) 11879-87.
- Maurici D, Monti P, Campomenosi P, North S, Frebourg T, Fronza G, Hainaut P. Oncogene 20(27) (2001) 3533-40.
Tato práce je podporována grantem NR/8068-3 IGA MZ ČR.
Datum přednesení příspěvku: 11. 5. 2006





