Konference: 2009 XXXIII. Brněnské onkologické dny a XXIII. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie; zhoubné nádory mozku a CNS
Téma: I. Experimentální onkologie
Číslo abstraktu: 004
Autoři: RNDr. Jitka Poljaková; MVDr. Jan Hraběta; MUDr. Jana Hřebačková; prof. MUDr. Tomáš Eckschlager, CSc.; Eva Frei; prof. RNDr. Marie Stiborová, DrSc.
Úvod
Neuroblastom, maligní embryonální nádor dětského věku, je odvozený
z nezralých a nediferencovaných buněk neurální lišty osídlujících
paravertebrální sympatická ganglia, dřeň nadledviny a paraganglií.
Tyto nádory jsou značně biologicky variabilní. Nádory nízkého
rizika často samovolně regredují, případně spontánně či při léčbě
diferencují v ganglioneuroblastom i v benigní ganglioneurom
(Brodeur, 2003). Prognóza úspěšné léčby neuroblastomů
vysokého rizika (HR NBL) je velmi nízká. U většiny pacientů vzniká
rezistence na podávaná cytostatika, přestože z počátku na léčbu
odpovídali. A to i přes intenzivní léčbu včetně megaterapie s
následnou transplantací kostní dřeně, bioterapie a imunoterapie
(Brodeur, 2003). Oblastí zájmu je tedy snaha o nové
možnosti léčby tohoto onemocnění.
Ellipticin (5,11-dimethyl-6H-pyrido[4,3-b]karbazol) a některé jeho
deriváty jsou alkaloidy rostlin čeledi Apocynaceae s významnou
protinádorovou aktivitou (Mathé et al., 1998). Důvodem
zájmu o ellipticin je jeho vysoká účinnost proti nádorovým buňkám
(již v koncentracích řádově rovných 0,1 – 1 µM) a jeho relativně
nízké vedlejší toxické účinky. Limitující toxicitou je xerostomie
(asialie), která může vyvolávat další nežádoucí účinky jako
monilázy nebo anorexie. S výjimkou nefrotoxicity, která je svým
mechanismem vzniku podobná nefrotoxicitě cis-platiny, jsou další
vedlejší nežádoucí účinky ellipticinu minimální. Hematologická
toxicita je dokonce prakticky nulová (Klener, 1996, Diop et
al., 1984). Nicméně ellipticin a jeho 9-hydroxyderivát jsou
silnými mutageny vykazujícími mutagenní aktivitu vůči kmenům
Salmonella typhimurium, Neurospora crassa, Escherichia coli a jsou
mutagenní i vůči buňkám savčím (De Marini et al.,
1992).
Ellipticin zastavuje buněčný cyklus regulací exprese cyklinu B1 a
Cdc2, stejně tak fosforylací Cdc2 a indukuje apoptózu tvorbou
cytotoxických volných radikálů, aktivací Fas/Fas ligandového
systému, regulací proteinů rodiny Bcl-2 a zvyšováním hladiny p53
tím způsobem, že je schopen obnovit aktivitu mutantního p53 a
iniciovat tak apoptózu mitochondriální cestou (Kuo et
al.,2005). Ellipticin také odpřahuje mitochondriální
oxidativní fosforylaci (Schwaller et al., 1995), čímž
narušuje buněčnou energetickou rovnováhu. Je známo, že zastavení
buněčného cyklu v důsledku chemoterapie je většinou způsobeno
poškozením DNA, vyvolaným řadou chemoterapeutik. U ellipticinu se
předpokládá, že jeho protinádorová, mutagenní a cytotoxická
aktivita, která je determinována poškozením DNA, je dána především
interkalací jeho planární molekuly do dvoušroubovice DNA a inhibicí
topoisomerasy II (Auclair et al., 1987).
V naší laboratoři bylo prokázáno, že ellipticin, po enzymové
aktivaci cytochromy P450 (především CYP3A4, 1A a 1B1) a
peroxidasami (laktoperoxidasou, myeloperoxidasou nebo
cyklooxygenasami 1 a 2) in vitro a in vivo, je také kovalentně
vázán na DNA (Stiborová et al., 2004, Stiborová el al., 2007,
Stiborová el al., 2008). Na základě těchto poznatků lze
ellipticin považovat za látku, jejíž farmakologická účinnost a/nebo
vedlejší genotoxické účinky závisí na jeho enzymové aktivaci v
buňkách cílových tkání.
V této práci bylo sledováno, zda je ellipticin účinný vůči lidským
neuroblastomovým buněčným liniím IMR-32, UKF-NB-3, UKF-NB-4 a linii
resistentní k ellipticinu UKF-NB-4(Elli). Cílem práce
bylo poznání cytotoxicity této sloučeniny a objasnění molekulárního
mechanismu jeho působení na studované neuroblastomové buněčné
linie.
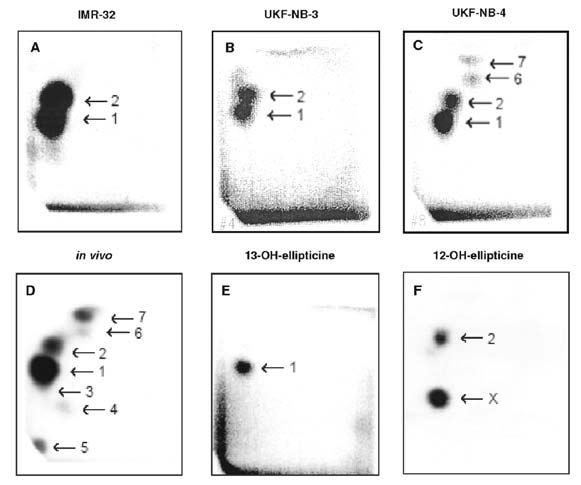
Obr. 1. Autoradiografie aduktů ellipticinu s DNA
neuroblastomových linií IMR-32 (A), UKF-NB-3 (B) a UKF-NB-4 (C)
vystavených působení 10 µM ellipticinu 48 h, jaterní DNA potkanů
exponovaných 40 mg ellipticinu/kg (D), v DNA inkubované s
13-hydroxyellipticinem (E) a 12-hydroxyelipticinem (F). Analýzy
byly prováděny metodou 32P-postlabeling, její versí využívající
nukleasu P1 pro intensifikaci detekce aduktů (Stiborová et al.,
2004, 2007, 2008).
Materiál a metody
Neuroblastomové linie UKF-NB-3 a UKF-NB-4, odvozené z metastasí
kostní dřeně HR NBL, byly poskytnuty Prof. J. Cinatlem, Jr. (J.
W. Goethe University, Frankfurt, Germany). Linie IMR-32
pochází z komerčního zdroje (LGC Promochem, Wesel,
Germany). Cytotoxicita ellipticinu (Sigma, St. Louis, MO,
USA) byla sledována MTT testem, který spočívá v redukci
žlutého rozpustného
3-[4,5-dimethylthiazol-2-yl]-2,5-difenyltetrazoliumbromidu na
nerozpustné modré krystaly formazanu, jak je popsáno v naší
předchozí práci (Poljaková et al., 2007). Analýzy vlivu
ellipticinu na buněčný cyklus neuroblastomů, indukce apoptózy a
exprese mRNA a proteinů metabolizujících ellipticin byly prováděny
postupy popsanými v naší práci (Poljaková et al., 2009).
Tvorba kovalentních aduktů aktivovaného ellipticinu s DNA byla
sledována metodou 32P-postlabeling jak je popsáno dříve
(Stiborová et al., 2004, 2007, 2008).
Výsledky a diskuse
Expozice neuroblastomových buněčných linií ellipticinu (1 a 10 µM,
48 hodin) indukuje „arrest“ buněčného cyklu linií IMR-32 a UKF-NB-4
v S fázi, zatímco buněčný cyklus linie UKF-NB-3 je zastaven v G0/G1
a G2/M fázi. Zjistili jsme, že tyto efekty jsou asociovány s
tvorbou dvou kovalentních aduktů ellipticinu s DNA, identickými s
adukty tvořenými metabolity této sloučeniny, 13-hydroxya
12-hydroxyellipticinem, tvořenými cytochromy P450 and peroxidasami
(Obr. 1), s deoxugunaosinem v DNA. Kromě těchto dvou hlavních
aduktů byly v buněčné linii UKF-NB-4 vystavené 48 hodin ellipticinu
o koncentraci 10 µM nalezeny ještě dva minoritní adukty – adukt 6 a
7. Z dřívějších studií v naší laboratoři vyplývá, že tyto minoritní
adukty jsou tvořeny in vitro po oxidaci ellipticinu především
peroxidasami.
V jednotlivých buněčných liniích byla analyzována exprese enzymů
metabolizujících ellipticin, a to jak na úrovni mRNA, tak i na
úrovni proteinů. Ve všech studovaných buněčných liniích byla
detekovaná mRNA enzymů CYP1A1, 1B1, 3A4, COX-1 a 2, avšak hladiny
mRNA COX-2, CYP3A4 a 1A1 byly v parentálních liniích extrémně
nízké. Ve všech studovaných buněčných liniích byla rovněž
detegována exprese proteinů některých enzymů aktivujících
ellipticin, a to CYP1A1, 1B1 a 3A4, na rozdíl od COX-1 a 2, jejichž
expresi jsme za našich experimentálních podmínek v
neuroblastomových buňkách nedetekovali.
Množství aduktů tvořených ellipticinem v DNA buněk
neuroblastomových linií IMR-32 a UKF-NB-4 korelovalo s toxicitou
ellipticinu vůči těmto liniím. Navíc, kultivace těchto
neuroblastomových linií za hypoxických podmínek vedla k poklesu
toxicity ellipticinu, který koreloval se snížením množství aduktů s
DNA.
Závěr
Výsledky získané v této studii jasně prokazují, že ellipticin je
účinným agens snižujícím růst neuroblastomových buněčných linií a
signalizují, že tvorba kovalentních aduktů DNA s ellipticinem po
jeho enzymové aktivaci v neuroblastomových liniích IMR-32 a
UKF-NB-4, je rozhodujícím mechanismem vedoucím k cytotoxicitě
tohoto léčiva vůči uvedeným nádorovým liniím.
Literatura
- Auclair C. Arch Biochem Biophys 1987;259:1.
- Broduer GM. Nat. Rev. Cancer 2003;3:203.
- De Marini DM, Abu-Shakra A, Gupta R, Hender LJ, Levine JE. Environ. Mol. Mutagen 1992;20:12.
- Diop B, Toure P, Sow MT, Toure M, Halliez ML, Castaigner JP, Mondestr JM, DeJaeger R. Med. Afr. Noire 1984;31:107.
- Klener P: Protinádorová chemoterapie. Praha: Galén 1996
- Kuo PL, Hsu YL, Kuo YC, Chang CH, Lin CC. Anti-Cancer Drugs 2005;16:789.
- Mathé G, Triana K, Pontiggia P, Blanquet D, Hallard M, Morette C. Biomed. Pharmacother. 1998;52:391.
- Poljaková J, Eckschlager T, Hraběta J, Hřebačková J, Smutný S, Frei E, Martínek V, Kizek R, Stiborová M. Biochem. Pharmacol. 2009, v tisku.
- Poljaková J, Frei E, Gomez JE, Aimová D, Eckschlager T, Hraběta J, Stiborová M. Cancer Lett. 2007;252:270.
- Schwaller MA, Allard B, Lescot E, Moreau F. J Biol Chem 1995;270:22709.
- Stiborová M, Arlt VM, Henderson CJ., Wolf CR, Kotrbová V, Moserová M, Hudeček J, Phillips DH, Frei E. Toxicol. Appl.Pharmacol. 2008;226:318.
- Stiborová M, Sejbal J, Bořek-Dohalská L, Aimová D, Poljaková J, Forsterová K, et al. Cancer Res 2004;64:8374.
- Stiborová M, Poljaková J, Ryšlavá H, Dračínský M, Eckschlager T, Frei E. Int J Cancer 2007;120:243.
Poděkování
Práce vznikla za finanční podpory MŠMT (MSM0021620813 a
1M0505)
Datum přednesení příspěvku: 17. 4. 2009





