Konference: 2008 XV. Jihočeské onkologické dny
Kategorie: Genitourinární nádory
Téma: Nádory prostaty
Číslo abstraktu: 011
Autoři: prof. MUDr. Martin Doležel, Ph.D.; prof. MUDr. Karel Odrážka, Ph.D.; doc. MUDr. Jaroslav Vaňásek, CSc.; MUDr. Miloslava Vaculíková; MUDr. Jana Šefrová; doc. MUDr. Milan Vošmik, Ph.D.; MUDr. Jan Jansa; MUDr. Zuzana Pleskačová (Mačingová); prof. MUDr. Jiří Petera, Ph.D.; Ing. Petr Paluska; Ing. Milan Zouhar; MUDr. Petr Morávek, CSc.; prof. MUDr. Miloš Broďák, Ph.D.
Karcinom prostaty je nejčastější urologickou malignitou. V léčbě pacientů s nádorem prostaty hraje radioterapie významnou roli. U pacientů s nízkým a středním rizikem je metodou volby, u pacientů s vysokým rizikem je v kombinaci s hormonální léčbou zlatým standardem.
Četné radiobiologické studie a retrospektivní klinická data prokazují dávkovou závislost karcinomu prostaty. Tato skutečnost byla potvrzena 4 recentními randomizovanými studiemi (Dearnaley Lancet Oncol 2007, Peeters JCO 2006, Pollack JCO 2000, Zietman JÁMA 2005), které prokázaly zlepšení biochemické kontroly u pacientů s eskalovanou dávkou. Data s delší dobou sledování potvrzují rovněž zlepšení DMFS a CSS (Hanks IJROBP 2002, Jacob Cancer 2004, Pollack J Urol 2004, Zelefsky IJROBP 2006). Eskalace dávky s sebou ovšem rovněž přináší zvýšenou morbiditu zejména v podobě pozdní gastrointestinální a urologické toxicity. Díky technologickému pokroku byla do klinické praxe zavedena radioterapie s modulovanou intenzitou svazku (IMRT). Uvedená metoda využívá modifikace intenzity fotonového svazku napříč ozařovaným polem. Takto je možné dosáhnout významně lepší prostorové distribuce dávky než je tomu při užití 3D konformní radioterapie. V klinické praxi to teoreticky znamená možnost eskalovat dávku bez výrazného zvýšení toxicity. Další výhodou této metody je možnost provedení ozáření formou simultánního integrovaného boostu (SIB). Tato radiační technika umožňuje aplikovat v průběhu jedné frakce ozáření do dvou různých cílových objemů různé dávky.
METODY
Od 2/02 do 1/07 jsme léčili pomocí IMRT suprakonvenční dávkou 180 pacientů. V první fázi jsme aplikovali 134 pacientům se středním a vysokým rizikem dávku LD 78 Gy a 2 Gy v 39 frakcích na oblast prostaty a baze semenných váčků (u pacientů s cT3b na oblast prostaty a celých SV). Po předběžném zhodnocení akutní a časné pozdní toxicity jsme přistoupili k další eskalaci dávky pomocí techniky SIB. 52 pacientům se středním a vysokým rizikem (s vyloučením nemocných se stadiem cT3b) jsme aplikovali na oblast prostaty dávku LD 82 Gy a 2 Gy v 41 frakcích a na oblast baze SV dávku LD 73,8 Gy a 1,8 Gy v 41 frakcích. Při konturování jsme získali PTV přidáním 1cm bezpečnostního lemu ve všech směrech (včetně dorzálního) k výše popsanému CTV. Rizikové orgány jsme konturovali v rozsahu PTV + 1 cm kraniálně i kaudálně. Při plánování jsme použili 5 polí (30, 100, 180, 260, 330) a specifikovali dávku do isocentra za striktního dodržení minimál¬ní pokrytí 95%V/95%D. Nastavení pacientů bylo verifikováno týdně pomocí portálového snímku s tolererancí odchylky 3mm při srovnání pomocí kostěných struktur. Všichni pacienti s vysokým rizikem absolvovali hormonoterapii (dle GS neadjuvantní či trvalou ablaci androgenů).
V průběhu ozařování byli pacienti klinicky kontrolováni 1x týdně. Po ukončení radioterapie byli nemocní sledováni v prvních 2 letech každé 3 měsíce a následně po půl roce. Důsledně byla monitorována kromě hladiny PSA i toxicita léčby, v případně akutní toxicity dle kritérií EORTC/RTOG, v případě pozdní toxicity dle RTOG FC-LENT.
VÝSLEDKY
Akutní GIT toxicita G3-4 se nevyskytla u žádného pacienta. Akutní urologickou toxicitu G3-4 jsme pozorovali u 13% pacientů léčených dávkou 78 Gy a 10% pacientů léčených dávkou 82 Gy. Všechny případy urologické toxicity 4.stupně byly tvořeny pacienty s nutností zavedení PMK, nebyla pozorována nekróza či ulcerace močového měchýře. Pouze u jednoho pacienta (v rameni 78 Gy) byla zastižena významnější hematurie (při současně prokázané infekci močových cest). Pozorovaná akutní toxicita je srovnatelná s nežádoucími účinky u pacientů léčenými v minulosti 3D-CRT při použití dávky LD 74 Gy a 2 Gy v 37 frakcích. U těchto pacientů se rovněž nevyskytla žádná akutní GIT toxicita G3-4 a těžká urologická toxicita byla pozorována u 12,8% pacientů.
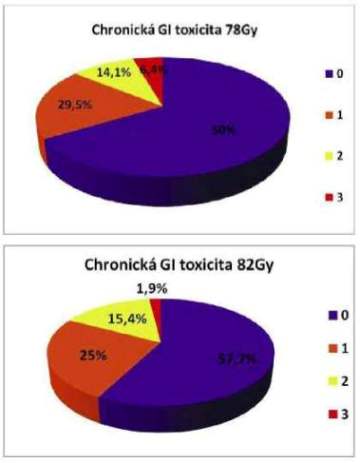
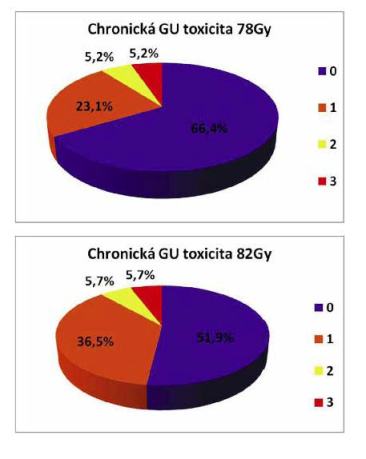
Medián sledování chronické toxicity činí 28,8 měs.pro celou skupinu pacientů, 30 měsíců pro rameno 78 Gy a 24 měsíců pro rameno 82 Gy. Chronická toxicita čtvrtého stupně nebyla pozorována u žádného pacienta. GIT toxicita G3 byla sledována u 6,4% pacientů v rameni 78 Gy a v 1,9% v rameni 82 Gy. GU toxicita G3 byla přítomna u 5,2% pacientů v rameni 78 Gy a v 5,7% pacientů v rameni 82 Gy.
V minulosti byly tyto skupiny pacientů léčeny pomocí 3D-CRT dávkou LD 74 Gy a 2 Gy v 37 frakcích a identicky hodnocena toxicita léčby (EORTC/RTOG a RTOG FC-LENT). GIT toxicita G3 byla přítomna u 14,9% pacientů a GU toxicita G3 u 23,4% pacientů. Při přímé komparaci dat jsme dosáhli přes eskalaci dávky statisticky signifikantně menší toxicity. V případě GIT p=0,006, v případě GU toxicity G3 p=0,0002.
ZÁVĚR
Přestože medián sledování činí 28,8 měsíců, odvažuji se tvrdit, že radioterapie s modulovanou intenzitou svazku umožňuje eskalovat dávku bez klinicky významného zhoršení morbidity. Není vyloučeno, že budeme v budoucnu při delším mediánu FU dokonce schopni potvrdit signifikantní snížení toxicity.
Datum přednesení příspěvku: 10. 10. 2008





