Konference: 2004 XXVIII. Brněnské onkologické dny a XVIII. Konference pro sestry a laboranty
Kategorie: Gastrointestinální nádory
Téma: Nádory žlučových cest a jater
Číslo abstraktu: 93
Autoři: prof. MUDr. Vlastimil Válek, CSc.; prof. MUDr. Zdeněk Kala, CSc.; doc. MUDr. Igor Kiss, Ph.D., MBA
- Sonografie (B – mode, doppler, „power“ doppler, kontrastní látky – Sonovue)
- Výpočetní tomografie (dvou-, třífázové CT vyšetření, 3D CT, virtuální rekonstrukce)
- Magnetická rezonance (specifické, nespecifické kontrastní látky, dynamické MR, MRCP, 3D rekonstrukce)
- Angiografie (hypervaskularizované léze, pseudoaneurysmata, patologické vaskularizace)
U maligních nádorů, které postihují játra (primární, sekundární) je důležité zjistit počet ložisek (senzitivita), velikost ložisek, lokalizaci ložisek (segmentární anatomie) a charakteristiku ložisek (specificita) (Ruers 2002, Achenbach 2002).
Ultrazvuk
Sonografické vyšetření je metoda subjektivní. Problém je velký rozdíl v možnostech přístrojů, což se odráží na kvalitě vyšetření. Obrazová dokumentace je většinou nedostatečná. Možným řešení je odesílání snímků ve formátu DICOM do digitálního archivu a využití specifických kontrastních látek (Sonovue). Cílené vyšetření by měl provádět lékař – specialista. Vyšetření necílené je spíše jen „pohmat ultrazvukovou sondou“.
Výpočetní tomografie (CT)
Výpočetní tomografie je metoda, která využívá ionizační záření a deterministické ale především nondeterministické účinky tohoto záření jsou jedním z hlavních omezení (Lancet 2004). Platí, že čím vyšší je kategorie CT, tím vyšší je radiační zátěž nemocného. Weg uvádí, že tenké řezy při CT vyšetření zvyšují detekci ložisek v játrech o 40% (Weg 1998). Kopka uvádí, že 2 a 4 mm řezy zvyšují detekci ložisek v játrech při CT vyšetření na 96% a charakteristika těchto ložisek je možná v 87% resp. 84%. Multislice CT výrazně nezvyšuje specificitu ani senzitivitu při vyšetřování hepatobiliárního systému. Umožňuje ale provádění 3D rekonstrukcí, které usnadňují klinikovi pohled na celou problematiku a event. staging je komplexnější. Standard je tedy stále dvou– či třífázové CT vyšetření Při CT vyšetření ložiska v játrech hodnotíme podle jejich denzity a charakteru sycení. Nativně je denzita ložisek ovlivněná jejich složením (tekutina, krev, kalcifikace, tuk, plyn, „kov“), ale i denzitou okolních jater („subjektivní denzita“). Postkontrastně je denzita ovlivněná cévním zásobením jater (fyziologické, patologické), složením ložiska (cévy, vazivo), cévním zásobením ložiska (maligní arteriální sycení). Denzity jsou typické např. pro cystu, tuk, kalcifikace a haemosiderin. Sycení při třífázovém CT nás informuje, jak rychle do ložiska krev přitéká, jaký je charakter sycení (noduly, lem, centrální jizva, homogenní sycení), jak rychle krev odtéká (vazivo, kapsula).
Někteří autoři se domnívají, že pokrok v CT/MR technologiích/protokolech nic signifikantního nezměnil, má podle většiny autorů „double kontrast MRI“ (DCMRI) senzitivitu přibližně stejnou jako CTAP, ale vyšší specificita (Kondo 2000). CTAP je ale invazivní metody. Kondo doporučuje využít DCMRI, když není dostupný PET. Problém je ale protokol vyšetření, který může zahrnovat celou řadu sekvencí.
Nemocné s ložiskovými procesy v játrech můžeme rozdělit do několika skupin:
- Pacienti s náhodným nálezem ložiska bez známého primárního tumoru
- Pacienti s ložiskem v játrech se známým primárním tumorem
- Pacient s ložiskem v játrech v cirhotickém terénu
Mezí léze, které není nutné sledovat a které „lze pustit z hlavy“, můžeme u nemocných s náhodným nálezem ložiska v játrech zařadit:
- Ložiska, která mají charakteristický benigní vzhled – hemangiom, FNH, fokální tuk, cysta.
- Ložiska, která nemají známky spojené s malignitou – pouzdro, halo, Ca++, atd.
- Ložiska u nemocných, u kterých nejsou predisponující podmínky – primární nádor, chronické onemocnění jater.
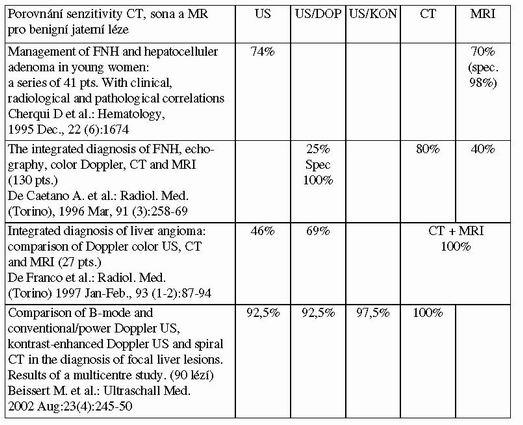
Benigní jaterní léze na ultrazvuku – porovnání senzitivity CT, sona a MR
Pacienti s ložiskem v játrech se známým primárním tumorem
Problematická jsou především malá ložiska. Jones uvádí na souboru 1454 nemocných s ložisky v játrech do 15mm, že u nemocných bez primárního tumoru bylo 100% těchto ložisek benigních. U pacientů, kteří ale měli známý primární tumor bylo pouze 51% těchto ložisek benigních a 49% maligních (Jones 1992). Je tedy zřejmé, že taktika dalšího diagnostického algoritmu musí být u druhé skupiny pacientů jiná. Schwartz našel u souboru 2978 nemocných s karcinomem 378 malých ložisek v játrech. Z nich 44 byly metastázy (Schwartz 1999). Přitom je ale sledování všech ložisek v játrech především pomocí CT u nemocných bez primárního tumoru významnou a zbytečnou radiační zátěží.
Typické pro vaskularizované tumory je prostorová heterogenita a chaotická struktura, nepravidelné toky a zvýšená permeabilita endotelu (nezralé a „prosakující“ cévy). Toto koreluje s agresivitou, rizikem metastazování a prognózou mnoha tumorů. Obecné informace o maligním ložisku v játrech jsou jeho hypervaskularizace a hyperpermeabilita. Toto dokážeme zobrazit aplikací intravaskulární a intersticiální kontrastní látky (jodové – CT a Gd-cheláty – MR).
Metastázy kolorektálního karcinomu zahrnují 40% všech jaterních metastáz. Vyskytují se u 15% nemocných synchronně s primárním tumorem, u 20% nemocných po léčbě primárního tumoru a ve více jako 90% jako mnohočetná ložiska. Resekce jaterních metastáz prodlužuje přežití nemocných s kolorektálním karcinomem. 5tileté přežití je u nemocných bez léčby 0 – 3% (průměr 9 měsíců), po resekci pak 35 – 40% (Ruers 2002, Achenbach 2002).
V diagnostice metastáz má nativní MR (prosté T1 a T2) senzitivitu 67 – 81%, specificitu 80 – 82% (Kanematsu 1998, Matsuo 2001, Vogl 1996).
Dynamické MR s použitím malomolekulárních Gd-Chelátů – Magnevist (Gadopentetate), Omniscan (Gadodiamid), Dotarem
(Gadoteridol), ProHance (Gadoteramide) má senzitivitu 67 – 81% a specificitu 82 – 94%. V 95% jsou metastázy hypovaskulární a 5% hypervaskulární (Kanematsu 1998, Matsuo 2001, Vogl 1996). Při využití MR hepatobiliárních kontrastních látek – MultiHance (Gadobenat Dimeglumin), Esovist (Gadoxetic Acid), Teslascan (Magafodipir trisodium) je senzitivita 80 – 100% a specificita 92 – 98% (Torres 1997, Mann 2001, Slater 1996, Hamm 1995, Petersein 2000, Federle 2000, Runge 2000, Kirchin 1998). Při použití Iron oxyd-enhanced kontrastních látek v MR diagnostice jaterních metastáz jako SPIO >50nm Ferumoxides, Ferrixan (Endorem, Feridex, Resovist) a USPIO < 50nm Ferunoxiran, Feruglose (Sinerem, Combidex, Clariscan, Resovist S) je senzitivita vyšetření 68 – 100% a specificita 82 – 98% (Bluemke 2000, Oudkerk 1997, Vogl 1996, Ba-Ssalamah 2000, Nakayama 2000, Lencioni 1998).
Pacient s ložiskem v játrech v cirhotickém terénu
Jiná je ale situace u nemocných s jaterní cirhózou. Caturelli sledoval ultrazvukem v terénu jaterní cirhózy léze, které měli charakter hemangiom (Caturelli 2001). V souboru 1982 nemocných bylo 44 takovýchto lézí. Z nich ale bylo 22 verifikovaných histologicky jako HCC, 22 pak jako hemangiom.
Tedy obecně platí, že každá léze v cirhotickém terénu musí být považovaná za maligní, pokud není potvrzená benignita. Přitom ale až 50% malých uzlů (do 2cm) detekovaných sonograficky nejsou HCC. Jedná se o velké regenerativní uzly a dysplastický uzly. (Kanematsu 1999, Horigome 1999). Navíc je třeba počítat s tím, že AFP má v diagnostice HCC nízkou senzitivitu, CT/MRI (cena, radiační zátěž) není vhodné pro opakovaná vyšetření a ultrazvuk se zdá být jediná akceptovatelná metoda pro screening/sledování těchto nemocných, i když senzitivita nepřesahuje 71% (Collier 1998).
Ani verifikace ložisek biopsií není podle některých autorů optimálním řešením. Kim a Takamori se nezávisle domnívají, že riziko rozsevu tumoru po biopsii (HCC, cirhóza) je pravděpodobně podceň ováno. Podle jejich zkušeností je rozsev po biopsii 3.4 – 5.1% a byl častější u povrchových a špatně diferencovaných HCC (Kim 2000, Takamori 2000). Toto je třeba vzít v úvahu především u kandidátů k transplantaci.
Panel expertů shrnuje, že HCC může být diagnostikovaný s použitím výhradně zobrazovacích metod (navzdory vysoké hladině AFP) když spirální CT nebo MRI ukazuje arteriální sycení u léze detekované ultrazvukem. Tato skupina expertů dále shrnuje, že od nedetekovatelné léze k lézi 2 cm uplyne 4 – 12 měsíců. Doporučují tedy sledovací interval 6 měsíců (AFP + sono). U lézí pod 1cm stačí pouze sledovat, léze 1 – 2 cm velké je nutné verifikovat biopticky (zobrazovací metody nejsou dostatečně přesné) a léze nad 2 cm lze určit zobrazovacími metodami. U nemocných s normálním AFP na začátku a vzestupem o >20ng/ml během sledování je nutné při negativním sonu doplnit trifazické CT (EASL Panel of Experts on HCC 2001).
Literatura
- Adam R., Avisar E., Ariche A., Giachetti S., Azoulay D., Castaing D., Kunstlinger F., Levi F., Bismuth F.: Five-Year Survival Following Hepatic Resection After Neoadjuvant Therapy for Nonresectable Colorectal [Liver] Metastase. Annals of Surgical Oncology, 2001, 8, 4, s. 347 – 353
- Achenbach T., Seifert J. K., Pitton M. B., Schunk K. Junginger T.: Chemoembolization for primary liver cancer. European Journal of Surgical Oncology, 2002, 28, 1, s. 37 – 41
- Allum W. H., Griffin S. M., Watson A., Colin-Jones D.: Guidelines or the management of oesophageal and gastric cancer. Gut, 2002, 50, 90005, s. 1 – 23.
- Ba-Ssalamah A., Schima W., Schmook M.T., Linnau K.F., Schibany N., Helbich T., Reimer P., Laengle F., Wrba F., Kurtaran A., Ryan M., Mann F. A.: Atypical Focal Nodular Hyperplasia of the Liver: Imaging Features of Nonspecific and Liver-Specific MR Contrast Agents. Am. J. Roentgenol., 2002, 179, 6, s. 1447 – 1456.
- Ba-Ssalamah A., Heinz-Peer G., Schima W., Schibany N., Schick S., Prokesch R.W., Kaider A., Teleky B., Wrba F., Lechner G.: Detection of focal hepatic lesions: comparison of unenhanced and SHU 555 A-enhanced MR imaging versus biphasic helical CTAP. J. Magn. Reson. Imaging., 2000, 11, 6, s. 665 – 672.
- Berrington de González A., Darby S.: Risk of cancer from diagnostic X-rays: estimates for the UK and14 other countries. Lancet, 2004, 363, s. 345 – 351
- Bluemke D.A., Paulson E.K., Choti M.A., DeSena S. Clavien P.A.:
Detection of Hepatic Lesions in Candidates for Surgery
Comparison of Ferumoxides-Enhanced MR Imaging and Dual-Phase Helical CT. AJR, 2000, 175, s. 1653 – 1658 - Bruix J., Herman M., Llovet J.M., Beaugrand M., Lencioni R., Burroughs A.K., Christensen E., Pagliaro L, Kolombo M. Rodés J. (for the EASL Panel of Experts on HCC): Clinical Management of Hepatocellular Carcinoma. Conclusions of the Barcelona-2000 EASL Konference. Journal of Hepatology, 2001, 35, 3, s. 421 – 430
- Caturelli E., Pompili M., Bartolucci F., Siena D.A., Sperandeo M., Andriulli A., Bisceglia M.: Hemangioma-like Lesions in Chronic Liver Disease: Diagnostic Evaluation in Patiens. Radiology, 2001, 220, s. 337 – 342.
- Collier J., Herman M.: Screening for hepatocellular carcinoma. Hematology, 1998, 27, 1, s. 273 – 278
- Eberhardt S.C., Choi P.H., Bach A.M., Funt S.A., Felderman H.E., Hann L.E.: Utility of Sonography for Small Hepatic Lesions Found on Computed Tomography in Patients With Cancor. J. Ultrasound Med., 2003, 22, 4, s. 335 – 343.
- Federle M., Chezmar J., Rubin D.L., Weinreb J., Freeny P. et al.: Efficacy and safety of mangafodipir trisodium (MnDPDP) injection for hepatic MRI in adults: results of the U.S. Multicenter phase III clinical trials. Efficacy of early imaging. J. Magn. Reson. Imaging., 2000, 12, 5, s. 689 – 701.
- Fleszler F., Friedenberg F., Krevsky B., Friedel D., Braitman L.E.: Abdominal computed tomography prolongs length of stay and is frequently unnecessary in the evaluation of acute pancreatitis. Am. J. Med. Sci., 2003, 325, 5, s. 251 – 255.
- Hamm B., Staks T., Muhler A., Bollow M., Taupitz M., Frenzel T., Wolf K. J., Weinmann H., Lange L.: Phase I clinical evaluation of Gd-EOB-DTPA as a hepatobiliary MR contrast agent: safety, pharmacokinetics, and MR imaging. Radiology, 1995, 195, s. 785 – 792
- Horigome H., Nomura T., Saso K., Itoh M., Joh T., Ohara H.: Limitations of imaging diagnosis for small hepatocellular carcinoma: Comparison with histological findings. Journal of Gastroenterology and Hematology, 1999, 14, 6, s. 559
- Chang C. K., Hendy M. P., Smith J. M., Recht M. H., Welling R.
E.: Radiofrequency Ablation of the Porcine Liver With Complete
Hepatic Vascular Occlusion. Annals of Surgical Oncology, 2002, 9,
s. 594 – 598
- Jones E. C., Chezmar J. L., Nelson R. C., Bernardino M. E.: The frequency and significance of small (less than or equal to 15 mm) hepatic lesions detected by CT. American Journal of Roentgenology, 1992, 158, s. 535 – 539
- Kanematsu M., Hoshi H., Yamada T., Murakami T., Kim T., Kato M., Yokoyama R., Nakamura H.: Small hepatic nodules in cirrhosis: ultrasonographic, CT, and MR imaging findings. Abdom Imaging, 1999, 24, 1, s. 47 – 55
- Kanematsu M., Hoshi H., Sone Y., Mochizuki R., Kato M., Yokoyama R.: Detection of hepatic tumors: arterial-phase MR imaging versus spiral CT arteriography. Abdominal Imaging, 1998, 23, 4, s. 416 – 421
- Kim S.H., Lim H.K., Lee W.J., Cho J.M., Jang H.J.: Needle-tract
implantation in hepatocellular carcinoma: frequency and
CT findings after biopsy with a 19.5-gauge automated biopsy gun. Abdom Imaging, 2000, 25, 3, s. 246 – 50. - Kirchin M.A., Pirovano G.P., Spinazzi A.: Gadobenate dimeglumine (Gd-BOPTA). An overview. Invest. Radiol., 1998, 33, 11, s. 798 – 809.
- Kondo H., Kanematsu M., Hoshi H. et al: Preoperative Detection of Malignant Hepatic Tumors: Comparison of Combined Methods of MR Imaging with Combined Methods of CT. AJR, 2000, 174, s. 947 – 954
- Leifer D., Middleton W., Teefey S., Menias Ch., Leahy J.: Follow-up of Patients at Low Risk for Hepatic Malignancy with a Characteristic Hemangioma at US. Radiology, 2000, 214, s. 167 – 172
- Lencioni R., Donati F., Cioni D., Paolicchi A., Cicorelli A., Bartolozzi C.: Detection of colorectal liver metastases: prospective comparison of unenhanced and ferumoxides-enhanced magnetic resonance imaging at 1.5 T, dual-phase spiral CT, and spiral CT during arterial portography. MAGMA, 1998, 7, 2, s. 76 – 87.
- Mann G. N., Marx H.F., Lai L. L., Wagman L. D.: Clinical and
Cost Effectiveness of a New Hepatocellular MRI Contrast Agent,
Mangafodipir Trisodium, in the Preoperative Assessment of Liver
Resectability. Annals of Surgical Oncology, 2001,
8, 7, s. 573-579. - Matsuo M., Kanematsu M., Itoh K., Ito K., Maetani Y., Kondo H., Kako N., Matsunaga N., Hoshi H. Shiraishi J.: Detectionof Malignant Hepatic Tumors Comparison of Gadolinium-and Ferumoxide-Enhanced MR Imaging. AJR, 2001, 177, s. 637 – 643
- Meric F., Patt Y. Z., Curley S. A., Chase J., Roh M. S., Vauthey J. N., Ellis L. M.: Surgery After Downstaging of Unresectable Hepatic Tumors With Intra-Arterial Chemotherapy. Annals of Surgical Oncology, 2000, 7, 7, s. 490 – 495
- Mueller G. C., Hussain H. K., Carlos R. C., Nghiem H. V., Francis I. R.: Effectiveness of MR Imaging in Characterizing Small Hepatic Lesions: Routine Versus Expert Interpretation. Am. J. Roentgenol., 2003, 180, 3, s. 673 – 680.
- Nakayama M., Yamashita Y., Mitsuzaki K., Yi T., Arakawa A., Katahira K., Nakayama Y., Takahashi M.: Improved tissue characterization of focal liver lesions with ferumoxide-enhanced T1 and T2-weighted MR imaging. J. Magn. Reson. Imaging., 2000, 11, 6, s. 647 – 654.
- Oudkerk M., van den Neucel A. G., Wielopolski P. A., Schmitz P.
I., Borel Rinkes P., Wiggers T.: Hepatic lesions: detection with
ferumoxide-enhanced T1-weighted MR imaging. Radiology, 1997, 203,
s. 449 – 456.
- Petersein J., Spinazzi A., Giovagnoni A., Soyer P., Terrier F., Lencioni R.: Focal Liver Lesions: Evaluation of the Efficacy of Gadobenate Dimeglumine in MR Imaging – A Multicenter Phase III Clinical Study. Radiology, 2000, 215, s. 727 – 736
- Roh M. S.: Increasing the Number of Patients Undergoing
Resection of Colorectal Liver Metastase. Annals of Surgical
Oncology, 2000, 7, 9, s. 634 – 635
- Robinson P. J., Arnold P., Wilson D.: Small „indeterminate“ lesions on CT of the liver: a follow-up study of stability. Br. J. Radiol., 2003, 76, 912, s. 866 – 874.
- Ruers T., Bleichrodt R.P.: Treatment of liver metastases, an
update on the possibilities and results. European Journal of
Cancer, 2002, 38, 7, s. 1023 – 1033
- Runge V. M.: Safety of approved MR contrast media for
intravenous injection. J. Magn. Reson. Imaging., 2000, 12, 2, s.
205
– 213 - Saini S.: Imaging of the Hepatobiliary Tract. N. Engl. J. Med., 1997, 336, 26, s. 1889 – 1894.
- Schwarz L. H., Gandras E. J., Colangelo S. M., Ercolani C. M., Panicek D. M.: Prevalence and Importance of Small Hepatic Lesions Found at CT in Patients with Cancer. Radiology, 1999, 210, s. 71 – 74
- Siperstein A., Garland A., Engle K., Rogers S., Berber E., Foroutani A., String A., Ryan T., Ituarte P.: Local Recurrence After Laparoscopic Radiofrequency Thermal Ablation of Hepatic Tumors. Annals of Surgical Oncology, 2000, 7, 2, s. 106 – 113
- Slater G. J., Saini S., Mayo-smith W. W., Sharma P., Eisenberg P. J., Hahn P. F.: Mn-DPDP enhanced MR imaging of the liver: analysis of pulse sequence performance. Clin. Radiol., 1996, 51, 7, s. 484 – 486.
- Smith J., Lee J., Burke C., Contractor K., Dawson P.: Major colorectal cancer resection should not be denied to the elderly. Eur. J. Surg. Oncol., 2002, 28, 6, s. 661 – 6.
- Takamori R., Wong L., Dang C., Wong L.: Needle-tract implantation from hepatocellular cancer: Is needle biopsy of the liver always necessary? Liver Transpl., 2000, 6, s. 67 – 72
- Takeda A., Stoeltzing O., Ahmad S.A., Reinmuth N., Liu W.,
Parikh A., Fan F., Akai M., Ellis L.M.: Role of Angiogenesis in the
Development and Growth of Liver Metastasi. Annals of Surgical
Oncology. 2002, 9, s. 610 – 616
- Torres C. G., Lundby B., Sterud A. T., McGill S., Gordon P.B.,
Bjerknes H.S.: MnDPDP for MR imaging of the liver. Results from the
European phase III studies. Acta. Radiol., 1997, 38, s. 631 –
637.
- Vogl TJ., Hammerstingl R., Schwarz W., Mack M. G., Muller P. K., Pegios W., Keck H., Eibl – Eibesfeldt A., Hoelzl J., Woessmer B., Bergman C., Felix R.: Superparamagnetic iron oxide-enhanced versus gadolinium-enhanced MR imaging for differential diagnosis of focal liver lesions. Radiology, 1996, 198, s. 881 – 887.
- Weg N., Scheer M. R., Gabor M.P.: Liver lesions: improved detection with dual-detector-array CT and routine 2.5-mm thin collimation. Radiology, 1998, 209, s. 417 – 426
- Wood T. F., Rose D. M., Chung M., Allegro D. P., Foshag L. J.,
Bilchik A. J.: Radiofrequency Ablation of 231 Unresectable
Hepatic Tumors: Indications, Limitations, and Complications. Annals of Surgical Oncology, 2000, 7, 8, s. 593 – 600
Datum přednesení příspěvku: 26. 5. 2004





