Konference: 2010 XXXIV. Brněnské onkologické dny a XXIV. Konference pro sestry a laboranty
Kategorie: Genitourinární nádory
Téma: Pokroky v biologii nádorů
Číslo abstraktu: 085
Autoři: Mgr. Lenka Pašková; Ing. Kateřina Trtková, CSc.
Karcinom prostaty je v současné době jedním z nejčastěji diagnostikovaných urogenitálních tumorů na světě. Ve vývoji a růstu nejen zdravé prostaty, ale i karcinomu prostaty hraje velmi důležitou roli androgenový receptor (AR) spolu s androgeny. AR je ligandem indukovaný transkripční faktor náležící do rozsáhlé rodiny steroidních jaderných hormonálních receptorů. AR má jako transkripční faktor schopnost regulovat tkáňově specifickou expresi různých cílových genů. Jedním z takto regulovaných genů je i PSA (prostatický specifický antigen). Úroveň exprese tohoto genu je regulována pomocí androgenů přes androgenový receptor, který interaguje svou DNA vazebnou doménou s cílovou oblastí genu PSA, tzv. ARE (androgen response element) a reguluje tak jeho transkripci.
V řízení exprese a aktivity samotného AR hrají významnou roli různé epigenetické modifikace. Jednou z důležitých epigenetických modifikací je acetylace, která může mít vliv na jeho transkripční aktivitu AR a jeho schopnost regulovat růst prostatických nádorových buněk. Pokud je acetylace AR aberantní může to vést k nadměrnému růstu buněk. Pro zvýšení úrovně acetylace je možné využít chemoterapeutické látky patřící do skupiny inhibitorů histonových deacetyláz (HDACIs). Tyto látky mají schopnost modifikovat expresi různých genů, inhibovat buněčný růst, indukovat diferenciaci buněk a/nebo indukovat apoptózu transformovaných buněk in vitro i in vivo. HDACIs ovlivňují kromě transkripce také replikaci a opravu poškozené DNA. Butyrát sodný, který patří do skupiny HDACIs, je přirozeně se vyskytující netoxická látka, která může ovlivnit acetylaci histonů a tím pozměnit i expresi velkého množství genů. NaB in vitro může inhibovat růst a podporovat apoptózu buněk různých lidských prostatických nádorových buněčných linií. Mechanismus řízení acetylace AR by tedy mohl být novým cílem pro výzkum terapie karcinomu prostaty.
Materiál a metody
V našem experimentu byly použity dvě nádorové
linie odvozené z nádorů prostaty. Prostatická nádorová linie LNCaP,
která je androgen-senzitivní a z ní odvozená prostatická nádorová
linie C4-2, která je androgen-nesenzitivní. U obou těchto linií je
exprimován funkční androgenový receptor.
Buňky prostatických nádorových linií byly
ovlivňovány inhibitorem histonových deacetyláz - butyrátem sodným
(NaB) o koncentracích 0,5 mM, 1 mM, 2,5 mM a/nebo 5 mM a inkubovány
po dobu 24 hodin nebo 48 hodin. Následně byl proveden MTT test pro
zjištění cytotoxicity NaB a stanovení viability buněk. Pro
posouzení změn v expresi AR a PSA pomocí kvantitativní analýzy
metodou real-time PCR byly buňky ovlivněny 1 mM a/nebo 5 mM
koncentrací NaB a inkubovány po dobu 24 hodin, 48 hodin nebo 48
hodin s výměnou média po 24 hodinách. Roztoky NaB byly připraveny
vždy rozpuštěním NaB v 10% roztoku dimethylsulfoxidu (DMSO). Buňky,
které sloužily v experimentech jako kontrola byly ovlivňovány 0,1%
roztokem DMSO.
Pro provedení MTT testu byly buňky nasazeny do
96-jamkových mikrotitračních destiček a kultivovány v médiu při
37°C a v 5% atmosféře CO2. Po adhezi buněk na dno bylo v
jamkách vyměněno médium za čerstvé s obsahem účinné látky (NaB) o
výše uvedených koncentracích nebo s obsahem 0,1% DMSO u kontroly.
Následovala inkubace buněk 24 nebo 48 hodin. Poté byl do každé
jamky přidán 3-[4,5-dimethylthiazol-2-yl]-2,5-difenyl tetrazolium
bromid (MTT). Výsledná absorbance změřená na spektrofotometru při
vlnové délce 570 nm přímo koreluje s počtem vitálních buněk.
Pro analýzu změny exprese AR a PSA byly buňky
nejprve kultivovány v médiu při 37°C a v 5% atmosféře
CO2 a po dosažení přibližně 60% konfluence byly
ovlivněny 0,1% DMSO, 1 mM a/nebo 5 mM NaB. Následovala inkubace
buněk po dobu 24 nebo 48 hodin, případně 48 hodin s výměnou média
obsahující účinnou látku. Z buněk byla poté izolována celková RNA
pomocí High Pure RNA Isolation Kitu (Roche) a reverzní transkripcí
pomocí Transcriptor First Strand cDNA Synthesis Kitu (Roche) byla
získána cDNA. Tato cDNA byla použita pro kvantitativní real-time
PCR s primery navrženými pro oblast 1. exonu AR a 1.exonu PSA, a se
specifickými TaqMan sondami. Výsledná změna exprese AR a PSA byla
vypočítána metodou ˄˄Ct.
Výsledky
Provedený MTT test ukázal, že NaB ovlivňuje
viabilitu buněk prostatických nádorových linií LNCaP a C4-2. U
linie LNCaP po 24-hodinové inkubaci s NaB došlo (při porovnání s
kontrolou) k mírnému snížení viability buněk zejména při použití
2,5 mM nebo 5 mM NaB. U téže linie po 48-hodinové inkubaci s NaB
došlo při použití 5 mM NaB k výraznějšímu snížení viability buněk,
a to přibližně o 20%. Avšak při použití 1 mM NaB byl u LNCaP
zjištěn mírný nárůst viability buněk. U druhé linie, C4-2, byl po
24-hodinové inkubaci s NaB zjištěn postupný pokles viability buněk,
a to tak, že s každým dalším navýšením koncentrace NaB byl pokles
viability buněk přibližně o 5% vyšší. Podobný trend v poklesu
viability buněk byl u této linie zaznamenán i po 48-hodinové
inkubaci s NaB. Zde však docházelo ke snižování viability buněk s
každým dalším navýšením koncentrace NaB přibližně o 10%. Mezi 2,5
mM a 5 mM NaB byl však pokles viability buněk téměř 30%.
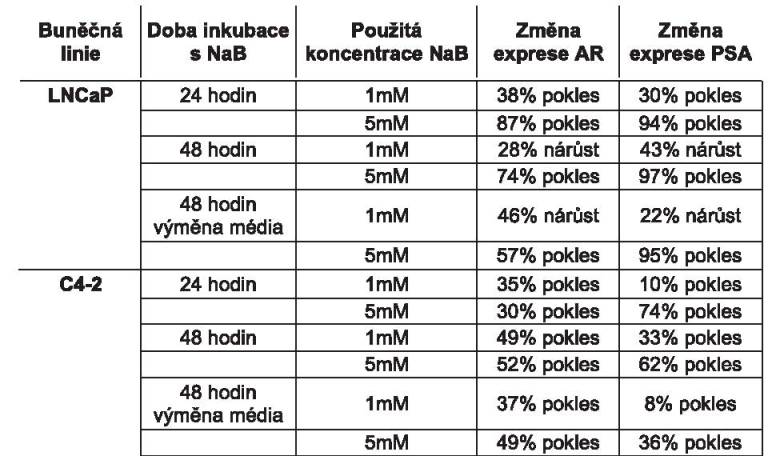
Kvantitativní analýza pomocí real-time PCR
ukázala, že NaB má vliv na změnu exprese AR i PSA, a to v různé
míře nejen v závislosti na použité koncentraci NaB, ale také v
závislosti na době inkubace s touto účinnou látkou. V následující
tabulce jsou uvedeny zjištěné změny v expresi AR a PSA při
porovnání s kontrolou.
Závěr
Pomocí MTT testu bylo potvrzeno, že NaB může v
určitých koncentracích a po různě dlouhé době působení více či méně
snižovat viabilitu prostatických nádorových buněk in vitro.
Kvantitativní real-time PCR analýza také potvrdila, že NaB má ve
většině případů vliv na snížení exprese AR i PSA.
Reference
- Rahman, M., Miyamoto, H. et Chang, Ch. (2004): Androgen
receptor coregulators in prostate cancer: Mechanisms and clinical
implications. Clinical Cancer Research (10), 2208-2219.
- Schuur, E. R., Henderson, G. A., Kmetec, L. A., Miller, J. D.,
Lamparski, H. G. et Henderson, D. R. (1996): Prostate-specific
antigen expression is regulated by an upstream enhancer. The
Journal of Biological Chemistry (271), 7043-7051.
- Leader, J. E., Wang, Ch., Fu, M. et Pestell, R. G. (2006):
Epigenetic regulation of nuclear steroid receptors. Biochemical
Pharmacology (72), 1589-1596.
- Minucci, S. et Pelicci, P. G. (2006): Histone deacetylase
inhibitors and the promise of epigenetic (and more) treatments for
cancer. Nature Reviews Cancer (6), 38-51.
- Johnstone, R.W. (2002): Histone-deacetylase inhibitors: Novel
drugs for the treatment of cancer. Nature Reviews Drug Discovery
(1), 287-299.
- Gu, J., Zhao, X., Spanjaard, R. A., Chen, T. C., Flanagan,
J.N., Boosalis, M., Perrine, S. P. et Faller, D.V. (2006): Histone
dea-cetylase-inhibitors sensitize human prostate cancer cell lines
to growth suppression and apoptosis by retinoids. Journal of Cancer
Molecules (2), 25-36.
- Maier, S., Reich, E., Martin, R., Bachem, M., Altug, V., Hautmann, R. E. et Gschwend, J. E. (2000): Tributyrin induces dif-ferentiation, growth arrest and apoptosis in androgen-sensitive and androgen-resistant human prostate cancer cell lines. International Journal of Cancer (88), 245-251.
Práce byla financována grantem IGA NS10262-3/2009 a podpořena z MSM 6198959216.
Datum přednesení příspěvku: 23. 4. 2010





