Konference: 2011 XXXV. Brněnské onkologické dny a XXV. Konference pro sestry a laboranty
Kategorie: Kasuistiky
Téma: Chemoterapie, biologická a hormonální terapie
Číslo abstraktu: 017
Autoři: doc. MUDr. Ilona Kocáková, Ph.D.; MUDr. Ivo Kocák, Ph.D.; MUDr. Iva Zichová; MUDr. Miloš Pacal; MUDr. Dagmar Adámková Krákorová, Ph.D.; prof. MUDr. Rostislav Vyzula, CSc.
Gastrointestinální stromální tumory (GIST) představují vzácné mesenchymální nádory charakteristické především silnou expresí tyrozinkinázového receptoru KIT (CD 117), který je pokládán za nejdůležitější imunohistochemický marker těchto nádorů. Přibližně 5-10 % GIST membránový protein c-kit neexprimuje, často je pak zachycena mutace v genu PDGFRA, který také kóduje příbuzný tyrozinkinázový receptor typu III. Jak vyplývá z názvu jde o neoplasie, které jsou nejčastěji lokalizovány v žaludku (40-70 %) a v tenkém střevě (20-40 %). Méně často postihují tlusté střevo, jícen, konečník. Jako „EGIST“ označujeme extragastrointestinální stromální tumory nacházející se v mesenteriu, omentu a retroperitoneu. Vzácně se objevují EGISTy v pankreatu, žlučníku a ve vagíně.
Metastatická choroba postihuje zejména játra, měkké břišní tkáně (omentum, peritoneum, retroperitoneum), méně často pánevní a nitrobřišní uzliny.
První efektivní léčbou lokálně pokročilého, inoperabilního nebo metastatického onemocnění je imatinib (Glivec). V MOÚ je používán od září 2003.
Dle SPC je Glivec indikován: k léčbě dospělých pacientů s pozitivními Kit (CD 117) inoperabilními a/nebo metastatickými maligními stromálními nádory zažívacího traktu (GIST); k adjuvantní léčbě dospělých pacientů s významným rizikem recidivy po resekci Kit (CD117)-pozitivního GIST nádoru, pacienti s nízkým nebo velmi nízkým rizikem recidivy by neměli tuto léčbu podstoupit.
Popis případu
Předkládáme kazuistiku mladé ženy, která byla odeslána ke konzultaci do MOÚ v březnu 2008 s rozsáhlou nádorovou infiltrací jater, retroperitonea, perigastrické oblasti a vícečetnými patologickými infiltráty na střevních kličkách v levém hypochondriu. Návštěvu konziliární ambulance předcházelo pět operačních revizí pro recidivující sarkom dutiny břišní a několik linií paliativní chemoterapie.
Poprvé se onemocnění manifestovalo u pacientky ve věku 26 let. Pod obrazem akutních bolesti břicha imitujících zánět slepého střeva byla v říjnu 2001 na extramurálním pracovišti provedena laparotomie, parciální resekce žaludku s exstirpací patologického infiltrátu z omenta velikosti 160x130x90 mm. Histologický nález včetně druhého čtení popisuje low grade hemangiosarkom M 9120/31. Následně byly indikovány 3 serie adjuvantní chemoterapie kombinací doxorubicin, ifosfamid, mesna, která byla ukončena v lednu 2002.
První relaps onemocnění vypukl v říjnu 2003. Byly extirpovány mnohočetná ložiska průměru až 40 mm z omenta a peroperačně provedena sutura ruptury cysty pravého ovaria, histologický nález byl překlasifikován na myofibrosarkom G I, c-kit negativní. Operace byla „zajištěna“ intraperitoneální aplikací cisplatiny.
Druhá recidiva v oblasti dutiny břišní nastala o dva roky později – v květnu 2005. Byla indikována operační revize s resekcí nádorových mas (bez udání velikosti) a intraperitoneální instilací cisplatiny. Histologicky byla opět popsána recidiva epiteloidního angiosarkomu dutiny břišní M 9120/31. Následovalo podání 9 cyklů chemoterapie – paklitaxel v třítýdenním podání. Léčba byla ukončena 24. 2. 2006.
Třetí recidiva onemocnění se manifestovala o 8 měsíců později, kdy v říjnu 2006 byl na CT vyšetření dokumentován patologický nález v oblasti retroperitonea. 21. 11. 2006 pacientka podstoupila exstirpaci patologické retroperitoneální lymphadenopathie. Histologicky je nález uzavřen jako angiosarkom M 9120/3, G I, KI 67 do 10 %, c-kit neg. Přechodně byly podávány COX II inhibitor + vitamín D jako pokus o antiangiogenní ovlivnění, pro palpitace však byla léčba záhy vysazena.
Čtvrtý relaps onemocnění propukl do roku. V říjnu 2007 byl na CT vyšetření patrný rozsáhlý nález na játrech, diseminace v dutině břišní, pánevní. V pořadí pátá operace byla provedena na chirurgickém pracovišti ve FN Bulovka. Jako již pátý chirurgický zákrok pro základní diagnózu pacientka podstoupila pravostrannou adnextomii, exstirpaci recidivy v oblasti malé pánve velikosti 100 mm. Nález na játrech byl hodnocen jako inoperabilní, provedení HIPEC pro riziko fatálního krvácení nebylo indikováno. Nález byl histologicky uzavřen jako low grade c-kit negativní GIST.
V rámci stagingu byla provedena následující vyšetření
CT vyšetření
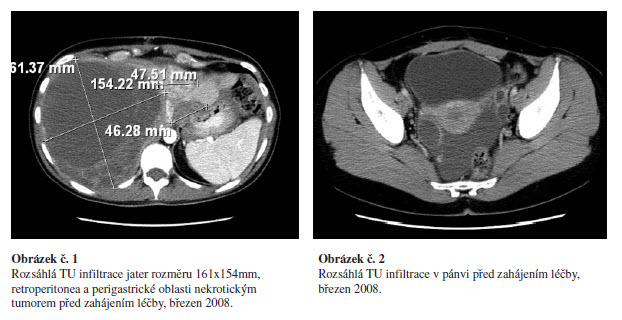
Rozsáhlá TU infiltrace jater, RP a perigastrické oblasti nekrotickým tumorem. V játrech ložisko v pravém laloku cca 16 cm v průměru, žaludek obalen tumorozní infiltrací zejména při malé kurvatuře a subfrenicky vlevo, v retroperitoneu četné patologické uzliny do 2 cm. Další patologický infiltrát na střevních kličkách v levém hypochondriu a v pánvi. obrázek č. 1,2.
Rtg plic
Bez patologického nálezu.
PET scan
FDG PET scan neprokazuje žádná ložiska se zvýšeným metabolismem glukozy, která by svědčila pro přítomnost viabilní nádorové tkáně.
Vyžádáno druhé histologické čtení a molekulární analýza mutací v genech KIT a PDGFR
Mikroskopický nález
V biopsiích primárního tumoru i ve všech recidivách je obdobný morfologický obraz solidní, monomorfní neoplasie z převážně epiteloidních buněk s eosinofilní a vakuolizovanou cytoplasmou, místy s distinktními buněčnými membránami. Jádra jsou uniformní, bez hyperchromázie a bez vizualizace nukleolů. V rozsahu nádorových infiltrátů je bohatá kapilární síť a místy hemoragie. Nekrózy nejsou přítomny. Primární tumor infiltruje svalovinu žaludku a tukovou tkáň omenta, v recidivách je přítomna infiltrace tukové tkáně. Invazi na serózu nelze jednoznačně posoudit. Resekční okraje nejsou zachyceny. Mitotická aktivita max. 2mit/50HPF. Nádorové buňky difuzně exprimují vimentin. Fokálně je pozitivní CD34 (20 % buněk) a SMA a MSA (15 % buněk). Další markery jsou negativní – desmin, S-100, CKAE, EMA, CD99, CK8/18, CD31. c-kit je negativní.
Závěr
V souhlase s prvním čtením hodnoceno jako recidivující gastrointestinální stromální tumor, c-kit negativní. Vzhledem k velikosti primárního tumoru (160 mm) se i při nízké mitotické aktivitě (2mit/50HPF) jedná o tumor s vysokým rizikem agresivního chování. Dodatečně na specializovaném pracovišti byla metodou jednokolové PCR a následné přímé sekvenace detekována mutace v exonu 12 genu PDGFRA. V ostatních vyšetřených exonech nebyla detekována žádná mutace.
Léčba a výsledky
Výkonnostní stav 34 leté pacientky s recidivujícím c-kit negativním GISTem je 80%. Poslední dny ji trápí prakticky trvalé kolísavě intenzivní bolesti břicha s propagací do zad, někdy i do pravého ramene. Bolesti, vyžadují nasazení analgetické medikace, jsou výrazně horší v noci, vleže. I přes značný rozsah onemocnění jsou laboratorní parametry v normě. Vzhledem k histologické povaze onemocnění a průkaz mutace PDGFR i přes c-kit negativitu (viz doporučení SPC) byla indikována léčba imatinibem v dávce 400 mg/den. Jelikož lék nebyl vzhledem k indikačním omezením pacientce hrazen z prostředků veřejného zdravotního pojištění, byl imatinib (Glivec) poskytnut firmou Novartis. V průběhu terapie nebyly zaznamenány žádné abnormality v laboratorních parametrech, do 2 týdnů od zahájení terapie dochází k vymizení algického břišního syndromu. Léčba imatinibem, jak prokázala následná série provedených vyšetření, byla efektivní a to ve všech dokumentovaných metastatických lokalitách.
Kontrolní CT vyšetření
Po dvou měsících terapie je na CT vyšetření patrná výrazná regrese cystoidní expanze v játrech, regrese hypodensních infiltratů perigastricky i v levém hypochondriu. Je zřejmá rezidualní porce při malé křivině vysoko subfrenicky. Uzliny v RP stac. V pánvi cystoidní formace v oblasti levého ovaria.
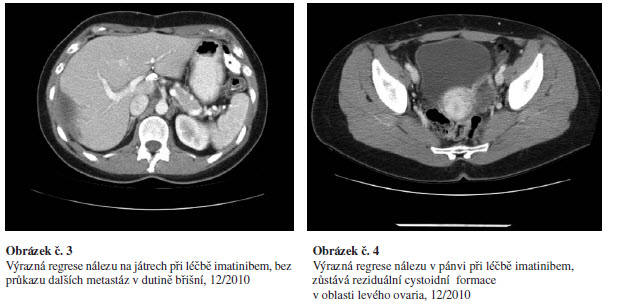
Pacientka je dále pravidelně sledován v tříměsíčních intervalech. Na sérii CT vyšetření (poslední z prosince 2010) dochází k postupné regresi nálezu ad normam, zůstává jen obraz stacionárního cystoidního ložiska jaterního a cystoidně zvětšeného levého ovaria – v.s. nekrotické metastázy, obrázek č. 3,4.
- V lednu 2010 byla pod UZ kontrolou provedena punkce jaterního
cystoidu. Cytologie popisuje oligocelulární materiál s přítomností
lymfocytů a erytrocytů, bez detekce nádorových elementů.
- V září 2010 pod UZ kontrolou provedena punkce cysty levého ovaria. Cytologie prokazuje v punktátu jen krevní elementy s dominancí erytrocytů. Bez nádorových buněk.
Závěr
Prognóza pacientů s inoperabilními a/nebo
metastatickými nádory GIST byla před zavedením imatinibu do
klinické praxe infaustní.
Námi prezentovaná pacientka podstoupila v
krátkém časovém horizontu několik operaci a několik linií
„neefektivní“ systémové chemoterapie. Nutno však podotknout, že do
září 2003 nebyla cílená biologická léčba pro pacienty s tumory GIST
v ČR dostupná.
Průkaz mutace PDGFRA se stal u naší nemocné
významným diagnostickým vyšetřením a důležitým článkem k rozvaze o
terapii. I při stanovení negativity c-kit by se při určení mutace v
exonu 12 genu PDGFRA měla pacientovi s GIST nabídnout léčba
imatinibem. Vzhledem k tomu, že zdravotní pojišťovna nehradí Glivec
při stanovené negativitě c-kit, je nutno o tuto léčbu individuálně
žádat.
Do MOÚ přišla pacientka v 3/2008 se značně
lokálně pokročilým onemocněním a s algickým břišním syndromem. Bylo
prokázáno multiorgánové metastatické postižení.
Léčba imatinibem vedla k navození výrazné remise nádoru v oblasti
břicha dle CT vyšetření. Dva perzistující cystoidy mohou
představovat nekrotické, aviabilní MTS. V průběhu terapie došlo k
vymizení symptomů nemoci a výraznému zlepšení klinického stavu
pacientky, která je zaměstnána na plný pracovní úvazek jako
rehabilitační pracovnice. Pacientka je léčena imatinibem od 3/2008
dosud, tj. 33 měsíců bez progrese onemocnění, což je zcela unikátní
terapeutický výsledek v porovnání s ostatními metastatickými
sarkomy.
Literatura:
- Gastrointestinal stromal tumours: ESMO Clinical Recommendations for diagnosis, treatment and follow-up. P. G. Casali1, L. Jost, P. Reichardt, M. Schlemmer & J.-Y. Blay On behalf of the ESMO Guidelines Working Group*Annals of Oncology 20 (Supplement 4): iv64–iv67, 2009
- Clinical implications of mutational analysis in gastrointestinal stromal tumours. A Hoeben1, P Schoffski1 and M Debiec-Rychter,2 British Journal of Cancer (2008) 98, 684-688
- Aktuální pohled na léčbu GIST. Farmakoterapie, speciální příloha. Ročník 6, říjen 2010.
Datum přednesení příspěvku: 21. 4. 2011





