Konference: 2011 XXXV. Brněnské onkologické dny a XXV. Konference pro sestry a laboranty
Kategorie: Gastrointestinální nádory
Téma: Onkochirurgie
Číslo abstraktu: 097
Autoři: MUDr. Roman Svatoň; MUDr. Mgr. Petr Kysela, Ph.D.; prof. MUDr. Zdeněk Kala, CSc.; Doc.MUDr. Igor Penka, CSc.; MUDr. Jan Hlavsa; MUDr. Jaroslav Ivičic; MUDr. Filip Marek
Gastrointestinální stromální tumory (GIST) jsou vzácné neepitelové nádory zažívacího traktu. Řadí se mezi sarkomy, nádory vycházející z pojivové tkáně. Tvoří asi 2-5% nádorů gastrointestinálního traktu (GIT). Lokalizovány mohou být kdekoliv v průběhu GIT. Nejčastěji v žaludku (60-70%) a tenkém střevě (20-25%), v menším počtu v konečníku (5%), jícnu (5%) a tlustém střevě (2%). Jako extragastrointestinální stromální tumory (EGISIT) jsou poté označovány tumory lokalizované mimo trávicí trubici do mezenteria, omenta, retroperitonea, pankreatu, žlučníku, močového měchýře, prostaty či vaginy. Incidence EGIST je o mnoho nižší a s jejich lokalizací jsou spojeny nespecifické příznaky a tudíž pozdní diagnostika. Za prekurzor vzniku těchto tumorů je považovaná progenitorní kmenová buňka diferencující se směrem ke Cajalovým intersticiálním buňkám (ICC). Jedná se o nádory potenciálně maligní a doposud není známo kritérium, které by maligní potenciál vylučovalo. Negativní prognostické faktory jsou velikost tumoru a mitotická aktivita. Nádory metastazují predilekčně do jater, peritonea, mezenteria nebo omenta. Vzácné jsou metastázy do lymfatických uzlin, plic, skeletu, vaječníků nebo prsu. Nádory se projevují zejména abdominální bolestí, dyspepsií a krvácením do GIT s anemizací. V diagnostice se uplatňuje CT a PET vyšetření. Léčba je primárně chirurgická v kombinaci s biologickou terapií inhibitory tyrozinkinásových receptorů.
Historie
GIST byl zpočátku označován jako leiomyom, bizardní leiomyom, leiomyoblastom nebo leiomyosarkom a řazen mezi leiomyocelulární nádory. V roce 1983 byl Mazurem a Clarkem GIST vyčleněn jako samostatná jednotka pod názvem ‘stromální tumor’. Tento termín zahrnoval mesenchymální tumory trávicího traktu nevykazující známky neurogenní ani hladkosvalové diferenciace. Zpřesnění v diagnostice přinesl rok 1998, kdy byla u nádorových buněk prokázána imunohistochemická pozitivita KIT proteinu (CD117) a jejich podobnost s interstitiálními (pacemakerovými) Cajalovými buňkami (ICC). Na objev KIT proteinu navázal ve stejném roce průkaz aktivačních (‘gain of function’) mutací genu KIT v gastrointestinálním stromálním tumoru. V dalších letech se tedy termín ‘GIST’ vymezil pro tumory, které kromě obvyklých morfologických znaků vykazovaly pozitivitu v imunohistochemickém průkazu KIT (CD 117).
Přesto zde zůstává malá skupina morfologicky přesvědčivých nádorů, která ale nevykazuje expresi KIT proteinů (KIT – negativní GIST), i když u nich byla prokázána mutace aktivačních genů KIT. U těchto nádorů je prokazována další mutace s možností onkogeneze v stromální tumor – mutace v genu pro PDGRFA.
Epidemiologie
Gastrointestinální stromální tumory (GISTy) představují pouze 1-3% nádorů žaludku, zhruba 20% nádorů tenkého střeva a méně než 1% nádorů tlustého střeva a konečníku. Incidence se pohybuje v rozmezí 0,31-1,45 případů na 100 000 obyvatel. Nejčastěji je diagnostikovaný u pacientů věku 66-69 let. V naší populaci je poměrné zastoupení ve výskytu pro muže a ženy 54,7% vs. 45,3%. Až 77% tumorů je diagnostikovaných jako symptomatických: 67,1% bolesti břicha, 34,3% anemie, 33,3% střevní krvácení. Průměrná doba přežití se dle světových údajů pohybuje v rozmezí 40,8-130,8 měsíce s 5ti letým přežitím 53,9-74,7%. V naší populaci se medián přežití pohybuje kolem 93,2 měsíce, 5ti leté přežití je ve všech rizikových stupních 78,3%, u velmi vysokého rizika poté 71,9%, u pacientů s nízkým a velmi nízkým rizikem 91,9%. Reálný výskyt GISTů je ale pravděpodobně daleko častější. Při sledovaní resekátů žaludku odebraných pro diagnózu karcinomu byla přítomnost mikroskopických GISTomů až 35%.
Histologie
Makroskopicky se jedná o tumory dobře ohraničené s pseudokapsulou, ze které někdy do nádoru vybíhají septa a rozdělují ho na pseudolobuly. Jsou elastické konzistence, na řezu bělavé či šedé barvy. Přítomné mohou být i sekundární změny jako nekróza, ulcerace, prokrvácení či kalcifikace. Již konvenční světelná mikroskopie s užitím základního barvení umožňuje s poměrně vysokou specificitou určit diagnózu gastrointestinálního stromálního tumoru. Klasické histologické dělení je na nádory vřetenobuněčného a epiteloidního typu. Jako zlatý standard k potvrzení diagnózy GISTu je užíván průkaz exprese receptorové tyrosinkynázy CD117 (KIT). Negativita tohoto proteinu však tuto diagnózu nevylučuje a je až 5%. Protein CD117 bývá prokazován také i u některých lézí spadajících do diferenciální diagnózy GISTu (angiosarkom, Ewingův sarkom, seminom, malobuněčný plicní karcinom). U GISTomů je dále imunohistochemicky vyšetřována exprese řada jiných proteinů: PDGFRA (platelet-derived growth factor receptor α), CD34, Thy-1 (CD90), DOG1 (discovered on GIST-1, PKC-θ (proteinkináza C – theta) Hladkosvalové markery, Neurální markery, S100 protein.
Prognostické a prediktivní factory
Každý GIST je nutno považovat za potenciálně maligní tumor, resp. zatím není známo kritérium, které by vylučovalo možnost maligního chování. V roce 2001 byla stanovena morfologická kritéria, na jejichž základě se stanovuje riziko agresivního chování gastrointestinálního stromálního tumoru. Zohledňuje se přitom velikost nádoru a mitotický index – tj. počet patologických mitóz na 50 zorních polí při 40ti násobném zvětšení. Nicméně, v roce 2006 byla navržena nová kritéria zohledňující odlišné chování stromálních nádorů žaludku a tenkého střeva.
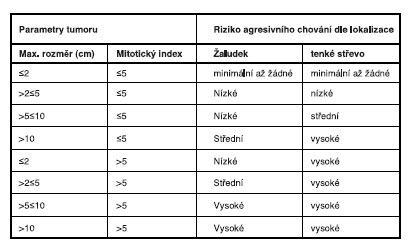
Z prediktivního hlediska lze na základě mutační analýzy KIT a PDGFRA rozdělit GISTy na tumory s regulačním typem mutace (KIT exon 11, PDGFRA exon 12) a tumory a enzymatickým typem mutace (KIT exon 17 a PDGFRA exon 18). V odpovědi na terapii imatinib mesylátem jsou poté tumory s regulačním typem mutace považovány za tumory responzivní, zatímco nádory s enzymatickým typem mutace za tumory primárně rezistentní. V klinických studiích se četnost dosažení parciální remise u GISTů s mutací v exonu 11 KIT pohybovala mezi 69 a 83,5%, zatímco u pacientů s mutací v exonu 9 téhož genu mezi 34 a 47,8%. Bohužel u mnoha pacientů s primární odpovědí na terapii imatinibem dochází ke vzniku sekundární rezistence.
Klinika
Klinický obraz koreluje s lokalizací a velikostí tumoru. Akutní příznaky: krvácení do dutiny břišní nebo GIT, perforační příhoda, obstrukce. Chronické příznaky: neurčité bolesti břicha, dysfagie, anemizace. Incidentální nález: Poměrně velká část GISTů je nalezena náhodně peroperačně nebo při endoskopickém či RTG vyšetření pro jinou základní diagnózu.
Diagnostika
V diagnostice GISTů je užívána řada zobrazovacích a endoskopických metod, anamnézu a klinické vyšetření při tom neopomínaje. Za standard je v současnosti považováno vyšetření pomocí CT a FDG (fluro-deoxy-glucose) PET/CT. Pokud CT hodnotí anatomickou charakteristiku nádoru, FDG PET jeho funkční charakteristiku. Dokáže diferencovat aktivní tumor od nekrózy, inaktivní jizevnaté tkáně či potencionálně maligní tumor, u kterého je vyšší metabolická aktivita a tudíž vysycování FDG. V rámci zvýšení senzitivity onemocnění je poté možné fúzní vyšetření PET/CT. Toto je užitečné zejména u pacientů s dobrou odpovědí na imatinib, u nichž může přetrvávat v CT zobrazení měsíce či roky tumorózní masa, která ale v PET zobrazení již nevykazuje aktivitu.
Terapie a dispenzarizace
Za jedinou potenciálně kurabilní léčebnou metodu je považována RO resekce t.j do mikroskopicky a makroskopicky tumor negativní tkáně. K chirurgickému řešení je indikován každý symptomatický nebo GIST větší 2cm. U nádorů incidentálních s velikostí do 2 cm zůstává management kontroverzní. Je možné využít laparotomický, laparoskopicky asistovaný nebo plně laparoskopický přístup. Vzhledem k vzácnému metastazování do uzlin není radikální lymfadenektomie vyžadována. V případě velkých a technicky obtížně resekabilních tumorů je doporučována neoadjuvantní terapie imatinibem v délce 6-12 měsíců resp. do maximální odpovědi. V případě R1 či R2 resekce je také vhodná adjuvantní terapie imatinibem. Zatím není dostatek důkazů týkajících se případné reexcize. V případě metastatického postižení jater je možná metastatektomie nebo využití RFA, kryoablace, nebo embolizace.
Terapie farmakologická: Konvenční cytotoxická chemoterapie je v léčbě GISTů neúčinná s odpovědí pouze 0-5%. Medián přežití u pacientů s konvenční terapií je 14-18 měsíců. Jednoznačný přínos byl zaznamenán u biologické terapie. Jde o skupinu léků inhibujících tyrozinkynázové receptory: Imatinib mesylat a Sunitinib malate. Dispenzarizace: restaging po roce terapie pomocí CT, PET/CT.
Naše výsledky
V průběhu let 2006-2010 bylo na naší klinice operováno 29 pacientů s diagnózou gastrointestinální stromální tumor. Celkem 20 (69%) mužů a 9 (31%) žen s průměrným věkem 60 let (max. 79, min. 23).
21 (72%) tumorů bylo lokalizováno v žaludku, 5 (17%) v tenkém střevě, dva (7%) v jícnu a jeden v gastrokolickém ligamentu. Průměrná velikost tumorů byla 54 mm. Největší tumor dosahoval 140 mm a vyrůstal ze zadní stěny žaludku. 7% nádorů vykazovalo velmi nízké, 62% nízké, 20% střední a 11% vysoké riziko agresivního chování.
U všech pacientů byla provedena R0 resekce. Totální gastrektomie 2x, resekce žaludku typu BII 3x, HPDE 1x, klínovitá resekce/excize poté ve zbylých případech. U jednoho pacienta byla operace provedena akutně z důvodu obstrukčního ileu jejuna. Průměrná doba hospitalizace byla 9 dnů. Mortalita v našem souboru dosáhla 14% (Dindo gr.II 3x, Dindo gr.IIIa 1x). Jednalo se převážně o interní komplikace: 1x fibrilace síní, 1x dekompenzace hypertenze, 1x bronchopneumonie. V jednom případě to byla dehiscence operační rány. 30ti denní pooperační morbitida byla nulová. U žádného pacienta nebyla doposud diagnostikovaná recidiva onemocnění.
Závěr
Gastrointestinální stromální tumory jsou vzácné mezenchymové nádory. V žádném případě je nelze považovat za tumory benigní. Mohou dosahovat gigantických rozměrů a také metastazují. Jedinou možnou kurabilní metodou je chirurgická R 0 resekce. Pokud je provedena včasná intervence, lze dosáhnout příznivých výsledků s minimální mortalitou a morbiditou, co dokazují také výsledky našeho pracoviště.
Literatura:
- Miettinen M, Lasota J: Gastrointestinal stromal tumors--definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch. (2001) 438(1):1-12.
- Jvora J.:Extragastrointenstinální stromální tumor – diagnostická úslalí v kazuistice. Rozhl. Chir., 2010, roč. 89, č. 5, s. 317-319
- Mazur MT, Clark HB: Gastric stromal tumors. Reappraisal of histogenesis. Am. J. Surg. Pathol. (1983) 7(6):507-519.
- Sarlomo-Rikalam, Kovatich AJ, Barusevicius A, Miettinen M: CD117: a sensitive marker for gastrointestinal stromal tumors that is more specific than CD34. Mod. Pathol. (1998) 11(8):728-734.
- Sircar K, Hewlett BR, Huizinga JD et al.: Interstitial cells of
Cajal as precursors of gastrointestinal stromal tumors. Am.
J.
Surg. Pathol. (1999) 23(4):377-389. - Nilsson B, Bumming P, Meis-Kindblom JM, et al. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era—a populationbased study in western Sweden. Cancer 2005;103:821–829.
- Brabec, P., Šufliarsky, J., Linke, Z., Plank, L., Mrhalová, M.,
Pavlík, T., Klimeš, D., Gregor, J. A whole population study of
gastrointestinal stromal tumors in the Czech Republic and Slovakia.
Neoplasma 2009;56(5):459-464.
- Kawanowa K, Sakuma Y, Sakurai S, et al. High incidence of
microscopic gastrointestinal stromal tumors in the stomach.
Hum
Pathol 2006;37:1527–1535. - Longley BJ, Reguera MJ, MA Y: Classes of c-KIT activating
mutations: proposed mechanisms of action and implications for
disease classification and therapy. Leuk. Res. (2001)
25(7):571-576.
- Heinrich MC, Corless CL, Demetri GD et al.: Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J. Clin. Oncol. (2003) 21(23):4342-4349
- Fletcher C, Berman J, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol2002;33: 459–465.
- Novitsky YW, Kercher KW, Sing RF, et al. Long-term outcomes of laparoscopic resection of gastric gastrointestinal stromal tumors. Ann Surg 2006;243:738–745; discussion 745–747.
- Fong Y, Coit DG, Woodruff JM, et al. Lymph node metastasis from soft tissue sarcoma in adults. Analysis of data from a prospective diabase of 1772 sarcoma patients. Ann Surg 1993;217:72–77.
- Andtbacka RH, Ng CS, Scaife CL, et al. Surgical resection of gastrointestinal stromal tumors after treatment with imatinib. AnnSurg Oncol 2007;14:14–24.
- Rutkowski P, Nowecki Z, Nyckowski P, et al. Surgical treatment of patients with initially inoperable and/or metastatic gastrointestinal stromal tumors (GIST) during therapy with imatinib mesylate. J Surg Oncol 2006;93:304–311
- Maluccio MA, Covey AM, Schubert J, et al. Treatment of metastatic sarcoma to the liver with bland embolization. Cancer 2006;107:1617–1623.
- Kobayashi K, Gupta S, Trent JC, et al. Hepatic artery chemoembolization for 110 gastrointestinal stromal tumors: response, survival, and prognostic factors. Cancer 2006;107:2833–2841
- Ryan DP, Puchalski T, Supko JG, et al. A phase II and
pharmacokinetic study of ecteinascidin 743 in patients with
gastrointestinal stromal tumors. Oncologist
2002;7:531–538.
- Edmonson JH, Marks RS, Buckner JC, et al. Contrast of responseto dacarbazine, mitomycin, doxorubicin, and cisplatin (DMAP) plus GM-CSF between patients with advanced malignant gastrointestinal stromal tumors and patients with other advanced leiomyosarcomas. Cancer Invest 2002;20:605–612.
Datum přednesení příspěvku: 22. 4. 2011





