Konference: 2009 XXXIII. Brněnské onkologické dny a XXIII. Konference pro sestry a laboranty
Kategorie: Gastrointestinální nádory
Téma: VIII. Biologická léčba nádorů
Číslo abstraktu: 081
Autoři: MUDr. Petr Karásek, Ph.D.; MUDr. Martin Šafanda, PhD.
Tarceva (erlotinib) byla registrována v kombinaci s gemcitabinem pro léčbu nemocných s metastazujícím karcinomem slinivky břišní v roce 2006 a byla po dlouhém období deseti let vůbec prvním lékem, který přinesl úspěch v prodloužení přežití těchto nemocných.
V naší práci hodnotíme své první vlastní zkušenosti s touto novou léčebnou modalitou.
Statistické metody
Použité statistické metody respektovaly cíl
vyhodnocení: deskriptivní analýzu sledovaného souboru pacientů. Pro
všechny spojité parametry byly vypočteny základní deskriptivní
statistiky (n, průměr, SD, medián, minimum a maximum), pro
kategoriální data byly stanoveny absolutní a relativní četnosti.
Data doby do progrese onemocnění a celkového přežití byla hodnocena
standardní metodou analýzy přežití, s využitím Kaplan-Meierovy
metody. Pro srovnání přežití mezi skupinami pacientů byl použit
logrank test.
Výsledky
Charakteristika souboru
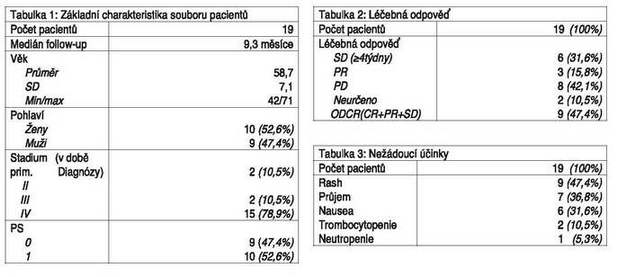
Hodnocený soubor zahrnoval 19 pacientů s
karcinomem pankreatu, léčených na dvou pracovištích: 10 (52,6%) MOÚ
a 9 (47,4%) Nemocnice Na Homolce. Pacienti byli léčeni kombinací
gemcitabin a Tarceva (erlotinib) v rámci léčby I. linie pro
metastazující onemocnění.
Střední doba sledování pacientů (medián
follow-up od data primární diagnózy do úmrtí nebo posledního
kontaktu s pacientem) byla 9,3 měsíce.
Průměrný věk pacientů v době zahájení léčby byl
58,7 let (min/max:42/71; SD=7,1), 10 (52,6%) pacientů byly ženy. V
čase primární diagnózy bylo 15 (78,9%) pacientů klinického stadia
IV, 2 (10,5%) stadia III a 2 (10,5%) stadia II. Pacienti stadia II
a III podstoupili radikální operaci a léčba s kombinací gemcitabin
a Tarceva byla zahájena po zjištění metastáz. Performance status
před zahájením léčby byl u 10 (52,6%) pacientů PS=1 a u 9 (47,4%)
PS=0. Před zahájením léčby s kombinací gemcitabin + Tarceva
předcházela operace u 13 (68,4%) pacientů, adjuvantní chemoterapie
u 4 (21,1%) a radioterapie u 2 (10,5%) pacientů. Ze symptomů se
vyskytoval obstrukční ikterus u 5 (26,3%) pacientů, abdominální
bolest u 12 (63,2%) pacientů, váhový úbytek (více jak 10% za
poslední 3 měsíce) u 13 (68,4%) pacientů. U 17 (89,5%) pacientů
byla provedena histologická verifikace karcinomu slinivky břišní, u
2 (10,5%) pouze cytologická. Onemocnění bylo lokalizováno v hlavě
pankreatu u 14 (73,7%) případů, v těle nebo ocase u 5 (26,3%)
pacientů. Vrůstání nádoru do duodena bylo zjištěno u 7 (36,8%)
pacientů. Diabetes mellitus byl přítomen u 8 (42,1%) pacientů.
Hodnocení účinnosti léčby
Medián doby zahájení léčby s kombinací
gemcitabin a Tarceva od data primární diagnózy u stadia IV byl 30
dnů a u stadií II. a III. byl 14,6 měsíce, střední délka trvání
léčby byla 2,5 měsíce, k datu zpracování souboru léčba u dvou
pacientů stále pokračovala.
Nejlepší dosažená odpověď po léčbě byla PD u 8
(42,1%) pacientů, SD> 4 týdny u 6 (31,6%) a PR u 3 (15,8%)
pacientů, u dvou pacientů nebylo možno léčebnou odpověď stanovit.
Celková kontrola nemoci ODCR (tedy CR+PR+SD) bylo dosaženo u celkem
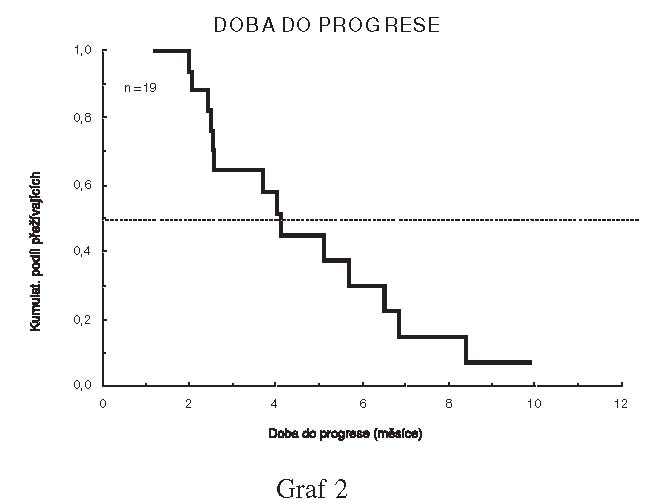
9 (47,4%) pacientů. Medián doby do progrese onemocnění od data
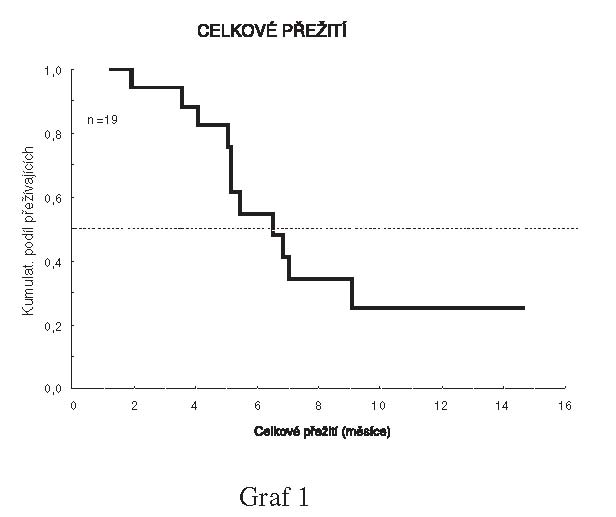
zahájení léčby byl 4,0 měsíců a medián celkového přežití od data
zahájení léčby 6,2 měsíců.
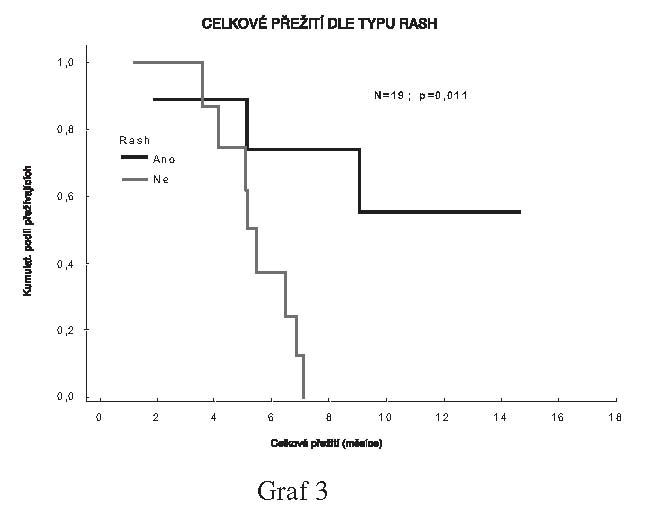
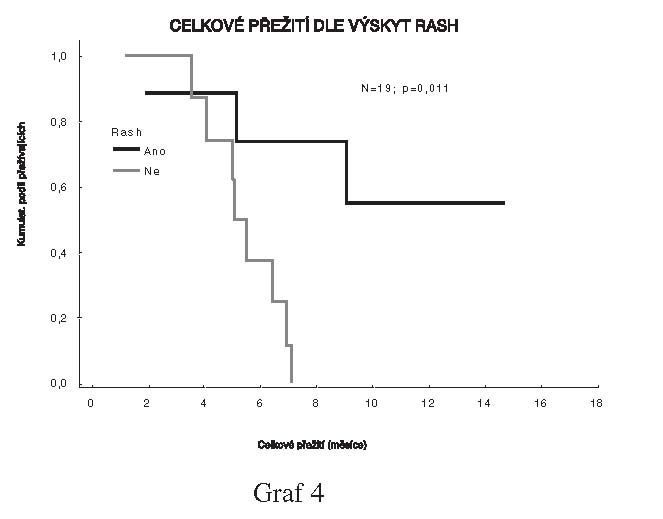
Byly zjištěny rozdíly v celkovém přežití i době
do progrese mezi skupinami pacientů podle výskytu rash, kdy výskyt
rash znamenal lepší prognózu (N=19; p=0.011 pro celkové přežití a
N=19; p=0.012 pro dobu do progrese.
Hodnocení bezpečnosti léčby
Alespoň jeden nežádoucí účinek v příčinné
souvislosti s léčbou se vyskytl u celkem 12 (63,2%) pacientů.
Převládal rash u 9 (47,4%) pacientů, průjem u 7 (36,8%) pacientů,
nausea u 6 (31,6%), trombocytopenie u 2 (10,5%) a neutropenie u 1
(5,3%). V případě rash převládal nejvyšší stupeň 1 (7 pacientů),
stupeň 2 (2 pacienti). Ze sedmi případů průjmů se v 5 případech
jednalo o nejvýše stupeň 1, ve 2 případech o stupeň 2. Nausea byla
ve 3 případech stupně 1, a shodně v jednom případě stupně 2 a 3, v
jednom případě neurčeno. Trombocytopenie byla v obou případech
stupně 1, jedna zjištěná neutropenie stupně 4.
Závěr
Dle našich zkušeností můžeme potvrdit, že
přidání Tarcevy ke gemcitabinu nezhoršuje kvalitu života takto
léčených nemocných. Léčebné výsledky našeho souboru korelují s
výsledky klinické studie PA.3, na základě jejichž výsledků byla
Tarceva Evropským úřadem pro registraci léčiv (EMEA) schválena pro
použití v léčbě nemocných s metastatickým karcinomem pankreatu.
Rovněž i na takto malém souboru je celkové přežití i doba do
progrese statisticky významně vyšší u pacientů s výskytem kožní
vyrážky.
Datum přednesení příspěvku: 16. 4. 2009





