Konference: 2010 15. ročník odborného sympózia na téma Onkologie v gynekologii a mammologii
Kategorie: Zhoubné gynekologické nádory
Téma: Tělo děložní
Číslo abstraktu: 034
Autoři: MUDr. Josef Chovanec, Ph.D.; doc. MUDr. Luboš Minář, Ph.D.; MUDr. Zuzana Dostálová, Ph.D.
Sarkomy měkkých tkání, mezi které náleží i zhoubné mezenchymální
a smíšené nádory dělohy, jsou poměrně vzácnou skupinou nádorových
onemocnění, tvořící cca 2% všech malignit. V průběhu posledních 50
let však dochází k mírnému nárůstu incidence těchto malignit u obou
pohlaví. Jedná se o značně heterogenní skupinu nádorů, která má
původ v mezenchymální tkáni. Současný stav incidence sarkomů a
smíšených zhoubných nádorů dělohy ve srovnání s jinými
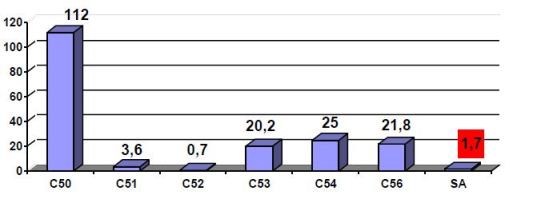
gynekologickými malignitami popisuje tabulka č.1.
Tabulka 1: Incidence – vybrané diagnózy, ženy,
Česká republika, 2006.
Tyto raritní tumory, tvořící zhruba 2–5% všech malignit dělohy,
jsou většinou biologicky velmi agresivní. Celkové pětileté přežití
bez ohledu na stádium se pohybuje kolem 42%. Mezi hlavní rizikové
faktory patří věk (40–60 let), absolvování radioterapie a
dlouhodobější užívání tamoxifenu u pacientek s karcinomem prsu. K
hlavním klinickým příznakům náleží vaginální krvácení, zapáchající
výtok, příznaky z útlaku orgánů v malé pánvi a protruze tumoru z
hrdla cervikálního kanálu. Jedná se v drtivé většině o příznaky
pozdní. Naopak často udávaný klinický příznak – rychle rostoucí
myom či zvětšující se děloha – ne vždy musí souviset s diagnózou
sarkomu dělohy.
Rovněž mezenchymální zhoubné tumory dělohy mají svoji klasifikaci
dle FIGO (tab. č.2), podle kterých můžeme alespoň orientačně určit,
zda se jedná o rané či pokročilé stádium.
Tabulka 2: FIGO klasifikace sarkomů
| Figo stádium | |
| IA | Tumor zasahuje endometrium |
| IB | Invaze do myometria (do 50%) |
| IC | Invaze do myometria (nad 50%) |
| IIA | Endocervikální glandulární invaze |
| IIB | Cervix – invaze do stromatu |
| IIIA | Invaze do serózy / postižení adnex / pozitivní laváž |
| IIIB | Metastázy poševní |
| IIIC | Metastázy do pánevních / paraaortálních uzlin |
| IVA | Invaze do sliznice moč.měchýře / rekta |
| IVB | Vzdálené metastázy včetně inguinálních uzlin |
Z hlediska histologické skladby dělíme sarkomy dělohy do několika
základních skupin:
- Smíšené mulleriánské tumory – karcinosarkomy – (45-50%)
- Leiomysarkomy – (30%)
- Endometriální stromální sarkomy – (15%)
- Jiné (nediferencované sarkomy a adenosarkomy)
Prognóza nemoci u karcinosarkomu, který obsahuje
složku epiteliální a mezenchymální, je závislá především od
biologického chování epiteliální složky (serozní, clear cell
karcinom). Dalšími prognostickými faktory jsou, kromě FIGO stádia,
přítomnost lymfangioinvaze, primární lokalizace tumoru v hrdle
děložním, metastázy v lymfatických uzlinách a reziduální nález po
chirurgické intervenci. I ve stadiu I a II se vyskytuje až 50%
recidiv, celkové pětileté přežití u karcinosarkomu se pohybuje mezi
20-30%.
Zásadní modalitou léčby je chirurgický výkon (explorativní
laparotomie: laváž, random biopsie, hysterektomie s bilaterální
adnexetomií, pánevní a paraaortální lymfadenektomie a
omentektomie). Hlavním cílem je snaha o kompletní
odstranění tumoru. Adjuvantní radioterapie bývá
aplikována k prevenci lokoregionálních metastáz. Chemoterapeutické
režimy jsou postaveny na kombinaci antracyklinů s ifosfamidem,
event. na platinových derivátech v kombinaci s taxany. Probíhají
studie s vysoko dávkovaným ifosfamidem (10g/m2) v
kombinaci s doxorubicinem. Tyto režimy si vyžadují pro svoji
toxicitu preventivní podání růstových faktorů. Na druhé straně se
však ukázaly jako efektivní léčba u pokročilých a metastatických
gynekologických sarkomů. Do úvahy přichází i paliativní režimy v
monoterapii (doxorubicin).
Mezi hlavní prognostické faktory u leiomysarkomů
patří velikost tumoru, přítomnost nekróz, vysoký mitotický index,
přítomnost vaskulární invaze a samozřejmě dostatečný lem zdravé
tkáně po chirurgickém výkonu. Rovněž histologická skladba
jednotlivých podtypů ovlivňuje prognózu. Vysoce agresivní jsou
myxoidní leiomyosarkomy, naopak tzv. STUMP tumory (smooth muscle
tumors of uncertain malignanat potential) mají riziko recidivy
nízké. Obecně mají leiomyosarkomy nevýraznou symptomatologii a jsou
často diagnostikovány peroperačně nebo na základě definitivní
histologie pooperační. Základní modalitou je opět chirurgická
léčba. V chemoterapii se používají obdobné kombinace jako u
karcinosarkomů. Standardním chemoterapeutickým režimem je kombinace
ifosfamidu s antracykliny. Velmi slibný efekt přináší kombinace
gemcitabinu s docetexelem, léčebné odpovědi je dosahováno až ve 45%
a její délka se pohybuje mezi 6 až 18 měsíci. Novou možností léčby
pacientek s neresekabilním nebo metastazujícím leiomyosarkomem je
použití nového cytostatika - trabectidinu (probíhá multicentrická
klinická studie fáze II) 1,5 mg/m2 i.v. v 21 denních
intervalech.Toto cytostatikum působí na úrovni genové
transkripce.
Endometriální stromální sarkomy (ESS) se
nejčastěji vyskytují v premenopauze. Základní dělení těchto nádorů
je možno provést na ‚high‘ a ‚low grade‘ tumory. Již toto rozdělení
výrazně ovlivní pětileté přežití. U low grade tumorů se pohybuje
kolem 60%, naopak u high grade nádorů dosahuje pouze 25%. Navržené
základní dělení výrazně ovlivňuje chirurgickou léčbu. Hysterektomie
s bilaterální adnexektomií bez lymfadenektomie je postačující pro
low grade ESS. Odstranění vaječníků je důležité, neboť velká část
těchto nádorů vykazuje receptorovou pozitivitu. U high grade ESS
doplňujeme výkon o lymfadenektomii.
U nediferencovaných sarkomů je chirurgický výkon
stejný jako u karcinosarkomů. Rovněž adjuvantní léčba chemoterapií.
Kromě standardních režimů mohou být použity i režimy obsahující
více než dvě cytostatika – např. chemoterapeutické schéma DECAV
(doxorubicin, dacarbazin, vindesin, cisplatina a ifosfamid), které
je však velmi toxické a není proto vhodné k rutinní aplikaci.
Ve stávající chirurgické léčbě existuje několik kontroverzí.
- Ponechání ovarií u premenopauzálních žen – vaječníky neodstraňujeme u low grade ESS ve stadiu I a u leiomyosarkomy, u všech ostatních nálezů by měla být provedena bilaterální ooforektomie.
- Diagnóza stanovena na základě definitivní histologie po neúplné operaci - je vhodné provádět relaparotomii s cílem doplnit lymfadenektomii? U karcinosarkomů pravděpodobně ano, u leiomyosarkomů, ESS pravděpodobně ne.
Odpověď sarkomů na chemoterapii je bohužel výrazně limitovaná a
radioterapie, která sice snižuje výskyt lokálních recidiv,
neprodlužuje celkovou dobu přežití. Možnou alternativou adjuvantní
terapie je cílená biologická léčba. Slibné
výsledky přináší imatinib (Glivec), inhibitor tyrozinkináz. V
současnosti probíhá I. fáze klinické studie hodnotící účinnost
perorálního angiokinázového inhibitoru VEGF (vascular endothelial
growth factor) a FGFR (fibroblast growth factor receptors) s
pracovním názvem BIBF 1120, v dávce 100, 150, 200 nebo 250 mg 2x
denně kontinuálně, v kombinaci s paclitaxelem (175
mg/m2) a carboplatinou (AUC 5) každé 3 týdny.
Vzhledem k tomu, že jde o řídce se vyskytující tumory, je obtížné
stanovit standardy léčby. Rozhodující význam má chirurgický výkon.
Cílem je optimální ‚debulking operation‘. Role lymfadenektomie je
pevně určena u karcinosarkomů a nediferencovaných adenosarkomů.
Zatím neexistuje exaktní chirurgický standard, nemáme k dispozici
rozsáhlé randomizované studie týkající se role lymfadenektomie u
ESS, provádění omentektomie u pacientek se sarkomy dělohy a
bilaterální adnexektomie u pacientek s leiomyosarkomy.
U pokročilých onemocnění nebo u neresekovatelných nádorových lézí
je základní modalitou léčba systémová (antracykliny a/nebo
ifosfamid). Radioterapie je alternativou pro adjuvatní léčbu po
chirurgickém výkonu a paliativní léčbu u pokročilého nebo
metastatického onemocnění. Jedná se tedy o léčbu multimodální,
která má být plánována multidisciplinárním týmem, kde kromě
onkogynekologa, patologa, radioterapeuta a klinického onkologa bude
v budoucnu potřeba účast i molekulárního biologa. Nová klasifikace
těchto nádorů bude určitě zahrnovat i molekulárně patogenetické
požadavky.
Publikováno s podporou vědecko-výzkumného záměru MOU č.:
MZ0MOU2005
Datum přednesení příspěvku: 9. 1. 2010





