Konference: 2004 XXVIII. Brněnské onkologické dny a XVIII. Konference pro sestry a laboranty
Kategorie: Kolorektální karcinom
Téma: Kolorektální karcinom
Číslo abstraktu: 106
Autoři: Doc. MUDr. Luboš Holubec (jr.), Ph.D., MBA; Prof. MUDr. Ondřej Topolčan, CSc.; prof. MUDr. Jindřich Fínek, Ph.D.; MUDr. Sabina Svobodová; doc.MUDr. Ludmila Lipská, Ph.D.; M. Matoulek; Š. Svačina
Thymidinkináza (TK) je důležitý enzym v metabolismu nukleových kyselin a je proto považována za významný marker buněčné proliferace (1,2). Rozhodli jsme se proto sledovat dynamiku thymidinkinázy v průběhu adjuvantní a paliativní chemoterapie u pacientů s kolorektálním karcinomem.
Materiál a Metodika
Thymidinkináza byla sledována u 30 nemocných s diagnózou karcinomu tlustého střeva a rekta a léčených chemoterapií na Oddělení onkologie a radioterapie Fakultní nemocnice Plzeň . Thymidikináza byla stanovována radioreceptorovou analýzou (Immunotech Praha). Podmínkou zařazení do studie bylo, že thymidinkináza byla sledována vždy před zahájením cyklu chemoterapie a po jejím skončení a to u 3 cyklů adjuvantní či paliativní chemoterapie. Hodnoty TK byly korelovány s klinickým průběhem onemocnění a s typem terapie.
Tabulka 1: Základní charakteristika souboru pacientů

Výsledky
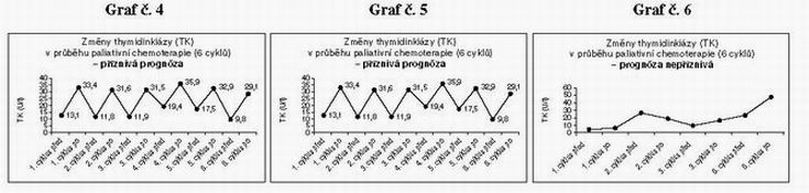
Základní charakteristika souboru nemocných je uvedena v tabulce č.1. V následujících grafech jsou uvedeny jednotlivé hodnoty u všech 30 nemocných před a po jednotlivých cyklech. Z grafu č. 1–3 vyplývá, že ve většině případů byly hodnoty na začátku 1. cyklu nízké a výrazně stoupaly po skončení 1. cyklu chemoterapie. Do následujícího cyklu hodnoty opět klesly. Obdobnou dynamiku jsme zaznamenaly po druhém a třetím cyklu chemoterapie. Na základě těchto dynamických změn proto byly hodnoty thymidinkinázy korelovány s typem chemoterapie (adjuvantní, paliativní) a klinickým průběhem onemocnění. V následujících 3 grafech jsou jsou uvedeny příklady typických změn hodnot TK před a po adjuvantní chemoterapii (graf č.4 ) a paliativní chemoterapii (graf č. 5,6 ).
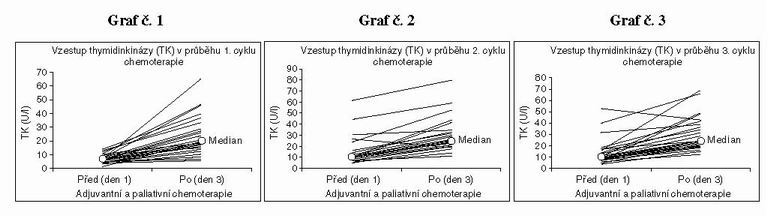
U adjuvantní chemoterapie byly hodnoty thymidinkinázy při zahájení každého cyklu terapie nízké a po skončení terapie vždy vysoké. (viz graf č. 4) U paliativní chemoterapie byla dynamika hodnot TK různá. Obecně lze konstatovat, že pokud se dynamika TK u paliativní chemoterapie podobala typické dynamice adjuvantní terapie, zaznamenali jsme u pacientů příznivou odpověď na léčbu. Pokud zůstávaly hodnoty trvale vysoké, či dokonce vzrůstaly, nebyla zaznamenána terapeutická odpověď. (viz graf č.5,6)
Současně s thymidinkinázou jsme u nemocných sledovali i další nádorové markery (CEA, CA 19-9, TPA, TPS). Tato sledování nejsou součástí tohoto sdělení, ale v souhlase s literaturou jsme prokázali, že při adjuvantní i paliativní chemoterapii vykazují tyto markery na rozdíl od TK poměrně malou variabilitu.
Diskuze
Na základě našich výsledků a údajů z literatury je zřejmé, že thymidinkináza je použitelná pro pro sledování průběhu a efektu chemoterapeutické léčby (3,4). Zdá se, že je jediným markerem, který lze použít u adjuvantní terapie, vzhledem k tomu, že u těchto nemocných jsou ostatní nádorové markery, včetně cytokeratininů, v mezích normy a vykazují minimální variabilitu. U paliativní léčby sice ke změnám ostatních nádorových markerů dochází, ale dynamika změn je podstatně pomalejší a méně signifikantní, než změny thymidinkinázy. Z těchto důvodů většina autorů sledování nádorových markerů pro monitoraci terapie nedoporučuje (5,6). Pokud jsou údaje o vztahu nádorových markerů k efektu terapie, jde o hodnocení hladin markerů získaných nejméně tři měsíce po skončení terapie. (7) Taková sledování umožň ují hodnocení konečného efektu chemoterapie, ale nehodí se pro individualizaci a optimalizaci terapie (8). Thymidinkinázu lze k tomuto účelu použít především proto, že má krátký biologický poločas a účastní se při syntéze DNA (9,12). U nádorů kolon a rekta souvisí přítomnost thymidinkinázy a thymidilát syntetázy přímo s etiopatogenezí nádoru a je diskutována i otázka využití thymidinkinázy v léčbě (10,11). Naším dlouhodobým cílem je vypracovat systém optimalizace a individualizace terapie pomocí sledování změn biologické aktivity nádorového procesu.
Literatura
- Kralovanszky J, Koves I, Orosz Z, Katona C, Toth K, Rahoty P,
Czegledi F, Kovacs T, Budai B, Hullan L, Jeney A. Prognostic
significance of the thymidylate biosynthetic enzymes in human
colorectal tumors. Oncology 62(2):167-74, 2002. 2
- Wu J, Mao Y, He L, Wang N, Wu C, He Q, Skog S. A new cell
proliferating marker: cytosolic thymidine kinase as compared to
proliferating cell nuclear antigen in patients with colorectal
carcinoma. Anticancer Res 20(6C):4815-20, 2000.
- O’Neill KL, Buckwalter MR, Murray BK. Thymidine kinase:
diagnostic and prognostic potential. 7: Expert Rev Mol Diagn:
1(4):428-33, 2001. - Bidart JM, Thuillier F, Augereau CH et al. Kinetics of Serum
Tumor Marker Concentrations and Usefulness in Clinical Monitoring.
Clinical Chemistry 45 (10): 1695-1707, 1999.
- Bast, RC., Bates,S., Bredt,AB., et al.: Clinical practice
guidelines for the use of tunor markers in breast and colorectal
cancer. J Clin Oncol 14, 1996, s.2843-2877.
- De Vita, VT., Vincent, T., Hellman, S., Rosenberg, A.: Cancer
of the Colon. In: Cancer: Principles Practise of Oncology.
Lippincott – Raven Publishers 1997, s. 1144-1182.
- European Group on Tumor Markers: Consensus Recommendations.
Anticancer Research 19: 2785-2820, 1999.
- Lothar,T.: Tumormarker. In: Labor und Diagnose. Frankfurt am
Main: TH Books: 976-979, 1998.
- Akbay A, Demirtas S, Yavuz Y. Increased serum thymidine kinase
following chemotherapy. Ann Clin Biochem 36 (6):771-
773, 1999. - Thomas WM, Robertson JF, McKenna PG, O’Neill KL, Robinson MH,
Hardcastle JD. Serum thymidine kinase in colorectal neoplasia. Eur
J Surg Oncol. 21(6):632-4, 1995.
- Fujii R, Seshimo A, Kameoka S. Relationships between the
expression of thymidylate synthase, dihydropyrimidine
dehydrogenase, and orotate phosphoribosyltransferase and cell
proliferative activity and 5-fluorouracil sensitivity in colorectal
carcinoma. Int J Clin Oncol. 8(2):72-8, 2003.
- Tanigawa N, Katoh Y, Fujii H, Shimomatsuya T, Aotake T, Yamakawa M. Prediction of prognosis of patients with gastrointestinal cancer based on thymidine uptake. Gan To Kagaku Ryoho. 21(3):388-94, 1994.
Práce byla podpořena grantem IGA MZ ČR NB/46635-3 a výzkumným záměrem
Datum přednesení příspěvku: 26. 5. 2004





