Konference: 2010 XXXIV. Brněnské onkologické dny a XXIV. Konference pro sestry a laboranty
Kategorie: Genitourinární nádory
Téma: Pokroky v biologii nádorů
Číslo abstraktu: 089
Autoři: doc., RNDr. Michal Masařík, Ph.D.; MUDr. Jaromír Gumulec, Ph.D.; Š. Kuchtíčková; MUDr. Arne Rovný; MUDr. Roman Hrabec; prof. MUDr. Tomáš Eckschlager, CSc.; doc.Ing. René Kizek, Ph.D.
Klíčová slova: těžké kovy,
thiolové sloučeniny, karcinom prostaty, nádorové markery,
thioneiny
Úvod
Metalothioneiny (MT) patří do skupiny intracelulárních,
nízkomolekulárních na cystein velmi bohatých proteinů o molekulové
hmotnosti od 6-10 kDa (Obr. 1) (Hamer; Klaassen et al.). Díky své
vysoké afinitě k těžkým kovům (Zn, Cd, As, atd.) je jejich hlavní
funkcí homeostatická kontrola a detoxikace těchto těžkých kovů.
Lidské MT patří do I. třídy metalothioneinu a jsou kódovány rodinou
genů vytvářejících 10 isoforem. Vzniklé proteiny jsou rozděleny do
čtyř skupin: MT-1, MT-2, MT-3 a MT-4. MT-1 protein existuje ve více
isoformách, respektive MT-1 protein vytváří více subtypů kódovaných
sadou MT-1 genů (MT-1A, MT-1B, MT-1E, MT-1F, MT-1G, MT-1X).
V organismu dospělých jedinců jsou nejvíce zastoupeny dvě isoformy
MT (MT-1a, MT-2a), které se exprimují ve většině lidských tkání, v
mozkové tkáni je přítomna pouze isoforma MT-3 (někdy označována
jako růstový inhibiční faktor - GIF). MT-1 a MT-2 isoformy jsou
obvykle exprimovány v lidském organismu ve velmi nízkých
koncentracích. Jejich exprese výrazně stoupá při indukci mnoha
exogenními a endogenními faktory jako jsou UV záření, těžké kovy,
stresové hormony, volné kyslíkové radikály a cytokiny uvolňující se
z poškozené tkáně či xenobiotika. Molekulární mechanismus exprese
MT je prozatím znám velmi málo, ale pravděpodobně se ho účastní
samotný kov vazbou na specifický transkripční faktor, protein
označený jako metal transription factor 1 (MTF-1). Komplex
kov-MTF-1 pak v jádře nasedá na metal-responsive element (MRE) v
promotorové oblasti MT-genu a spouští jeho transkripci. Na syntéze
MT se mohou podílet další regulační proteiny prostřednictvím
responsivních elementů jako je glucocorticoid response element
(GRE), interferon response element (IRE), signal transducers and
activator protein (STAT) nebo antioxidant response element (ARE),
dále vazebné receptory spojené s tvorbou druhých poslů či aktivací
běžných transkripčních faktorů. Jednotlivé isoformy metalothioneinů
se pak podílejí na metabolismu detoxikace a homeostázy těžkých
kovů, účastní se ochrany organismu před vzniklými volnými
kyslíkovými radikály a podporují regeneraci poškozené tkáně. MT je
významný přenašeč iontů kovů v organismech. Nejčastěji váže Zn, ale
velkou afinitu má i k Cu, čímž udržuje homeostatickou hladinu
těchto kovů v organismu. Při výskytu toxických kovů v organismu je
metalothionein schopen je navázat a přenést na místo detoxikace, s
největší pravděpodobností do ledvin. Tímto mechanismem je tělo
schopno se bránit proti iontům Cd, Hg, Pb a dalších těžkých kovů.
MT má také významnou antioxidatiční roli. Spolu s GSH vytváří
oxidačně redukční dvojici, která reguluje výskyt volných
kyslíkových radikálů. Napomáhá tak chránit nukleové kyseliny před
účinky ionizujícího záření, fosfolipidy membrán před oxidací a
zajišťuje pro buňku redukční prostředí. V posledních letech je
studována overexprese MT v souvislosti s nádorovými onemocněními
(Eckschlager et al.; Krizkova et al.; Pedersen et al.). Tato
overexprese je pozorována především u isoformy MT-1a a MT-2a ja
převážně spojena s maligními nádory a je studována jako nový
prognostický marker v progresi onemocnění, přežití pacientů,
korelací s histologickým typem nádoru a nádorovým gradingem.
Experimentální část
Materiál a metody
V této studii byly použity čtyři prostatické buněčné linie: (a)
PNT1A, buněčná linie odvozená z normálních lidských prostatických
epiteliálních buněk (HPA Culture Collections, Salisbury, UK); (b)
PC-3, buněčná linie odvozená ze 4. stupně adenokarcinomu prostaty
(HPA Culture Collections, Salisbury, UK); (c) 22RVL, lidská
nádorová epiteliální buněčná linie odvozená ze štěpu nádorové
tkáně, propagována u kastrovaných myší (HPA Culture Collections,
Salisbury, UK); (d) LNCaP, lidská nádorová epiteliální buněčná
linie odvozená z metastatického místa v levé supraklavikulární
lymfatické uzlině (ATCC, Manassas, VA, USA).
Lyzace buněk byla prováděna standardně pomocí RIPApufru s přídavkem
inhibitoru proteáz, nebo mechanickou homogenizací a tepelnou
denaturací.
Separace proteinů byla prováděna technikou SDS-PAGE na 12.5% gelech
ve vertikálním uspořádání (BioRad, Hercules CA, USA). Po separaci
byly proteiny přeneseny na nitrocelulózovou membránu western
blottingem (BioRad, Hercules CA, USA). Následná imunodetekce
probíhala s použitím monoklonální protilátky proti MT1a/2a (Abcam,
Cambridge, UK) a v případě detekce PSAmonoklonální protilátkou
anti-PSA (Santa Cruz Biotechnology, Santa Cruz, CA, USA).
Imunohistochemická detekce MT byla prováděna pomocí R.T.U
Vectastain universal ABC kit (Vector Laboratories, Burlingame, CA,
USA).
Elektrochemické stanovení bylo prováděno na přístroji 747 VA Stand
instrument ve spojení s 746 VA Trace Analyzer a 695 Autosampler
(Metrohm, Switzerland) nebo na AUTOLAB Analyzer (EcoChemie,
Netherlands) ve spojení s VA-Stand 663 (Metrohm, Switzerland) na
visící rtuťové kapkové elektrodě.
Výsledky a diskuse
V této studii byly použity prostatické buněčné linie odvozené od
karcinomu prostaty (LNCaP, PC-3, 22RVL) a dále prostatická buněčná
linie odvozená z normálního epitelu (PNT1A - jedná se o
imortalizovanou buněčnou linii prostatických epiteliálních buněk,
získaných z prostaty 35 letého muže post mortem). Kultivace všech
buněčných linií probíhala standardním způsobem v RPMI-1640 médiu s
10% FBS (LNCaP, 22RVL, PNT1A) nebo Ham´s F12 médiu se 7% FBS (PC-3)
a 1x Strep/Pen při 37°C a 5% CO2. Čas zdvojení (doubling
time) je v rozmezí 30-40 hodin. Jakmile buňky dosáhly konfluence
přibližně 80%, byly sklizeny a následně laboratorně zpracovány.
Buněčné linie byly pravidelně kontrolovány, mikroskopickým
počítáním buněk při rozsevu, dále vitalita buněk pomocí klasické
trypan-blue metody a pak MTT test (životnost) při ovlivňování
buněčných kultur zinečnatými ionty.
Pro separaci MT od ostatních proteinů byla použita standardní
SDS-PAGE s 12.5% gely. Koncentrace 12.5% nebyla zvolena náhodně,
ale byly zkoušeny různé koncentrace polyakrylamidu pro získání co
nejlepší separace. Z literatury je známo, že MT tvoří nejen
monomery (cca 6 kDa), ale i vícemery (12 - cca 40 kDa), což bylo z
gelů patrné. Vzhledem k tomu, že separace jednotlivých forem MT je
poněkud složitější, byla navržena technika imunoprecipitace pomocí
magnetických částic a následného imunochemického stanovení MT,
která je dále testována. Pro imunochemické stanovení bylo nutno
nejprve zvolit vhodnou protilátku pro detekci MT1A/2A. Byly
vyzkoušeny dvě protilátky - a) Mouse monoclonal [UC1MT] to
metallothionein (Abcam, UK; ab12228), b) Rabbit polyclonal to
metallothionein (Santa Cruz biotechnology, USA; sc-11377). Jako
vhodnější a specifičtější se testováním ukázala protilátka firmy
Abcam a s tou byly poté prováděny veškeré imunochemické
experimenty. Kromě stanovení MT byl imunochemicky stanovován i
prostatický specifický antigen (PSA), který je pro prostatickou
tkáň specifický a také beta-aktin, jako vnitřní kontrola. Při
těchto stanoveních jsme prokázali up-regulaci exprese PSA v
prostatických nádorových buňkách (LNCaP, PC-3, 22RVL), naopak
down-regulaci exprese MT.
Dále byla prováděna analýza MT in situ. Buňky byly napěstovány opět
do konfluence cca 80%, následně byly zafixovány ledovou směsí
MetOH/aceton 1:1 a dále zpracovány s barvícím ABC kitem a DAB+ jako
substrátem pro detekci MT s použitím výše uvedené protilátky. Z
výsledků (mikroskopické hodnocení buněk) je patrné, že exprese MT
je v případě nádorových buněk extrémně snížena oproti buněčné linii
PNT1A, která vychází z normální prostatické tkáně. Potvrdili jsme
tak výsledky získané při testování jednotlivých primárních
protilátek na buněčných lyzátech.
Elektrochemická detekce MT se provádí na plně automatickém
analyzátoru Metrohm ve spojení s mikrodávkovačem vzorku v klasickém
tříelektrodovém uspořádání pomocí tzv. Brdičkovy reakce. Právě
Rudolf Brdička před více než 70 lety objevil katalytické vylučování
vodíku ze základního elektrolytu v přítomnosti proteinů. Tato
metoda byla později vylepšena a využita pro analýzu proteinů
krevních sér pacientů s nádorovým onemocněním. Dlouho nebylo jasné,
které proteiny se této reakce účastní, ale později bylo zjištěno,
že jsou to právě látky obsahující -SH skupiny, mezi které patří i
MT (Adam et al.; Fabrik et al.; Kizek et al.).
Měření probíhá tak, že na pracovní elektrodu, kterou je visící
rtuťová elektroda dochází k akumulaci vzorku a stanovení probíhá v
základním elektrolytu, obsahujícím kobaltitou sůl v amonném pufru s
pH 9.6.
Nejprve bylo potřeba najít vhodné prostředí pro elektrochemickou
analýzu. Ukázalo se, že prostředí lyzačního RlPApufru není příliš
vhodné z důvodu přítomnosti povrchově aktivních látek, které
ovlivňují elektrochemickou detekci. Buněčnou suspenzi jsme proto
jen mechanicky dezintegrovali homogenizátorem a tepelně
denaturovali. Tak jak bylo řečeno výše, MT je termostabilní protein
a tepelnou denaturací se odstraní případné interferující
biomakromolekuly. Takový postup se nám osvědčil, proto jsme dále
pro elektrochemické stanovení postupovali tímto způsobem. Provedli
jsme několik experimentů a z měření vyplývá, že exprese MT je u
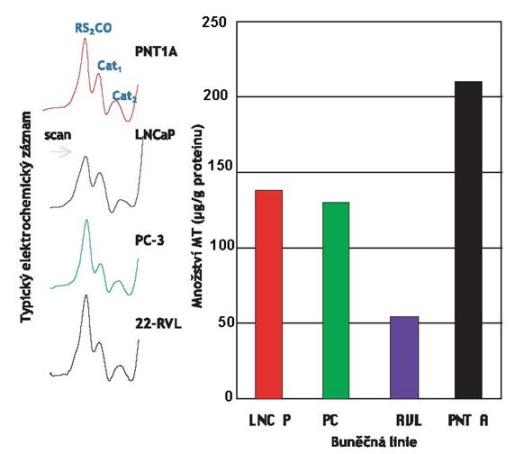
nádorových linií snížena oproti kontrolní buněčné linii. Na obr. 2
je ukázán jeden z výsledků - elektrochemické stanovení MT pomocí
Brdičkovy reakce a v grafu přepočet množství MT, vyjádřená v
jednotkách µg MT/g proteinu.
Závěr
Tato studie přináší nové důležité informace o expresi MT na
proteinové úrovni v prostatických nádorových buňkách. Z výsledků
imunohistochemických a elektrochemických analýz vyplývá, že exprese
MT je v nádorových prostatických buňkách down regulována oproti
normální prostatické buněčné linii. Tento efekt přisuzujeme rapidně
snížené koncentraci zinečnatých iontů, která je za normální situace
v prostatě relativně vysoká. Přesné vysvětlení tohoto jevu doposud
není známo (Costello et al.). Proto se v další experimentální práci
chceme zaměřit nejen na MT ale také na zinkové transportéry, které
v tomto procesu hrají důležitou roli.
PoděkováníPříspěvek vznikl za podpory GAČR
301/09/P436, IGA MZ10200-3/2009, GAAVIAA401990701
Literatura
- Adam, V., et al., (2008): Application of the Brdicka reaction in determination of metallothionein in patients with tumours. Chemicke Listy, 102: 51-58.
- Costello, L. C., et al., (2004): Role of zinc in the pathogenesis and treatment of prostate cancer: critical issues to resolve. Prostate Cancer and Prostatic Diseases, 7: 111-117.
- Eckschlager, T., et al., (2009): Metallothioneins and Cancer. Current Protein & Peptide Science, 10: 360-375.
- Fabrik, I., et al., (2008): Employment of Electrochemical Techniques for Metallothionein Determination in Tumor Cell Lines and Patients with a Tumor Disease. Electroanalysis, 20: 1521-1532.
- Hamer, D. H., (1986): METALLOTHIONEIN. Annual Review of Biochemistry, 55: 913-951.
- Kizek, R., et al., (2001): Determination of metallothionein at the femtomole level by constant current stripping chronopoten-tiometry. Analytical Chemistry, 73: 4801-4807.
- Klaassen, C. D., et al., (1999): Metallothionein: An intracellular protein to protect against cadmium toxicity. Annual Review of Pharmacology and Toxicology, 39: 267-294.
- Krizkova, S., et al., (2009): Using of chicken antibodies for metallothionein detection in human blood serum and cadmium-treated tumour cell lines after dot- and electroblotting Electrophoresis, 30: 3726-3735.
- Pedersen, M. O., et al., (2009): The role of metallothionein in oncogenesis and cancer prognosis. Progress in Histochemistry and Cytochemistry, 44: 29-64.
Datum přednesení příspěvku: 23. 4. 2010





