Autor je předsedou Akreditační komise Ministerstva zdravotnictví ČR pro radiační onkologii a členem Vědecké rady České lékařské společnosti.
S blížícím se zahájení provozu Protonového centra v Praze se v tisku objevují objektivní, ale bohužel i zavádějící informace o této nové technologii radioterapie. Myslím, že řada nepřesných informací, publikovaných v tisku, jde na úkor novinářského zjednodušení a zkreslení odborných informací, které v dobré víře poskytli odborníci zástupcům médií o popisované metodě léčby nádorů protonovými svazky.
Ihned v úvodu musím zdůraznit, že ozařování urychlenými protony patří mezi nejmodernější způsoby léčby zhoubných onemocnění ozařováním a možnost provedení této léčby v České republice je nutné hodnotit velice pozitivně. Už z historického pohledu naše země vždy stála v popředí výzkumu využití ionizujícího záření, a to nejen v lékařské praxi, a řada našich osobností se také nesmazatelně zapsala do jeho historie.
Historický pohled na radioterapii v českých zemích
Jako příklad lze uvést Ostrčilovu metodu ozařování karcinomu děložního hrdla, kterou ve 20-tých létech minulého století vyvinul prof. Antonín Ostrčil za svého působení na gynekologické klinice v Brně. Ve své době se jeho metoda stala učebnicovou metodou léčby nádoru hrdla děložního radioterapií. Z Brna také pochází teoretický fyzik světového významu Georg Placzek (1905-1955), který se na vedoucím místě zúčastnil amerického projektu Manhattan (vývoj atomové bomby) a spolu s Nielsem Bohrem, Enrico Fermim a Robertem Oppenheimerem se podílel na vývoji první atomové bomby a prvního atomového reaktoru. Jedním z bývalých prezidentů evropské radioterapeutické společnosti (ESTRO) byl prof. Michael Brada, původem Čech z Liberce, který od studií žije a pracuje v Londýně.
Současný stav radioterapie v ČR
Radiační onkologie zaznamenala v posledních desetiletích velmi rychlý rozvoj. Nové trendy jsou založeny na rozsáhlé digitalizaci a využití počítačů, zpřesnění možností diagnostiky a zavedení technologicky dokonalejších vysokoenergetických zdrojů ionizujícího záření do klinické praxe. Uvedené pokroky vyústily ve zmenšení a zpřesnění ozařovaných cílových objemů (zvýšení konformity), což umožnilo zvýšit léčebnou dávku záření při stejných nebo dokonce menších nežádoucích účincích léčby na okolní zdravé tkáně a orgány. V současnosti je považováno za standardní vybavení pracoviště radioterapie lineárními urychlovači, které léčí tzv. brzdným zářením („tvrdé“ Rentgenovo X-záření) a elektronovými svazky. Nyní je v České republice v provozu 44 lineárních urychlovačů (v počtu je zahrnut i X-nůž v Masarykově onkologickém ústavu), jeden robotický lineární urychlovač (Ostrava) a jeden gama-nůž (Praha). Tedy diametrálně odlišná situace v pozitivním smyslu při srovnání se situací konce minulého století.
Ve všech Komplexních onkologických centrech v České republice se provádí prostorové trojrozměrné (3D) plánovaní radioterapie a vysoce přesná technika radioterapie IMRT (radioterapie s modulovanou intenzitou), umožňující maximálně optimalizovat dávkovou distribuci. Vybraná pracoviště jsou schopna provádět IGRT techniku (obrazem řízenou radioterapii). Při metodě IGRT se pomocí 3D zobrazovacích metod (CT vyšetření) kontroluje poloha zdravých tkání a ozařovaných cílových objemů přímo na ozařovacím stole. Špičková centra v naší zemi pak provádí stereotaktickou radiochirurgii se systémy umožňující intra a extrakraniální (v mozkovně a mimo mozkovnu) výkony (např. Klinika radiační onkologie v Masarykově onkologickém ústavu, pracoviště CyberKnife na Klinice onkologické v Ostravě-Porubě), nebo radiochirurgii „jen“ v oblasti hlavy (gama-nůž v Praze – Nemocnice Na Homolce). Na obdobné úrovni jsou další centra, např. v Pardubicích, Hradci Králové a v Plzni. Nutno zdůraznit, že pokrok v radioterapii nedílně souvisí s vývojem zobrazovacích technologií (CT, 4DCT, PET/CT) a jejich začlenění do plánovacích algoritmů v radioterapii. Otevřením Protonového centra v Praze pokračuje dál modernizace a rozšiřování možností radioterapie v naší republice. V tomto duchu lze vnímat jeho otevření bezesporu kladně.
Protonová terapie v Evropě
V současnosti jsou protonová centra v provozu především v Německu, např. Mnichov, Essen, Darmstadt. Dále ve Švýcarsku (Villigen), Itálii (Catania), ve Francii (Orsay) a ve Švédsku (Uppsala). V Rusku se protonová terapie provádí v Moskvě, Petrohradě a v Dubnu. Protonová centra se však staví v Rakousku, Slovensku, Polsku a v Maďarsku.
Rozdíl fotonového a protonového ozařování
Při ozařování fotonovými svazky (gama záření radiokobaltu, X záření lineárních urychlovačů) jednoduchými ozařovacími technikami (jedno přímé nebo dvě protilehlá pole) se předává tkáním nejvíce energie v malých hloubkách pod povrchem těla. S rostoucí hloubkou dochází k exponenciálnímu poklesu dávky. Tuto nevýhodu kompenzují moderní přístroje ozařováním z více směrů (polí), při kterém dochází k superpozici a ke zvýšení dávky v cílové oblasti ložiska nádoru. Cílem kombinace více polí při 3D či 4D plánování je homogenní ozáření daného objemu se strmým poklesem dávky mimo cílový objem a tím šetření okolních zdravých tkání a orgánů. Např. při použití terapie kyvem (V-MAT, RapidArc), při kterém se technika modulovaného svazku záření (IMRT) provádí za současného pohybu ramene urychlovače, lze kombinovat ozáření po dobu celé rotace (360 st.) a dosáhnout výrazného snížení dávky v okolí ozařovaného ložiska. Při zvolení techniky ozařování s více poli se ale zvětší celkový ozářený objem nízkou dávkou (objemová, tzv. integrální dávka) mimo cílový objem (zpravidla oblast nádoru nebo pooperační oblast).
Při ozařování svazkem urychlených protonů má křivka jejich průchodu tkáněmi (Braggova křivka) zcela jiný tvar než fotony (Obr. 1). Při vstupu do tkáně rychlé protony způsobují jen nízkou ionizaci, neboť je jejich rychlost průchodu značně vysoká a předávají okolí jen málo své energie. Průchodem v tkáních ale klesá jejich rychlost a rostou ionizační účinky. Tak se protonům podaří v určité hloubce pod povrchem těla předat okolním atomům více energie (absorbovaná dávka), která ničí tkáň. Rozložení dávky v závislosti na hloubce má proto charakteristický tvar. Při průchodu rychlých protonů tkání je zpočátku absorbovaná dávka poměrně nízká a téměř konstantní, až do blízkosti konce doletu. U konce doletu absorbovaná dávka prudce vzrůstá, dosahuje maxima a pak následuje velmi strmý pokles dávky k nule. Největší část své energie urychlené protony předávají v úzké oblasti tzv. Braggova vrcholu, těsně před svým maximálním doletem. Dochází zde k nejhustší ionizaci a k největší radiační dávce. Do oblasti Braggova vrcholu se dostane zhruba 70 % energie protonů. Proto jsou tkáně ležící před tímto maximem, ozářeny výrazně menší dávkou (je zde předáno jen asi 30 % energie) a tkáně, ležící za tímto maximem, nedostanou téměř žádnou radiační dávku – protony tam vůbec nedoletí (Obr. 1). Při ozařování protony tedy není nutné kombinovat tolik polí jako u fotonové terapie a celkový ozářený objem malou dávkou je tedy významně menší. Zdrojem protonového svazku je urychlovač nabitých částic, nejčastěji synchrotron nebo cyklotron.
Obr. 1: Srovnání křivek průchodu jednotlivých druhů záření tkáněmi v závislosti na hloubce
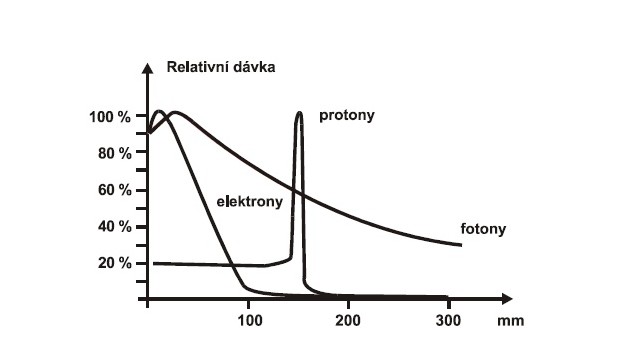
V protonové radioterapii se pro přesné ozařování cílového objemu používají podobné techniky jako v radioterapii brzdnými svazky – frakcionované ozařování (celková dávka záření je rozdělena do více, např. 20-ti menších denních dávek, frakcí) z více směrů s modulovanou intenzitou svazku (IMPT - intenzitou modulovaná protonová terapie, obdoba IMRT u svazků fotonových). Velkou výhodou protonové radioterapie je možnost přesného nastavení hloubky, v níž bude deponována maximální hodnota energie, ideálně přímo do nádorového ložiska. Při dané energii totiž doletí všechny protony do zhruba stejné hloubky v tkáni, kde se zbrzdí a předají maximum své energie a zničí tkáň. Integrální dávka protonového ozařování je sice nižší, ale diskutovanou zůstává otázka dávkového ekvivalentu „mimo pole“, neboť neutrony vzniklé (emitované) rozptýlenými protony jsou příčinou nechtěné další efektivní dávky, kterou obdrží pacient, a tato je mnohdy vyšší ve srovnání s klasickou fotonovou IMRT technikou .
Radiobiologie protonů
Protonová terapie, resp. ozařování urychlenými částicemi (protony a jiné ionty - uhlíkové, neonové, křemíkové, argonové), event. neutrony, alfa částicemi, má proti ozařování brzdnými svazky urychlovačů i radiobiologické výhody, především větší smrtící (letální) efekt s malým rozdílem pro různé buněčné kmeny. O to více je nutné přesně zaměřit protonový svazek na dané ložisko, neboť hrozí vyšší riziko poškození zdravých tkání v okolí než u ozařování fotony (urychlovače, radiokobalt). Účinek protonového záření na buňky nemá závislost na přítomnosti kyslíku v buňce, což je pro ozařování fotony značně zvyšujícím faktorem biologické účinnosti.
Použitím protonových svazků se zmenší celkový ozářený objem (integrální dávka) a tím se sníží riziko vzniku radiačně podmíněných sekundárních nádorů, nicméně toto riziko zcela nevymizí ani po protonové terapii. Sekundární tumory po ozařování se zpravidla objevují v časovém odstupu asi 5-15 let po aplikaci radioterapie.
Nevýhodou protonového ozařování je vznik sekundárních neutronů, s čímž souvisí zvýšená ochrana před zářením. Přístrojová náročnost a komplexnost celého systému si vyžadují vesměs náročnější údržbu, dozimetrii, úkony implementované v programu zabezpečení jakosti a bezpečnosti radioterapie. Toto je zcela určitě finančně, personálně a časově náročnější ve srovnání s pracovišti s fotonovou radioterapií.
Určité problémy se ukazují také ve výpočtu dávky, tzv. nehomogenity v cílových objemech. A samostatnou kapitolou může být také srovnání vstupních cen ozařovacích systémů a budov, která je u protonové terapie minimálně o řád vyšší než u fotonové. Ne-li o dva (nejsou dostupné údaje).
Pohled evropských odborníků
Letos v dubnovém čísle prestižního časopisu evropské radioterapeutické společnosti ESTRO, Radiotherapy and Oncology, vyšlo několik publikací, zabývající se problematikou protonové terapie. Zvláště přehledový článek předních evropských radioterapeutů (D. Ruysscher – Maastricht, M. Lodge, B. Jones – Oxford, M. Brada – Sutton, A. Munro – Dundee, T. Jefferson – Řím3) se snaží podat ucelený a objektivní pohled na využití léčby pomocí nabitých částic v klinické praxi. Autoři provedli nový systematický přehled literárních výsledků 5 let po jejich předchozí publikaci. Z textu souhrnné práce lze citovat následující názory a závěry – viz dále.
Více souhrnných prací provedených během poslední dekády zkoumající klinickou účinnost radioterapie s urychlenými částicemi ukazují, že nejsou stále k dispozici definitivní závěry. Částečně je to způsobeno nedostatkem kvalitních dat znemožňující adekvátní porovnání s jinými druhy radioterapie. Za posledních 5 let nebyla provedena žádná klinická studie 3. fáze a z mnoha retrospektivních a několika prospektivních studií není možné určit, zda protony jsou opravdu lepší než fotonová terapie. Navíc mnoho publikovaných klinických studií bylo provedeno v době, kdy nebyly dostupné současné radioterapeutické technologie, včetně nejnovějších zobrazovacích metod. Autoři souhrnu nemohou potvrdit, že terapie částicemi umožňuje eskalaci dávky záření vedoucí k vylepšení lokální kontroly tumoru a k prodloužení přežití bez zvýšení vedlejších účinků. Výhody protonové terapie jsou omezeny pouze na redukci dávky okolních orgánů. Kromě vzácných indikací, jako jsou dětské nádory, stále platí předchozí závěry autorů, tj. zisk z použití protonů v praxi zůstává kontroverzní, nejasný.
Fotonová terapie a zobrazovací techniky se během posledních 10 let významně zlepšily především se zvýšenou implementací moderních technik (IMRT, pohybová IMRT - terapie kyvem, stereotaktická radioterapie) do klinické praxe. Společně s vývojem zobrazovacích technik pro plánování (CT, MR, PET, 4DCT), využití zobrazovacích metod ke kontrole pozice v průběhu ozařování, vylepšené optimalizační algoritmy a kalkulace dávky brzdného záření dovolují aplikovat vysokou dávku do nádorového ložiska. Výsledky moderní techniky radioterapie s X zářením, např. u nemalobuněčného karcinomu plic, jsou srovnatelné nebo ještě lepší než u protonové terapie (s pasivním rozptylem). Nicméně při aplikaci X záření je vždy vyšší integrální dávka v celkově ozářeném objemu a tedy vyšší riziko vzniku sekundárních nádorů.
V závěru článku autoři doporučují podporu dalšího výzkumu protonové terapie v léčebných centrech k získání dostatku validních dat. Potřebné jsou především randomizované (srovnávací) studie 3. fáze. Výsledky těchto studií mohou zlomit začarovaný kruh diskuze kolem finanční efektivity této metody léčby. Za velmi důležité pokládají globální, kontinentální či národní řízení tohoto výzkumu a vzájemnou spolupráci mezi obhájci a odpůrci terapie urychlenými částicemi (to pokládají za Achillovu patu protonové terapie).
Názory americké radioterapie
Ve stejném čísle časopisu Radiotherapy and Oncology jsou publikována doporučení americké radioterapeutické společnosti ASTRO k protonové terapii (A.M Allen a ost.1). Novou technologii radioterapie pravidelně vyhodnocuje výbor ASTRO na základě publikovaných údajů. Od r. 2007 pracuje nad problematikou radioterapie urychlenými částicemi samostatná pracovní skupina.
Zveřejněná data ke konci r. 2009 však neposkytují dostatečné důkazy o výhodě protonové terapie v léčbě bronchogenních karcinomů, karcinomů hlavy a krku, zhoubných nádorů trávícího traktu, dětských malignit mimo nádory centrální nervové soustavy (CNS). V případě časných stadií bronchogenních nádorů (stadium I), které nebyly určeny k chirurgické léčbě, má protonová terapie stejné výsledky v lokální kontrole jako stereotaktická radiochirurgie lineárními urychlovači (80-90 % lokální kontrola). Při použití protonové terapie je však menší riziko ozáření druhostranné plíce.
U karcinomů prostaty a hepatocelulárního karcinomu jater jsou dostupná data o efektivitě protonové terapie, která nejsou lepší než radioterapie brzdnými svazky (X-záření), nicméně při ozařování protony jsou okolní zdravé tkáně méně ozářeny. Nutno dodat, že ročně je v USA zjištěno asi 217 000 nových případů karcinomu prostaty a publikované výsledky protonové terapie jsou založeny na vyhodnocení asi 2 000 pacientů. Některé práce uvádějí nižší riziko poškození trávícího traktu při použití fotonové IMRT techniky než u protonového ozařování (Sheets N.C. a ost., JAMA 2012)
V léčbě nádorů centrálního nervového systému (CNS) dětského věku se přepokládají lepší výsledky protonové terapie než při ozařování fotony, ale výsledky jsou předběžné, chybí data z klinických studií. V případě ozařování rhabdomyosarkomu v očnici u dětských pacientů je popsána 85 % lokální kontrola a zvýšené šetření druhostranné orbity a zrakových drah. Riziko vzniku sekundárních nádorů u dětí ozařovaných protonovými svazky se snižuje asi o polovinu, metaanalýza uvádí hodnotu rizika 6,4 %.
Zlepšené léčebné výsledky se ukazují v léčbě chordomů (až 80 % lokální kontrola) a očních melanomů (95 % lokální kontrola při 90 % zachování zraku) protonovými svazky. Srovnatelné výsledky s radiochirurgií fotonovými svazky byly publikovány v léčbě meningeomů.
Pro další zhodnocení radioterapie urychlenými částicemi chybí data z prospektivních a randomizovaných studií 3. fáze, nicméně předběžná data protonové terapie, zvl. moderními technikami, naznačují optimistický potenciál do budoucna.
Závěr
Protonová terapie, resp. radioterapie urychlenými částicemi, znamená významný technický pokrok v radioterapii zhoubných nádorů. Ve správných indikacích lze předpokládat snížení vedlejších účinků záření a u vybraných nádorů i zlepšení léčebných výsledků ve smyslu lokální kontroly a prodloužení přežití (chordomy, oční melanomy, dětské nádory centrální nervové soustavy). Srovnatelné výsledky s moderní léčbou X-zářením prokazuje protonová terapie v léčbě karcinomů prostaty, dále ve srovnání s radiochirurgií lineárními urychlovači v případě léčby nádorů plic časného stadia a meningeomů. Dále se protonová terapie používá v léčbě nádorů hlavy a krku, trávícího traktu a vyšších stadií karcinomu plic, v léčbě sarkomů. U těchto diagnóz jsou výsledky léčby zatím kontroverzní.
Bohužel, k statistickému vyhodnocení léčebné a ekonomické efektivity protonové terapie chybí validní data z randomizovaných (srovnávacích) studií 3. fáze. Jednoznačnou výhodou protonové terapie je snížení dávky záření mimo cílový objem, tedy snížení objemové (integrální) dávky. To může vést k snížení rizika vzniku sekundárních nádorů po léčbě zářením. Avšak ani protonová terapie nezabrání riziku pozdních následků v ozářeném objemu, a to i v případě dětských pacientů. Ozářením kraniospinální osy (mozkovna a míšní kanál) u dětí s meduloblastomem sníží riziko trvalého poškození srdce, plic a štítné žlázy, ale riziko růstových deformit u ozářených obratlů je obdobné jako při ozařování brzdným svazkem urychlovače, možná i vyšší.
Z radiobiologického hlediska je nutné si uvědomit vyšší biologickou účinnost protonového svazku na ozářené buňky, tedy i na zdravé buňky, a tím vyšší riziko poškození normálních tkání v okolí ozařovaného ložiska při nesprávném zacílení svazku. Obecně platí, že nové technologie je nutné do běžné praxe zavádět uvážlivě, aby nedošlo k nesprávnému ozáření pacientů. Stále platí pravidlo, že dobře zvládnuté „staré“ přístroje jsou bezpečnější než nesprávně použitá supermoderní technologie.
Otevřením Protonového centra v Praze se nám dostává unikátní možnost zařadit naše pacienty do výzkumu a zcela jistě se mohou uskutečnit i srovnávací studie pro vybrané diagnózy nebo pilotní projekty. Kontrolní skupinou ve studiích budou pacienti léčeni moderní fotonovou terapií v komplexních onkologických centrech. A vzhledem k absenci srovnávacích studií protonového ozařování a nejmodernější fotonové léčby, nabízí se velké možnosti spolupráce mezi odborníky Protonového centra a odborníky v radioterapeutických centrech.
Základem léčby zářením v České republice i po zprovoznění Protonového centra v Praze zůstanou lineární urychlovače především v Komplexních onkologických centrech. Tato centra disponují ověřenou technologií radioterapie na vysoké úrovni a vybraná centra poskytují špičkové způsoby radioterapie, které nelze nahradit ani protonovými svazky. Zcela určitě budou v onkologických centrech zůstávat v léčbě pacienti/tky s nádory prsu, konečníku, plic, kůže, hematologickými nádory aj., tedy s nejčastěji vyskytujícími se malignity.
Je na kompetentních orgánech státní správy a zdravotního pojištění, aby tuto situaci bralo v úvahu při rozdělování dotací a úhrady zdravotní péče, neboť drtivá většina pacientů bude i nadále léčena v onkologických centrech lineárními urychlovači. A zde je nutné připomenout, že i na těchto pracovištích bude nutností další modernizace ozařovacích a plánovacích systémů. Cena nových, špičkových urychlovačů je stále vysoká a nelze tedy snížit úhradu výkonů radioterapie urychlovači a jinými ozařovacími přístroji na úkor proplácení ozařování protonovými svazky.
Základní literatura
- Allen, AA., Pawlicki, T., Dong, L., Fourkal, E., Buyyounouski, M., et al. An evidence based review of proton beam therapy: The report of ASTROś emerging technology committe. Radiotherapy and Oncology, 103, 2012, pp. 8-11
- Hynková, L., Šlampa, P. a kol. Základy radiační onkologie. LF Masarykovy univerzity, Brno, 2012, v tisku
- Ruysscher, DD., Lodge, MM., Jones, B., Brada, M., Munro, A. et al. Charged particles in radiotherapy: A 5-years update of a systematic review. Radiotherapy and Oncology, 103, 2012, pp. 5-7
Obr. 1: Srovnání křivek průchodu jednotlivých druhů záření tkáněmi v závislosti na hloubce





