Konference: 2004 XXVIII. Brněnské onkologické dny a XVIII. Konference pro sestry a laboranty
Kategorie: Onkologická diagnostika
Téma: Molekulární a laboratorní diagnostika nádorů
Číslo abstraktu: 24
Autoři: prof. RNDr. Jana Šmardová, CSc.; Mgr. Šárka Pavlová, PhD; K. Kšicová; R. Ravčuková; S. Svitáková; Iva Kroupová
Většina mutací p53 se nachází v centrální DNA vazebné doméně a jejich důsledkem bývá ztráta schopnosti proteinu p53 vázat se na cílové nukleotidové sekvence. Původní představa o mutacích p53 jako „klasických“ recesivních, inaktivujících mutacích
(„loss-of-function“) typických pro nádorové supresory, se ale postupně vyvíjela v dnešní chápání velké rozmanitosti funkčních důsledků mutací p53. A tak byly u p53 například popsány mutace s dominantně-negativním efektem. U některých z nich se předpokládá, že protein vzniklý expresí mutantní alely tvoří s proteinem vzniklým expresí nepoškozené alely nefunkční nebo pouze částečně funkční heterotetramery, a tím částečně vyřazuje nepoškozenou alelu z funkce. Jiným možným mechanismem účinku dominantně negativních mutantů p53 je jejich schopnost „vychytávání“ kofaktorů nezbytných k aktivitě funkčních variant p53. Další skupinu mutantů p53 tvoří mutanti se ziskem funkce („gain-of-function“), tj. mutanti, kteří získávají další funkce, které přispívají k maligní transformaci. Tato funkce není zprostředkována mechanismem transaktivace, ale spíše mechanismem protein-proteinových interakcí, například s proteiny p63, p73 či topoizomerázou I. Další stále se rozrůstající skupinou mutací p53 jsou mutace podmínečné, především teplotně senzitivní (ts), případně chladově senzitivní (cs). Původně byly tyto vzácně detekované mutace považovány za spíše zajímavé, případně experimentálně využitelné výjimky mezi mutacemi p53. Se stále častějším používáním funkčních testů na místo molekulárních analýz struktury DNA při vyšetřování statutu p53 ale podíl těchto mutací neustále narůstá. Status teplotní senzitivity je sám o sobě zajímavý, protože poukazuje na skutečnost, že všechny mutace nejsou stejné. Zatímco některé rozvrací konformaci proteinu p53 zcela a nevratně, znemožň ují bezvýhradně jeho transaktivační funkci a jsou tedy zcela inaktivující, jiné mutace pouze lokálně narušují standardní strukturu p53 v místě vazby na DNA nebo v oligomerizační doméně, ale ponechávají ji poněkud flexibilní a za určitých podmínek (např. změnou teploty) umožň ují její návrat do funkční podoby, jsou tedy jen částečně inaktivující. Mnohem podstatnější okolností teplotně senzitivních mutací p53 je ale fakt, že jsou často doprovázeny dalším fenotypovým znakem naplň ujícím podstatu částečné inaktivace. Zatímco standardní protein umí rozpoznat a následně fungovat na všech svých popsaných responzivních elementech (i když s odlišnou afinitou), ts mutanti jsou často diskriminující, to znamená, že jsou více nebo méně funkční na některých responzivních elementech p53, zatímco jsou zcela nefunkční na jiných.
FASAY („functional analysis of separated alleles in yeast“) je jednou z metod používaných k detekci mutantů p53 v klinickém materiálu (v nádorové tkáni, v buň kách periferní krve, apod.). Metoda využívá reparačního mechanismu na principu homologní rekombinace („gap repair“), který se uplatň uje v kvasinkových buň kách, a toho, že lidský protein p53 funguje v kvasinkách jako transkripční faktor (Ishioka et al. 1993, Flaman et al. 1995). Transkripčně aktivační schopnost p53 odvozeného metodou RT-PCR z vyšetřované tkáně je v kvasinkových buň kách testována s využitím reportérského genu ADE2. Míra transaktivační schopnosti p53 je hodnocena podle zbarvení kvasinkových kolonií, které rostou na plotnách s nízkou hladinou adeninu a které exprimují danou variantu p53. Metoda FASAY má nesmírný potenciál být neustále vyvíjena a obměň ována a ve svých různých variantách slouží kanalýze různých funkčních typů mutací p53 (Flaman et al. 1998, Di Como a Prives 1998, Campomenosi et al. 2001, Inga et al. 2002, Resnick a Inga 2003, Inga et al. 2001, Inga et al. 1997, Monti et al. 2002, Monti et al. 2003, Shie et al. 2002).
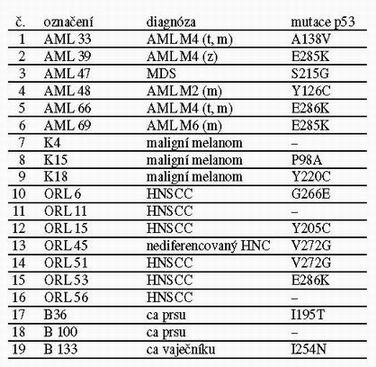
Tabulka 1: Přehled teplotně senzitivních mutací p53
AML – akutní myeloidní leukémie;
MDS – myelodysplastický syndrom;
HNSCC – dlaždicobuněčný nádor hlavy a krku.
Funkční analýzu v kvasinkách používáme k detekci mutantů p53 již několik let. Díky drobné modifikaci protokolu FASAY jsme schopni s vysokou účinností detekovat teplotně závislé mutace p53 (Pavlová et al. 2003). Během práce na našich projektech se nám postupně podařilo vytvořit soubor 19 teplotně závislých mutací p53 (tab. 1): 5 teplotně senzitivních mutací bylo nalezeno mezi mutacemi detekovanými u pacientů s akutní myeloidní leukémií (AML), 1 u pacienta s myelodysplastickým syndromem (MDS) (Pavlová et al. 2003), 3 teplotně závislé mutace (1 teplotně senzitivní a 2 chladově senzitivní) byly detekovány mezi mutacemi nalezenými v buněčných liniích odvozených z maligního melanomu, 7 teplotně senzitivních mutací bylo nalezeno při analýze statutu p53 u nádorů hlavy a krku (Šmardová et al. 2004), 2 teplotně senzitivní mutace byly nalezeny v tkáni karcinomu prsu a 1 teplotně senzitivní mutace byla detekována mezi mutacemi nalezenými u karcinomu vaječníku. Podrobnější analýzou těchto mutantů p53 jsme zjistili:
- Jednotliví teplotně senzitivní mutanti p53 se liší mírou své teplotní závislosti, tj. liší se teplotou, při které dochází k plnému nebo alespoň částečnému obnovení jejich transaktivační schopnosti.
- Mutanti se liší svou schopností reaktivace funkce p53, například působením amifostinu.
- Alespoň někteří teplotně závislí mutanti se liší mírou své aktivity na různých typech promotorů (RGC, p21, bax), tedy mají tak zvaně diskriminující povahu.
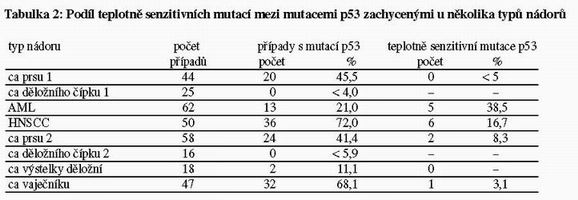
- Frekvence výskytu teplotně senzitivních mutantů p53 je tkáň ově
specifická. Celkový počet námi zachycených teplotně senzitivních
mutantů p53 je 19 (z celkového počtu 127 detekovaných mutantů)
(tab. 2), ale jejich distribuce mezi různé typynádorů je zřetelně
nerovnoměrná. Zatímco například mezi 32 mutanty p53 nalezenými u
karcinomu vaječníku pouze jediná
(3,1%) byla teplotně senzitivní, podíl teplotně senzitivních mutantů (5/13) dosahoval u AML 38,5%. V tomto případě byl navíc podíl teplotně senzitivních mutantů vyšší u sekundárních AML než u primárních.
Literatura
- Campomenosi P, Monti P, Aprile A, Abbondandolo A, Frebourg T,
Gold B, Crook T, Inga A, Resnick MA, Igo R, Fronza G.
Oncogene 20 (2001) 3573-3579. - Di Como CJ, Prives C. Oncogene 16 (1998) 2527-2539.
- Flaman JM, Frebourg T, Moreau V, Charbonnier F, Martin C,
Chappuis P, Sappino AP, Limacher JM, Bron L, Benhattar J, Tada M,
Van Meir EG, Estreicher A, Iggo RD. Proc.Natl.Acad.Sci.USA 92
(1995) 3963-3967.
- Flaman JM, Robert V, Lenglet S, Moreau V, Igo R, Frebourg T.
Oncogene 16 (1998) 1369-1372.
- Inga A, Cresta S, Monti P, Aprile A, Scott G, Abbondandolo A,
Iggo R, Fronza A. Carcinogenesis 18 (1997) 2019-2021.
- Inga A, Monti P, Fronza G, Darden T, Resnick M. Oncogene 20
(2001) 501-513.
- Inga A, Storici F, Darden TA, resnick MA. Mol.Cell Biol. 22
(2002) 8612-8625.
- Ishioka C, Frebourg T, Yan YX, Vidal M, Friend SH, Schmidt S,
Iggo R. Nature Genet. 5 (1993) 124-129.
- Monti P, Campomenosi P, Ciribilli Y, Iannone R, Inga A,
Abbondandolo A, Resnick MA, Fronza G. Oncogene 21 (2002)
1641-
1648. - Monti P, Campomenosi P, Ciribilli Y, Iannone R, Aprile A, Inga
A, Tada M, Menichini P, Abbondandolo A, Fronza G. Oncogene 22
(2003) 5252-5260.
- Pavlová Š, Mayer J, Koukalová H, Šmardová J. Int.J.Oncol. 23
(2003) 121-131.
- Resnick M, Inga A. Proc.Natl.Acad.Sci. USA 100 (2003)
9934-9939.
- Shie XB, Di Mauro SM, Highshaw R, Deitch AD, Evans CP,
Gumerlock PH, deVere White RW. Cancer Biother.Radiopharm.
17 (2002) 657-664. - Šmardová J., Kšicová K., Binková H., Krpenský A., Pavlová Š.,
Rottenberg J., Koukalová H. Oncol.Rep. 11 (2004) 923-929.
Tato práce je podporována grantem IGA MZ ČR č. NR/8068-3
Datum přednesení příspěvku: 26. 5. 2004





