Konference: 2004 XXVIII. Brněnské onkologické dny a XVIII. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: Nádorová imunologie a buněčná terapie
Číslo abstraktu: 53
Autoři: Mgr. Darina Očadlíková; Mgr. Lucie Říhová, PhD.; Petra Vidláková; E. Tůzová; Jana Heinigová; prof. MUDr. Miroslav Penka, CSc.; prof. MUDr. Jan Žaloudík, CSc.; prof. MUDr. Roman Hájek, CSc.; Prof. MUDr. Jaroslav Michálek, Ph.D.
Mnohočetný myelom (MM) je nádorové onemocnění, které je charakterizováno zhoubnou klonální proliferací plazmatických buněk. Incidence tohoto onemocnění jsou asi 4 nemocní na 100 000 obyvatel. Zaujímá 10% z hematologických malignit a 1% ze všech nádorových onemocnění. Neefektivnost standardní chemoterapie při léčbě onemocnění vedla k zavedení vysokodávkované chemoterapie (1,2). Tato léčebná strategie dosahuje vysokého procenta léčebných odpovědí (80-90%) s maximálním podílem kompletních remisí v rozmezí 30-40%. Parametry dlouhodobého přežití jsou lepší než při použití standardní léčby: medián
3 roky pro dobu do relapsu onemocnění a medián 4-5 let pro celkové dlouhodobé přežití (2,3). Výsledky randomizované studie potvrdily přínos vysokodávkované léčby oproti standardní chemoterapii pro nemocné s MM (4). Přestože je zařazení autologní transplantace do léčebné strategie pacientů s MM výrazným přínosem, relaps onemocnění je zpravidla neodvratný. I přes dosažení kompletní remise zůstává v organismu pacienta zbytková nádorová populace.
MM je považován za nevyléčitelné onemocnění (5,6), a proto jsou hledány nové cesty, jak zlepšit prognózu pacientů s MM. Jednu z nich představuje protinádorová imunoterapie, která zaznamenala značný úspěch u melanomu a renálního karcinomu, které jsou považovány za imunogenní. V posledním desetiletí byly podány experimentální důkazy o možnostech navození imunitní reaktivity i vůči méně imunogenním nádorům včetně MM (7,8,9). Imunitní systém může být aktivován specifickými nádorovými antigeny. V případě MM se nabízí využití monoklonálního imunoglobulinu, který je produkován nádorovým klonem plazmatických buněk. Tento tzv. idiotypický protein (Id-protein) může být izolován z plazmy pacientů s MM a použit jako specifický nádorový antigen ke stimulaci cytotoxických T-lymfocytů (CTL) schopných lyzovat autologní myelomové buňky in vitro (10,11). Aktivace T-lymfocytů byla prokázána jak in vitro, tak in vivo. Id-protein je však málo imunogenní, a proto vakcíny připravené z Id-proteinu dosáhly jen velmi limitovaných úspěchů (12, 13, 14).
Dalšími příčinami neuspokojivých výsledků imunoterapie u MM jsou mnohočetné defekty imunitního systému pacientů s MM, které zahrnují defekty dendritických buněk (DB) a jejich schopnosti aktivovat T-lymfocyty (15, 16), malou imunogennost myelomových buněk (17), defekty imunitního systému pacientů s MM (18) a funkční změny T-lymfocytů, NK buněk a B-lymfocytů (17).
Ve druhé polovině 90. let bylo s výhodou využito DB naložených nádorovými antigeny, které mají schopnost aktivace protinádorově specifických CTL (19, 20). V současné době jsou tímto způsobem testovány různé druhy potenciálních nádorových antigenů. Bylo prokázáno, že myelomové buňky, u nichž byla navozena apoptóza ozářením a byly využity jako nádorové antigeny a naloženy do DB, indukují odpověď myelom-specifických CTL in vitro (21). Po opakované stimulaci T-lymfocytů apoptickými tělísky nádorových buněk naložených do DB dochází k jejich aktivaci, kterou lze standardně měřit pomocí produkce g)interferonu gamma (IFN-). Cílem této studie byla identifikace specifických protinádorových T-lymfocytů, které lze separovat a expandovat in vitro.
2. Materiál a metody
2.1.Buněčné kultury
Mononukleární buňky (MN) byly izolovány z nesrážlivé periferní krve (PK) zdravých dárců po podepsání informovaného souhlasu z transfuzní stanice ve FN Brno metodou gradientové centrifugace (Histopaqueu 1077, Sigma-Aldrich, Praha, Česká republika) a kultivovány v médiu obsahujícím X-VIVO 10 (BioWhittaker, Walkersville, MD, USA) s 80U/ml DNAsy (Boehringer, Mannheim, Ně mecko) a 1mM L-glutaminu (Sigma-Aldrich, Praha, Česká republika) na 6-jamkových miskách při 37°C v atmosféře 5% CO2 a 4,5% O2 Iniciální buněčnost byla 3,3x106 buněk/ml tohoto média.
Po 2-hodinové kultivaci byla suspenze rozdělena na adherentní a neadherentní frakci. Byl odebrán supernatant s neadherentní frakcí bohatou na T-lymfocyty a tyto buňky byly zamraženy a uchovávány při –80°C. Před vlastní stimulací byly T-lymfocyty kultivovány přes noc v kompletním médiu (KM) obsahujícím X-VIVO 15 (50 mg/l gentamycin, 2 mM L-glutamin, 25 mM hepes pufr: BioWhittaker, Walkersville, MD, USA) s 10% lidským AB-sérem (Sigma-Aldrich, Praha, Česká republika) při 37°C v atmosféře 5% CO2.
Adherentní frakce bohatá na prekurzory DB byla dále kultivována v médiu pro DB:X-VIVO 10 (BioWhittaker, Walkersville, MD, USA) se 100 ng/ml interleukinu 4 (IL-4) (Sigma-Aldrich, Praha, Česká republika) a granulocyty a makrofágy stimulující faktor (GM-CSF) 800 U/ml (Schering Plough, New Yersey, USA) po dobu 6 dnů při 37°C v atmosféře 5% CO2 a 4,5% O2, médium pro DB včetně IL-4 a GM-CSF bylo měněno 2x. 7.den byl přidáván antigen – ozářené myelomové buňky linie ARH 77 dávkou 60 Gy (MB) v poměrech 1:1, 1:2, a 1:10 (DB:MB), a) 40 8.den tumor-nekrotizující faktor (TNF-ng/ml (Bender Med-systems Diagnostics, Vídeň , Rakousko) (22). 9. den byly DB naložené MB smíchány s T-lymfocyty ve stimulačních poměrech 2:1, 10:1, 20:1, 28:1 (T-lymfocyt:DB+MB). Část DB naložených MB byla zamražena a uchovávána při –80°C pro pozdější restimulaci. DB byly 2 hod před restimulací kultivovány v KM. Restimulace byla prováděna samotnými MB nebo DB naloženými MB v restimulačních poměrech 2:1, 10:1 (T-lymfocyt:antigen, DB+MB).
2.2. Příprava antigenu
Jako zdroj nádorových buněk byla využita myelomová buněčná linie ARH 77 (dar, který byl laskavě poskytnut profesorem
B. Barlogiem, University of Arkansas, USA, 1995). Nádorový antigen byl připraven ozářením myelomových buněk dávkou 60Gy.
2.3. Značení pomocí IFN – a magnetická separace
Aktivované T-lymfocyty produkující IFN-γ byly zhodnoceny pomocí Secretion Assay Cell Enrich. And Detect. Kit (MACS Reagens, Miltenyi Biotec, Bergisch Gladbach, Německo) podle pokynů výrobce (23).
Magnetická separace byla prováděna na koloně umístěné v magnetickém poli přístroje Vario MACS (MACS Reagents, Miltenyi Biotec, Bergisch Gladbach, Německo). Výsledkem bylo významné gobohacení IFN-γ pozitivních T-lymfocytů. Pozitivní frakce byla získána dvojitou separací pro zvýšení čistoty.
2.4. Průtoková cytometrie:
T-lymfocyty (1x106) z pozitivní a negativní frakce po MACS-separaci byly inkubovány 15 minut s monoklonálními protilátkami anti-CD4 značenými fluoroisothiokyanátem (FITC), anti-CD8 FITC, anti-CD3 phycoerythrin-cyaninem (PE-Cy) g(Immunotech, Marseille, Francie) a s anti-IFN-γ phycoerythrinem (PE) (Miltenyi Biotec, Bergisch Gladbach, Německo). T-lymfocyty byly analyzovány na průtokovém cytometru Cytomics™ FC 500 (Beckman Coulter, Miami, Florida, USA).
2.5. Expanze T-lymfocytů in vitro
IFN-γ pozitivní T-lymfocyty byly expandovány in vitro v KM obohaceném o interleukin 2 (IL-2) (Proleukin, Chiron, Amsterdam, Holandsko) (500 IU IL-2/ml KM). 1.den expanze byl přidán phytohemaglutinin (PHA) (Sigma-Aldrich, Praha, Česká republika) mv množství 5µg/ml KM. Po celou dobu expanze byla udržována buněčnost kultury 1x106 lymfocytů/ml KM. KM včetně IL-2 bylo vyměň ováno 1 x týdně a současně byly přidávány alogenní MNPK ozářené dávkou 30 Gy.
3. Výsledky a diskuse
Nejprve byly optimalizovány poměry stimulace T-lymfocytů autologními DB naloženými MB. Optimální stimulace bylo dosaženo při poměrech 20:1 (T-lymfocyt:DB+MB) a 1:1 (DB:MB) viz tabulka. Maximální produkce IFN- na průtokovém cytometru byla zaznamenána 48 hod po stimulaci. V případě CD4+ T-lymfocytů došlo kjejich významné aktivaci. V případě CD8+ T–lymfocytů došlo pouze k marginální aktivaci po celou dobu měření. Stimulované T-lymfocyty byly po 7-denní inkubaci restimulovány buď DB naloženými MB nebo samotnými MB. Optimální restimulace gbylo dosaženo při poměru 2:1 (T-lymfocyt: DB+MB). Produkce IFN-γ byla po restimulaci DB naloženými MB několikanásobně vyšší viz obrázek.
Restimulované aktivované myelom-specifické T-lymfocyty byly magneticky separovány a expandovány in vitro. Došlo kexpanzi z počáteční hodnoty 3x105 na 2x108 T-lymfocytů během pěti týdnů. Naměřené výsledky jsou v souladu s publikovanými prácemi (23, 24), které rovněž ukázaly možnost identifikace a následné expanze protinádorových T-lymfocytů včetně průkazu, že DB naložené ozářenými nádorovými buň kami lépe stimulují autologní T-lymfocyty než samotné ozářené nádorové buňky.
Tabulka

Průměrné hodnoty aktivovaných IFN-γ+ CD3+ CD4+ a IFN-γ+ CD3+ CD8+ myelom-specifických T-lymfocytů a nestimulovaných T-lymfocytů (negativní kontrola). Měřeno na průtokovém cytometru 48 hod po stimulaci. T-lymfocyty byly stimulovány DB naloženými MB. Data byla vyhodnocena pomocí Wilcoxonova testu, kde n je počet experimentů.
Obrázek
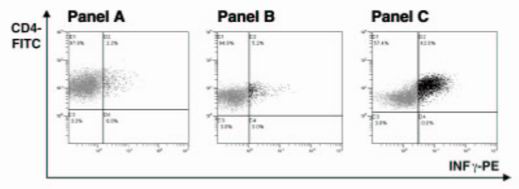
Výsledek průtokové cytometrie, měření aktivovaných T-lymfocytů pomocí produkce IFN-γ u CD4+ T-lymfocytů 24 hod po restimulaci.
Panel A: negativní kontrola bez stimulace;
panel B: aktivace T-lymfocytů samotnými MB v poměru 2:1;
panel C: aktivace T-lymfocytů DB naloženými MB v poměru T-lymfocyt:DB+MB 2:1.
4. Závěr
MM je nevyléčitelné onemocnění. Jednou z možností jak zlepšit jeho prognózu je protinádorová imunoterapie založená na schopnostech DB účinně předkládat nádorový antigen T-lymfocytům a indukovat tak protinádorovou imunitní odpověď. Tato práce byla zaměřena na identifikaci myelom-specifických T-lymfocytů in vitro. Aktivace byla provedena DB naloženými ozářenými myelomovými buňkami. Izolace aktivovaných T-lymfocytů byla provedena magneticky na základě jejich produkce IFN-γ. Aktivované T-lymfocyty bylo možno expandovat in vitro na množství použitelné pro klinické aplikace.
Částečně podporováno z grantu IGA MZ 7475-3.
Literatura
- Hájek R., Aam Z., Vášová I. A Král Z.: Evolution of myeloma
treatment from melphalan monotherapy to bone marrow
transplantation. Acta Medica Austriaca, 1996, 23, No.3
(85-91)
- Hájek R., Vášová I., Adam Z., Mayer J.: New approaches to
management of multiple myeloma. Acta medica Austriaca, 1996, 23
(91-8)
- Barlogie B., Jagannath S., Vesole D. H., Trikot G.: Autologous
and allogenic transplants for multiple myeloma. Semin. Hematol.,
1995, 32 (31-44)
- Attal M., Haroussean J. L., Stoppa A. M., et al.: A
prospective, randomized trial of autologous bone marrow
transplantation and chemotherapy in multiple myeloma. N. Engl. J.
Med., 1996, 335 (91-7)
- Adam Z., Vorlíček J., Králová E., et al.: Therapy of multiple
myeloma. Press:Opsula. Haematologica, Masaryk University
Brno, 1993 (1-220) - Adam Z., Hájek R., Mayer J., Ščudla V., Vorlíček J. a kol.:
Mnohočetný mydlím a další monoklonální gamapatie. Masarykova
univerzita, 1999
- Yi Q., Ö sterborg A.: Idiotype-specific T cells in multiple
myeloma:targets for an immunotherapeutic intervention?. Med.
Oncol., 1996, 13 (1-7)
- Greipp P.R., Witzig T.: Biology and treatment of myeloma. Curr.
Opin. Oncol., 1996, 8 (20-7)
- Barlogie B., Jagannath S., Epstein J., Munshi N., Siegel D.,
Desikan K. R., Feinman R., Hsu P. L., Von Bremen K., Trikot G.:
Biology and therapy of multiple myeloma in 1996.
Semin.Hematol.,1997, 34 (67-72)
- Kwak L.W., Thielemans K., Massaia M.: Idiotypic vaccination as
therapy for multiple myeloma. Semin.Hematol., 1999, 36
(34-37) - Musilová R., Táborská E., Bourková L., Bü chler T., Kovářová
L., Novotná H., Penka M., Hájek R.: Příprava a využití
antitumorového antigenu z patologického imunoglobulinu pro pacienty
s mnohočetným myelomem. Transfuze a hematologie dnes, 2002, 3(8)
(91-95)
- Kwak L.W. et al.: Induction of imnmune response in patiens with
B-cell lymphoma against the surface-immunoglobulin idiotype
expressed by their tumor. N. Engl. J. Med.,1992,327
(1209-1215)
- Ö sterborg A., Yi Q., Henriksson L., Fagerberg J., Bargenbrant
S.: Idiotype immunization combined with GM-CSF in myeloma patiens
induced type I, MHC restricted, CD4-and CD8-specific T-cell
responses. Blood,1998, 91(7) (2458-66)
- Massaia M., Borrione P., Battaglio S., Mariani S., et al:
Idiotype vaccination in human myeloma:generation of tumor-specific
immune response after high-dose chemotherapy. Blood, 1999, 94 (2)
(673-83)
- Raje N., Gong J., Chauhan D., Teoh G., et al.: Bone marrow and
pheripheral blood dendritic cells from patiens with multiple
myeloma are phenytypically and functionaly normal despote the
detection of Kaposi’s sarcoma herpesvirus gene sequences., Blood,
1999, 93(5) (2411-9)
- Brown R. D., Pope B., Murray A., Esdale W., Sze D. M., Gibson
J., Ho P. J., Hart D., Josua D.. Dendritic cells from patients with
myeloma are numerically normal but functionally defective as they
fail to up-regulate CD80 (B7-1) expression after huCD40LT
stimulation because of inhibition by transforming growth
factor-beta1 and interleukin-10.,Blood, 2001, 98(10)
(2992-8)
- Cook G., Campbell J.D.M.: Immune regulation in multiple
myeloma: the host-tumor conflict., Blood Reviews,1999, 13
(151-162)
- Yi Q.: Immunoregulatory mechanisms and immunotherapy In: Mehta
J. and Singhal S., Myeloma., Martin Dunitz Ltd.; 2002
(81-97) - Hájek R., Butch A.W.: Dendritic cell biology and the
application of dendritic cells to immunotherapy of multiple
myeloma., Med. Oncol., 2000, 17 (2-15)
- Bü chler T. and Hájek R.. Dendritic cell vaccines in the
treatment of multiple myeloma., Med.Oncol., 2002, 19(4) 213-8
2002
- Hayashi T., Hideshima T., Akiyama M., Raje N., Richardson P.,
Chauhan D. and Anderson K.C.: Ex vivo induction of multiple
myeloma-specific cytotoxic T lymphocytes., Blood, 2003, 102
(1435-1442)
- Bü chler T., Hájek R., Bourková L., Kovářová L. Musilová R.,
Buliková A., Doubek A., Svobodník A., Mareschová I.,
Váňová P., Tůzová E., Vidláková P., Vorlíček J., Penka M.: Generation of antigen-loaded dendritic cells in a serum-free medium usány different cytokine combinations., Vaccine, 2003, 21 (877-882) - Brosterhus H., Brings S., Leyendeckers H., Manz R.A., Miltenyi
S., Radbruch A., Assenmacher J., Schmitz J.: Enrichment and
detection of live antigen-specific CD4(+) and CD8(+) T cells based
on cytokine secretion., Eur J. Immunol., 1999,29(12)
(4053-9)
- Becker C., Pohla H., Frankenberger B., Schuler T., Assenmacher
M., Schendel D.J., Blankenstein T.: Adoptive tumor therapy with
Tlymphocytes enriched through an IFN-gamma capture assay., Nat.
Med., 2001, 7(10) (1159-62)
Datum přednesení příspěvku: 26. 5. 2004





