Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Chemoterapie
Téma: Novinky v protinádorové chemoterapii a v bioterapii
Číslo abstraktu: 044
Autoři: MVDr. Jan Hraběta; RNDr. Jitka Poljaková; MUDr. Aleš Vícha; prof. RNDr. Marie Stiborová, DrSc.; Katarína Figová; J. Činát; Martin Michaelis; prof. MUDr. Tomáš Eckschlager, CSc.
V experimentechin vitro jsme prokázali přímý cytosatický účinek VPA na linie odvozené od neuroblastomu, včetně linií s experimentálně navozenou rezistencí k cytostatikům viz obrázek 1. U těchto linií VPA také snižoval expresi MYCN. VPA rovněž potencovala účinky ellipticinu viz obrázek 2, cytostatika jehož hlavními mechanismy účinku jsou interkalace, inhibice topoisomerázy II a kovalentní vazba na DNA po enzymatické aktivaci (tvorba adduktů). V neuroblastomových buňkách inkubovaných s ellipticinem a VPA jsme prokázali vyšší koncentraci adduktů ellipticinu než u buněk inkubovaných se stejnou koncentrací ellipticinu bez VPA.
VPA je podáván s velmi dobrou dostupností, jeho poločas je 920 hodin, prostupuje přes hematoencefaickou barieru a je možné jeho dlouhodobé podávání s únosnou toxicitou. V současné době probíhá v USA i v Evropě několik studií zaměřených na terapii zhoubných nádorů kyselinou valproovou v monoterapii. Kombinace vybraného cytostatika s VPA se proto zdá nadějnou.

Obrázek 1.
Účinek VPA na buněčnou linii UKF-NB-4 (odvozené od chemorezistentní recidivy neuroblastomu s vysokou expresí P-glykoproteinu) a od ní připravené linie vysoce rezistentní k cisplatině.
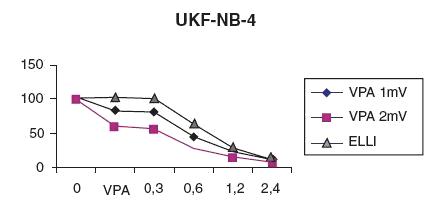
Obrázek 2.
Potenciace účinku ellipticinu VPA v koncentraci 1 a 2 mM.
Buňky UKF-NB-4 (odvozené od chemorezistentní recidivy neuroblastomu s vysokou expresí P-glykoproteinu) byly inkubovány 24hodin
při 1 mM a 2 mM koncentraci VPA nebo bez VPA, následně byl přidán ellipticin v různých koncentracích
a po 5 dnech byla životnost buněk měřena MTT testem.
Práce vznikla za finanč ní podpory MŠMT VZ č . 0021620813.
Datum přednesení příspěvku: 13. 5. 2005





