Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: Imunologie nádorů
Číslo abstraktu: 216p
Autoři: MUDr. Šárka Lukešová, Ph.D.; doc. MUDr. Otakar Kopecký, CSc.; Mgr. Vladimíra Vroblová, Ph.D.; PharmDr. Doris Vokurková, Ph.D.; MUDr. Petr Morávek, CSc.; H. Šafránek; RNDr. Pavel Souček, CSc.
Renální karcinom je více než jiné tumory infiltrován lymfocyty. Přítomnost tumor infiltrujících lymfocytů (TIL) u karcinomu ledviny odráží protinádorovou aktivitu organismu. Podrobné poznání fenotypu a funkce efektorových buněk pro nádorovou regresi je důležité pro stanovení správné strategie imunoterapie (9) a odhad prognózy onemocnění. Existuje mnoho prací, které sledují pomocí průtokové cytometrie přítomnost subpopulací lymfocytů v renálním tumoru. Součástí našeho výzkumného záměru je také porovnat přítomnost různých cytologických parametrů ve vlastním tumoru, v krvi z renální žíly a v periferFITní krvi.
Soubor pacientů
V období mezi dubnem 2005 a prosincem 2005 bylo provedeno chirurgické odstranění ledvinového nádoru 38 pacientům. Soubor byl tvořen 13 ženami a 25 muži ve věkovém rozmezí od 31 do 82 roků. Průměrný věk pacientů byl 65,8 let (s.d. = 10,86 let).
Většině pacientům byla provedena radikální nefrektomie (36 pacientů). Ve dvou případech byla provedena resekce části ledviny. Bilaterální nález tumoru ledviny byl nalezen u jednoho pacienta, kterému byla provedena jednostranná nefrektomie a enkapsulace tumoru na druhé postižené ledvině.
Dle histologického zhodnocení patologem se v 79% (30 pacientů) jednalo o konvenční světlobuněčný karcinom, v 11% (4 případy) šlo o papilární karcinom, ve 3% (2 pacienti) byl nalezen chromofobní karcinom. Po jednom případu byl diagnostikován sarkomatoidní a vřetenovitý karcinom.
K určení stupně pokročilosti onemocnění jsme použili klasifikaci TNM. Do T1 patřilo 50% pacientů (19 případů), 29% (11 případů) pacientů s renálním karcinomem bylo zařazeno do T2. 18% (7 případů) bylo zařazeno do T3 a jeden do T4 klasifikace prvotního ložiska. Rozřazení do stádií je shodné s číselnými indexy prvotního ložiska (T-tumor). Jen dva pacienti zařazení do T1 a jeden pacient do T3 patří do stadia IV pro současný výskyt metastáz. N (noduli) v klasifikaci TNM popisuje stav regionálních mízních uzlin a je vyjádřen číselnými indexy N1-3. V našem souboru pacientů se vyskytly jen dva případy s číselným indexem N1, u 6 pacientů se nález na uzlinách nedal spolehlivě interpretovat. Ostatní pacienti (79%, 30 pacientů) měli negativní nález v uzlinách. Tři pacienti (8%) byli zařazeni do M1 pro vzdálené metastázy. Zbylých 35 pacientů (92%) bylo zařazeno do M0 pro nepřítomnost vzdálených metastáz.
Od každého pacienta jsme získali vzorek nádoru, periferní krev a krev z renální žíly v den operace. Z tohoto souboru pacientů se tumor infiltrující lymfocyty podařilo vyhodnotit u 28 vzorků nádorové tkáně. (U deseti vzorků nádorová tkáň neobsahovala dostatečný počet lymfocytů pro kvalitní analýzu).
Metoda
Periferní krev i krev z renální žíly byly odebírány do zkumavek s heparinem. Vždy 25 l krve bylo inkubováno 20 minut s 10 l naředěnými přímo značenými monoklonálními protilátkami (Immunotech a Beckman Coulter Company): CD45-FITC / CD14-PE, CD3-FITC / CD16+56-PE / CD19-PC5, RO-FITC / RA-PE / CD4-PC, CD8-FITC / DR-PE / CD3-PC5, CD69-FITC / CD25-PE / CD3-PC5, CD57-FITC / alfa+beta-PE / CD8-PC5, CD34-FITC / CD105-PE. Po zlyzování červených krvinek lyzačním roztokem (0,5 ml OptiLyse C, Backman Coulter) jsme přidali fyziologický roztok s 5% azidem sodným (1,5 ml Natriumazid-MERCK + Infusio Natrii Chlorati Isotonica-IMUNA) a provedli víceparametrovou analýzu průtokovým cytometrem Coulter® Epics® XL (Coulter, Fullerton, USA). Vyhodnocení naměřených vzorků bylo provedeno analyzačním programem CXP software analysis.
Nádorová tkáň byla mechanicky dezintegrována a zhomogenizována pomocí nůžek, pinzety a homogenizátoru na jednotlivé buněčné elementy, které byly přefiltrovány, 2x promyty fyziologickým roztokem (Infusio Natrii Chlorati Isotonica-IMUNA) a naředěny na přibližnou koncentraci 5x105 buněk. Další postup byl stejný jako u zpracování krve.
Výsledky
Výsledky měření jsou uvedeny v tabulce. Statisticky významné rozdíly byly zjištěny ve výskytu těchto subsetů v nádoru oproti nálezu v periferní krvi a renální žíle: CD3+/69+, CD4+, CD8+, poměr CD4+/CD8+, CD69+. Aktivační molekula CD69+, zprostředkovávající časné aktivační signály, byla vyjádřena na vyšším procentu mononukleárních buněk izolovaných z nádorové tkáně. CD8+ T lymfocyty byly dominantní lymfocytární populací v nádorové tkáni, naopak CD4+ T lymfocyty byly většinovou populací v periferní a renální žilní krvi. Zastoupení NK buněk (CD3–/16+56+) a CD3+/DR+ T lymfocytů nevykazovalo statisticky významné rozdíly.
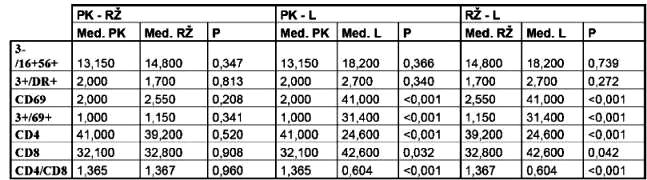
Med. = median
Diskuze
Klinická pozorování jak spontánních regresí primárních i sekundárních ložisek renálního karcinomu (RC), tak i léčebných odpovědí u 15-20% nemocných po podání IL-2 svědčí pro účinnou protinádorovou odpověď. Za protinádorovou odpověď jsou zodpovědny tumor infiltrující lymfocyty (TIL). Jedná se o heterogenní populaci cytotoxických buněk nesoucích převážně fenotyp CD3+/CD8+ a CD3–/CD16+/CD56+. Minoritní populací TIL jsou CD4+ T lymfocyty a B lymfocyty. Na všech uvedených buněčných typech, isolovaných z RC jsou nalézány znaky časné i pozdní aktivace. Pro efektivní protinádorovou odpověď je důležité rozpoznání nádorových struktur T lymfocyty. V tomto ohledu je za klíčovou považována role dendritických buněk (DC) a monocytů infiltrujících tumor. Dendritické buňky svým cytokinovým spektrem mohou upřednostňovat TH1 odpověď a předkládají nádorové antigeny cytotoxickým lymfocytům (2).
Ve shodě s jinými autory jsme nalezli signifikantně vyšší zastoupení CD8+ T lymfocytů v TIL oproti nálezům v periferní krvi (4,7,8).
Zastoupení NK buněk v TIL nebylo u našich nemocných signifikantně zvýšeno. V periferní krvi se nacházejí dvě subpopulace NK buněk. Obě subpopulace exprimují povrchové molekuly CD16 a CD56. Molekula CD57 je naproti tomu vyjádřena pouze na zralých NK buňkách. Nachází se i na části cytotoxických CD8+ T lymfocytů. NK buňky jsou považovány za hlavní efektorovou buněčnou populaci v protinádorové odpovědi (3). Bylo prokázáno, že přítomnost CD57 pozitivních buněk je nezbytná pro dosažení léčebné odpovědi po podání IL-2. Určení fenotypu TIL u lokalizovaného renálního karcinomu nemá prognostický význam. Pouze u nemocných s renálním karcinomem III. a IV. stádia bylo pozorováno vyšší zastoupení CD4+ a snížení CD8+ T lymfocytů. V několika studiích byla sledována exprese aktivačních molekul na TIL buňkách. Molekuly CD69, CD25, HLA DR jsou vyjádřeny na membránách všech buněčných populací TIL (5,6,8).
Ačkoliv přítomnost aktivovaných TIL je popisována u více jak 70% nemocných s renálním karcinomem, jen u malé části je pozorována regrese tumoru. Příčina selhání lokální buněčné specifické protinádorové odpovědi není přesně známa a může mít řadu důvodů. Jedním z důvodů může být aktivace TH2 lymfocytů, které produkují IL-10. Tento cytokin potlačuje expanzi cytotoxických CD3+/CD8+ T lymfocytů. Funkce lymfocytárních buněk infiltrujících solidní tumor není uspokojivě vysvětlena (1). Zvýšená exprese aktivačních znaků CD69, HLA DR a nízká denzita CD25 je také pozorována u zánětlivých chorob pojiva. Je pravděpodobné, že u části nemocných infiltrace nádoru aktivovanými lymfocyty je způsobena cytokinovým a chemokinovým mikroprostředím nádoru. K infiltraci tumoru lymfoidními buňkami tak dochází i při nedostatečné nebo chybějící stimulaci nádorovými antigeny. Rostoucí nádorová tkáň je vystavena ischemii a částečně propadá nekróze. Do nekrotické tkáně vcestují fagocytující buňky, které produkují chemoatraktanty. Endoteliální buňky novotvořených cév produkují řadu faktorů stimulujících též proliferaci CD4+ T lymfocytů. TH2 lymfocyty produkují IL-13, který má proangiogenní efekt. Uvedený kruh je příkladem nespecifické antigenní stimulace, která je ve svém důsledku odpovědna za selhání imunologického dozoru (8).
Závěr
Současné poznatky na poli nádorové imunologie vytvářejí základ pro využití imunologických poznatků v diagnostice a léčbě nádorového bujení.
Lze shrnout, že imunokompetentní buňky infiltrující renální karcinom nesou známky aktivace. Transformace těchto imunokompetentních buněk v efektorové cytotoxické T a NK buňky je blokována u většiny nemocných zatím neznámými mechanismy. Nelze vyloučit, že u většiny nemocných dochází k nespecifické stimulaci TIL. Cytokinové prostředí nádoru a angiogenní faktory jsou zodpovědny za neúčelnou zánětovou lokální reakci. K prolomení tohoto stavu, při kterém jsou tolerovány nádorové struktury, nevedou ani imunomodulační zásahy interleukinem-2 a interferonem á. Plánujeme rozšířit naše pozorování o další pacienty a imunofenotypovou analýzu doplnit o průkaz cytoplazmatických znaků a stanovení hladin solubilních markrů. Všechny tyto nálezy budou korelovány s klinickými, imunohistochemickými a cytologickými vyšetřeními.
Zkratky:
APC antigen-prezentující buňky
BP-filtr bandpass filtr
CV koeficient variability
FITC fluorescein izothiokyanát
PC5 fycoerytrin cyanin 5
PE fycoerytrin
PI propidium jodid
RNA ribonukleová kyselina
TIL tumor infiltrujících lymfocytů
TNM Tumor, Nodi, Metastasis klasifikace
Literatura
- Bejarano, M.T., de Waal Malefyt, R., Abrams, J.S., et al.:
Interleukin 10 inhibits allogeneic proliferative and cytotoxic T
cell responses generated in primary mixed lymphocyte ciltures. Int.
Immunol., 1992; 59:1389-97.
- de Jong, E.C., Smits, H.H., Kapsenberg, M.L.: Dendritic
cell-mediated T cell polarization. Spr. Sem. Immun., 2005;
26:289-
307. - Donskov, F., Bennedsgaard, K.M., von der Maase, H., et al.:
Intratumoural and peripheral blood lymphocyte subsets in patients
with metastatic renal cell carcinoma undergoing interleukin-2 based
immunotherapy: association to objective response and survival. Br.
J. Cancer, 2002; 87: 194-201.
- Kowalczyk, D., Skorupski, W., Kwias, Z., Nowak, J.: Flow
cytometric analysis of tumour-infiltrating lymphocytes in patients
with renal cell carcinoma. Br. J. Urol., 1997; 80:
543-547.
- Kronke, M., Leonard, W.J., Depper, J.M., Greene, W.C.:
Sequential expression of genes involved in human T lymphocyte
growth and differentiation. J. Exp. Med., 1985; 161:
1593-8.
- Reed, J.C., Alpers, J.D., Nowell, P.C., Hoover, R.G.:
Sequential expression of protooncogenes during lecitin-stimulated
mitogenesis of normal human lymphocytes. Proc. Natl. Acad. Sci.
USA, 1986; 83: 3982-6.
- Shabtai, M., Ye, H., Frischer, Z., et al.: Increased expression
of activation markers in renal cell carcinoma infiltrating
lymphocytes. J. Urol., 2002; 168: 2216-2219.
- van den Hove, L.E., van Gool, S.W., van Poppel, H., et al.:
Phenotype, cytokine production and cytolytic capacity of
fresh
(uncultured) tumour-infiltrating lymphocytes in human renal cell carcinoma. Clin. Exp. Immunol., 1997; 109: 501-509. - Whittington, R., Faulds, D.: Interleukin-2. A review of its pharmacological properties and therapeutic use in patients with cancer. Drugs, 1993; 46: 446-514.
Tento příspěvek vznikl s podporou grantu výzkumného zámě ru IGA: NR/8914-4.
Datum přednesení příspěvku: 11. 5. 2006





