Konference: 2005 XXIX. Brněnské onkologické dny a XIX. Konference pro sestry a laboranty
Kategorie: Kolorektální karcinom
Téma: Kolorektální karcinom - Pokroky v diagnostice a léčbě
Číslo abstraktu: 101
Autoři: Doc. MUDr. Jan Novotný, Ph.D.; MUDr. Martina Zimovjanová, Ph.D.; Mgr. Viktor Sýkora; Doc. MUDr. Jiří Gatěk, Ph.D.; prof. MUDr. Luboš Petruželka, CSc.; Doc. MUDr. Luboš Holubec (jr.), Ph.D., MBA; Doc. RNDr. Ladislav Pecen, CSc.
Fluoropyrimidiny, jejichž hlavním zástupcem je 5-FU, patří mezi základní léky standardně používané pro léčbu celé řady solidních nádorů, včetně karcinomu prsu nebo kolorektálního karcinomu, a to jak v monoterapii, tak v kombinaci s dalšími cytotoxickými léky.
Základní režimy podání 5-FU jsou bolusové aplikace podle Mayo, kontinuální infúze dle DeGramonda samostatně nebo v kombinaci s oxaliplatinou (FOLFOX) či irinotekanem (FOLFIRI). Poměrně často je také používána mnoho týdnů trvající kontinuální infůze nízce dávkovaného 5-FU v režimu podle Lokiche či ECF.
Výhodou kontinuálních aplikací je vyšší účinnost jak z hlediska četnosti léčebných odpovědí, tak i z hlediska prodloužení celkového přežívání pacientů s kolorektálním karcinomem.
Nevýhodou podání 5-FU v kontinuální infuzi je nutnost zavedení centrálního žilního katetru, poměrně velká náročnost na práci zdravotnického personálu a nekomfort pro nemocného.
V nedávné době byl vyvinut perorálně podávaný derivát 5-FU, kapecitabin, který napodobuje kontinuální infúzi 5-FU aniž by měl způsoboval výše uvedené nepříznivé efekty.
Kapecitabin je prolék, fluoropyrimidový karbamát, který podstupuje přeměnu v aktivní metabolit enzymy karboxylesterázou, cytidindeaminázou a thymidinfosforylázou (TP).
Studie publikovaná Miwou naznačuje, že kapecitabin by mohl být přednostně aktivován v nádorové tkáni, neboť aktivita TP je signifikantně vyšší v nádorové než fyziologické tkáni[1] u řady japonských pacientů s různými solidními nádory. Také Schü ller[2] nalezl 3,66 x vyšší aktivitu TP v osmi vzorcích primárního kolorektálního karcinomu než v normální sliznici. Ve stejné studii se však nelišila aktivita TP v normální jaterní tkáni a v jaterních metastázách u jiných osmi pacientů. Bohužel, výsledky uvedené studie je však třeba posuzovat opatrně vzhledem k mimořádně malému studovanému souboru. V jiných dvou studiích byla exprese TP studována imunohistochemicky[3]. V obou byla pozorována vyšší exprese TP v buňkách nádorového stromatu a v tumor infiltrujících lymfocytech a makrofázích, nikoliv však v buňkách nádorových.
Cílem naší studie bylo zjistit míru exprese hymidinfosforylázy, thymidinfosforylázy a dihydropyrimidindehydrogenázy v primárním kolorektálním karcinomu a v sousední fyziologické sliznici.
Materiál a metody
Vzorky primárních nádorů a sousedící zdravé sliznice byly odebrány v průběhu operace pro karcinom tlustého střeva na chirurgickém oddělení nemocnice Atlas, Zlín od září 2002 do listopadu 2003.
Vzorky byly ihned po chirurgické resekci zbaveny nekrotické tkáně a rozděleny na částky o hmotnosti nejméně 100 mg. Jedna porce nádoru a zdravé sliznice byla skladována v médiu RNA later první týden při 4°C, později při –20°C. Druhé porce obou vzorků byly standardně histologicky zpracovány ve formolu a parafinu.
Celková RNA byla izolována kitem Perfect RNA Mini kit [Eppendorf Scientific, Inc., Germany]. Stanovení exprese klíčových prediktorů – thymidylátsyntázy (TS), thymidinfosforylázy a dihydropyrimidindehydrogenázy (DPD) bylo provedeno pomocí kvantitativní RT-PCR reakce na přístroji Light Cycler Roche s využitím komerčně dostupných kitů TSmRNA Quantification Kit plus, LightCycler – TPmRNA Quantification Kit plus and LightCycler DPDmRNA Quantification Kit plus.
Univariační statistická analýza byla provedena softwarem SAS.
Výsledky
Izolace RNA byla úspěšná u všech 128 vzorků 64 pacientů. Analýza TP byla provedena ve všech vzorcích, analýzy TS a DPD byly provedeny pouze ve vzorcích u náhodně vybraných 15, resp. 12 pacientů.
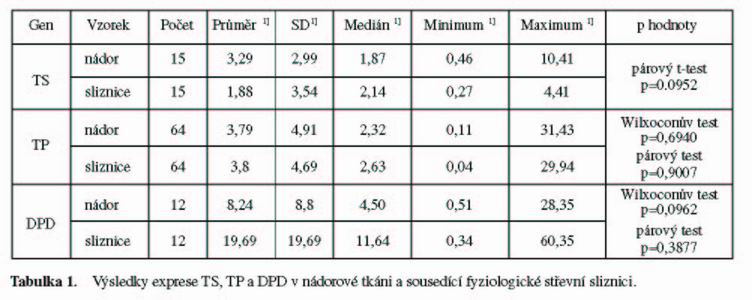
Výsledky kvantitativní exprese TS, TP a DPD ve srovnání s referenčním genem G6PDH jsou uvedeny v tabulce 1.
Rozdíly v expresi TS v nádorové a zdravé tkáni měly Gausovskou distribuci a nebyly statisticky významné [párový t-test, p=0.0952].
Na rozdíl od TS měla exprese TP a DPD negausovské rozložení. Statisticky významné rozdíly v expresi TP a DPD mezi primárním kolorektálním karcinomem a normální sliznicí nebyly pozorovány [TP: Wilxoconův test, p=0,6940; párový test, p=0,9007, resp. DPD: Wilxoconůvtest, p=0,0962; párový test p=0,3877 ].
Závěr
Výsledky naší práce, jakož i většiny ostatních studií, nepodporují tvrzení o významně vyšší expresi thymidinfosforylázy vnádorové tkáni než v normální střevní sliznici u stejného pacienta.
I přesto je třeba považovat kapecitabin za lék, který má svou nezastupitelnou úlohy v léčbě kolorektálního karcinomu, karcinomu prsu a potenciálně i u jiných solidních nádorů.
Odkazy
- Miwa M, Ura M, Nishida M, Sawada N, Ishikawa T, Kori K, Shimma
N, Umeda I, Ishitsuka H. Design of a Novel Oral Fluoropyrimidine
Carbamate, Capecitabine, which Generates 5-Fluorouracil Selectively
in Tumours by Enzmyes Concentrated in Human Liver and Cancer
Tissue. Eur J Cancer 1998; 34: 1274-1281.
- Schü ller J, Cassidy J, Dumont E, Roos B, Durston S, Banken L,
Utoh M, Mori K, Weidekamm E, Reigner B. Preferential activation of
capecitabine in tumor following oral administration to colorectal
cancer patients. Cancer Chemother Pharmacol 2000; 45:
291-297.
- Shomori K, Sakatani T, Goto A, Matsuura T, Kiyonari H, Ito H.
Thymidine phosphorylase expression in human colorectal mucosa,
adenoma and carcinoma: Role of p53 expression. Pathol Int 1999; 49:
491-499.
Poděkování:
Studie byla podpořena grantem IGA MZ ČR 7575-3 a výzkumným záměrem MSMT 111100004, 111100003.
Datum přednesení příspěvku: 26. 5. 2005





