Konference: 2009 XXXIII. Brněnské onkologické dny a XXIII. Konference pro sestry a laboranty
Kategorie: Zhoubné nádory prsu
Téma: V. Onkopatologie
Číslo abstraktu: 054p
Autoři: MUDr. Magdalena Čížková; doc. MUDr. Marián Hajdúch, Ph.D.; MUDr. Kateřina Bouchalová (Špačková), Ph.D.; MUDr. Karel Cwiertka, Ph.D.; prof. MUDr. Zdeněk Kolář, CSc.; RNDr. Radek Trojanec, Ph.D.; Soňa Mlčochová; Mgr. Jana Fürstová; Mgr. Lenka Radová, Ph.D.
Úvod
Triple negativní (TN) karcinom prsu (BrCa) - negativní pro
hormonální receptory (HR) a receptor pro epiteliální růstový faktor
2 (HER2, HER2/neu, c-erbB2) - je podskupina, která zahrnuje asi
10-17% (Rakha et al., 2006; Nishimura et Arima, 2008; Reis-Filho et
Tutt, 2008) případů BrCa. V léčbě tohoto typu nádoru nelze využít
přístupy běžně užívané u dalších podskupin BrCa, jež jsou cílené na
HR a HER2, právě pro negativitu zmíněných receptorů, a zůstává tedy
terapie chirurgická, radiační a chemoterapie. S podporou cílené
biologické léčby by ale tyto léčebné modality mohly přinášet lepší
výsledky, obdobně jak se pozoruje u cílené léčby HR a HER2
pozitivních tumorů. V naší práci se zaměřujeme na cytogenetické
znaky TN BrCa s potenciálním využitím pro zacílení léčby v korelaci
s histopatologickými charakteristikami a klinickými daty zařazených
pacientek.
Materiál a metodika
Do souboru bylo zařazeno 59 pacientek diagnostikovaných s TN BrCa v
letech 1998 - 2004, histologické diagnózy zahrnovaly invazivní
duktální karcinom (IDC), invazivní lobulární karcinom (ILC),
medulární karcinom (MC) a duktální karcinom in situ (DCIS). Na
formalínem fixovaných v parafinu zapuštěných archivovaných
tkáňových řezech z peroperačně odebraných vzorků jsme pomocí metody
fluorescenční in situ hybridizace (FISH) ověřovali negativitu HER2
(současně s počtem kopií chromozómu 17, CH17) a dále vyšetřovali
geny pro receptor epiteliálního růstového faktoru (HER1, EGFR) a
topoizomerázu 2a (TOP2A) ve vztahu k jejich chromozomům 7, resp. 17
(cep7, cepl7) značeným centromerickými sondami. Hodnocení signálů
probíhalo ve 100 nepřekrývajících se jádrech (v případě nedostatku
tkáně minimálně v 60 jádrech). Pro hodnocení amplifikace (A) jsme
použili hranici EGFR/cep7 >1,5, pro polyzomii (P) cep7 > 2,5.
Všechna data byla vyhodnocena standardními statistickými metodami:
byl vypočten Pearsonův, resp. Spearmanův korelační koeficient mezi
jednotlivými proměnnými, dále byla použita ANOVA, a to jak
parametrická tak neparametrická verze (Kruskal-Wallisův test) na
základě rozdělení proměnných. Přežití jednotlivých skupin pacientů
bylo porovnáváno Gehan-Wilcoxonovým testem.
Výsledky
Soubor je charakterizován věkovým rozložením při diagnóze s
nejmladší pacientkou 30 let, nejstarší 791et a mediánem 57 let.
Histopatologická a klinická data shrnují tabulky 1 a 2.
V souboru jsme našli amplifikaci genu HER1 u 20,7% (12/58), z toho
vysoká amplifikace (HERl/cep7 > 2,5) byla přítomna u 3 pacientek
(25%). Polyzomie chromozomu 7 se vyskytla u 22,4% (13/58)
zařazených pacientek. Cytogenetické změny zahrnující EGFR
amplifikaci a polyzomii chromozómu 7 byly nalezeny u 43,1% (25/58)
nemocných. U jedné pacientky (1,7%; 1/58) byla detekována vzácná
delece EGFR, nádor této pacientky vykazoval rovněž amplifikaci
TOP2A. Amplifikace TOP2A se objevily jen u nádorů s
neamplifikovaným (NA) genem EGFR, jednalo se o 6 pacientek (12,8%;
6/47). Vysoká amplifikace TOP2A (TOP2A/cepl7 > 2,5) byla
přítomna u 1 nemocné (16,7%). Delece TOP2A byla nalezena u 3,4%
(2/59) všech pacientek. Počet kopií genu TOP2A vztažený k
centroméře chromozomu 17 vykazoval trend asociace s vyšším počtem
genu HER2 (p=0,0883). Amplifikace TOP2A je u HER2 neamplifikovaných
nádorů popisována vzácně.
Statistická korelační analýza ukázala u EGFR amplifikace tumorů
vyšší grading (G) a vztah k negativitě uzlin v axile (p=0,0179,
resp. P=0,0086) a u EGFR polyzomie trend k výskytu u starších
pacientek (p=0,0741). Statisticky významný (p= 0.0069) vyšel vztah
medulárního karcinomu k nižšímu věku pacientek při diagnóze BrCa. S
rostoucím počtem kopií genu EGFR v buněčných jádrech je ve
statisticky významném vztahu nižší exprese bcl-2 při p=
0.0194.
Analýzy přežití neprokázaly významný rozdíl stavu genu EGFR s
ohledem na léčbu ani další hodnocené parametry.
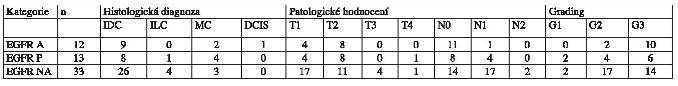
Tab.1 - přehled histopatologických dat zařazených
pacientek, všechny byly primárně nemetastazující s M0
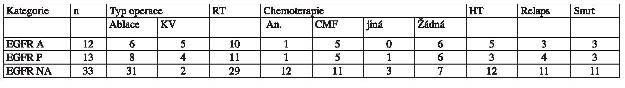
Tab.2 - přehled klinických dat zařazených
pacientek, KV = kvadrandektomie, RT = radioterapie,
An. = antracyklinový režim chemoterapie, CMF =cyklofosfamid +
metotrexát + fluorouracil, HT = hormonální terapie
Závěr
Zvýšený počet kopií genu EGFR způsobený amplifikací nebo polyzomií
je významně asociován s nízkou expresí bcl-2. U EGFR
amplifikovaných tumorů byl nalezen vztah k vyššímu gradingu. Naopak
vztah k peroperační pozitivitě uzlin v axile vyšel negativně a
asocioval NO s EGFR amplifikací. Zmnožení počtu kopií EGFR v
jádrech by tedy mohlo podporovat růst nádoru jako takového bez
podpory jeho metastazování. Analýza přežití neprokázala rozdíly
mezi jednotlivými podskupinami souboru, což může být ovlivněno
různými modalitami léčby, z kterých by některá mohla být
užitečnější pro jednu nebo více podskupin, ale soubor zatím
nezahrnuje dostatek pacientek k prokázání lepších výsledků u
některého z léčebných přístupů. Pro podpoření výsledků
vyzdvihujících chemoterapii CMF a přesnější zhodnocení vlivu
radioterapie je třeba soubor dále rozšířit, aby bylo dosaženo
statistické významnosti. S přihlédnutím k již publikovaným datům
očekáváme lepší výsledky při léčbě CMF (Rakha et al., 2007) a
naopak pravděpodobný spíše negativní vliv radioterapie (Širák et
al., 2008) u EGFR amplifikovaných/polyzomických nemocných.
Amplifikace genu TOP2A se objevují s nízkou frekvencí u triple
negativních karcinomů a EGFR neamplifikovaných tumorů - v našem
souboru u 12,8% (6/47) pacientek. TOP2A je znak, který naznačuje
pravděpodobnou lepší odpověď na léčbu antracykliny, ovšem v našem
souboru tuto léčbu měly pouze 2 z nemocných s TOP2A amplifikací.
Obě z nich přežívají bez známek onemocnění.
Na základě vyšetření genu EGFR jsme identifikovali pacientky, které
by mohly profitovat z cílené léčby zaměřené proti EGFR. Rovněž jsme
nalezli malou skupinu pacientek s amplifikací TOP2A, kde lze
očekávat lepší odpověď na antracykliny.
Literatura:
- Rakha et al. (2006) Basal phenotype identifies a poor prognostic subgroup of breast cancer of clinical importance. Eur J Cancer.
- Nishimura et Arima (2008) Is triple negative a prognostic factor in breast cancer? Breast Cancer.
- Reis-Filho et Tutt (2008) Triple negative tumours: a critical review. Histopathology.
- Rakha et al. (2007) Prognostic Markers in Triple-Negative Breast Cancer. Cancer.
- Širák et al. (2008) Receptor pro epidermální růstový faktor a jeho úloha v radioterapii. Klinická onkologie.
Práce byla podpořena granty MSM6198959216 a LC07017.
Datum přednesení příspěvku: 16. 4. 2009





