Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: Nové nádorové markery a prediktory
Číslo abstraktu: 184p
Autoři: prof. MUDr. Marek Svoboda, Ph.D.; O. Blaštík; prof. MUDr. Tomáš Eckschlager, CSc.; MUDr. Hana Binková, Ph.D.; MUDr. Zuzana Horáková; MUDr. Richard Salzman; prof. MUDr. Elena Tóthová, CSc.; MVDr. Jan Hraběta; Mgr. Ondřej Zítka; Mgr. Jitka Petrlová, Ph.D.; doc.Ing. René Kizek, Ph.D.; doc.RNDr. Vojtěch Adam, Ph.D.
Metalothionein protinádorová terapie; elektrochemické stanovení; cisplatina; mnohočetná rezistence na léčbu; Brdičkova reakce
Úvod
Z řady klinických studií je známo, že rezistence vůči cytostatikům je vážnou komplikací léčby nemocných se zhoubnými nádory[1,2]. Rezistence nádorových buněk k cytostatikům vzniká různými mechanismy a celý proces je na úrovni buňky zcela jistě multifaktoriální. Obzvláště komplikovaná je terapie nádorového onemocnění v případě mnohočetné lékové rezistence (MDR; multidrug resistance). Jednou z příčin rezistence nádorových buněk je snížená koncentrace cytostatik v místě cíle působení léčiva. Na změny hladiny cytostatik v buňkách se podílí některé membránové proteiny jako Pgp, MRP a LRP. Pgp je membránový fosfoglykoprotein s ATPázovou aktivitou, který se nachází v cytoplazmatické membráně. S tímto proteinem byla asociována MDR rezistence především na vinca alkaloidy, antracykliny, taxany a epipodofylotoxiny. Dalším významným je protein MRP (membránový transportní protein), který se nachází v cytoplazmatické membráně i membránách uvnitř buňky. Úroveň exprese MRP v nádorových buňkách se liší od exprese v normálních buněčných typech, což naznačuje buď změněnou funkci nebo aktivitu v rezistentních nádorových buňkách. Pro vznik MDR rezistence je také významný cytosolový protein LRP[3-5]. Funkce LRP zatím není plně vysvětlena. Lze předpokládat, že LRP umožňuje ukládání cytostatik v buňce do vezikulů či lysozomů. Zajímavé je také to, že většinu těchto receptorů blokují flavonodiní sloučeniny jako genistein. Rezistence k inhibitorům topoizomeráz je často způsobena i změnou jejich cíle – topoizomeráz. Mechanizmus účinku těchto látek spočívá ve stabilizaci štěpného komplexu, a tím inhibici opětovného spojení rozštěpené DNA. Složitost vzniku MDR dokládají i změny řady genů účastnících se apoptózy nebo nádorových supresorů. Takovým supresorem je rodina proteinů Bcl-2, jejichž změněná exprese byla nalezena v mnoha chemorezistentních nádorových buňkách. Velice často jsou v nádorových buňkách poškozeny geny, které se účastní regulace buněčného cyklu. To zvyšuje aktivitu cyklin dependentních kináz a vyvolá nekontrolovanou proliferaci. Je známo, že v některých rezistentních nádorových buňkách je poškozena funkce nádorových supresorů například protein p53. V neposlední řadě je možné vznik MDR rezistence spojit se zvýšenou činností reparačních mechanizmů DNA. Cytostatika indukující různé primární změny v molekule DNA (např. cisplatina se vmezeřuje mezi dva guaniny v DNA). Léčebný efekt může být právě potlačen vlivem oprav reparačními enzymy. Z hlediska výsledku reparačního procesu je možné sledovat různé mechanismy reparací: reverze poškození DNA, excizní reparace DNA a inducibilní reparační mechanizmy související s tzv. SOS reparací. Dalším faktorem MDR rezistence může být přímá detoxikace cytostatik. Nejčastěji je zvýšena aktivita enzymů, které xenobiotika oxidují či konjugují s endogenními konjugačními činidly. Enzymy oxidující xenobiotika tvoří početnou skupinu, z nichž největší roli hrají mikrosomální monooxygenázy. Ke konjugačním enzymům inaktivujícím cytostatika konjugací s endogenními substráty patří zejména glutation-S-transferázy. Právě glutationtransferázový systém byl rozsáhle studován v souvislosti s rezistencí k cytostatikům u leukemických buněk.[6-8] Kromě výše uvedených mechanismů je možné spojovat vznik MDR rezistence se zvýšenou expresí nízkomolekulárního proteinu metalothioneinu (MT). Biologickou funkcí MT je vazba a homeostáza iontů kovů v organismech. O molekulárním mechanismu exprese MT je prozatím známo velmi málo, ale pravděpodobně se ho účastní samotný kov vazbou na specifický transkripční faktor, protein označený jako metal transription factor 1 (MTF-1). Komplex kov-MTF-1 pak v jádře nasedá na metal-responsive element (MRE) v promotorové oblasti MT-genu a spouští jeho transkripci [9-11]. Mimo jiné v okamžiku, kdy se v organismu objeví externě podaný kov (např. protinádorové léčivo) rychle narůstá koncentrace MT [12,13]. Exprimovaný MT začne okamžitě vyvazovat námi podávané protinádorové léčivo. Výsledkem je prudký pokles koncentrace léčiva pod účinnou hladinu [12,13].
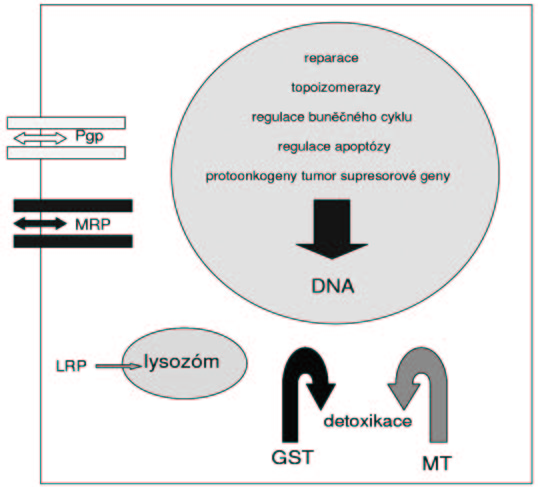
Obr. 1.
Možné buněčné mechanizmy účastnící se procesu rezistence nádorových buněk vůči cytostatikům;
Pgp = membránový fosfoglykoprotein,
MRP = membránový transportní protein,
LRP = cytosolový protein,
Bcl-2 = protiapopetický protein,
GST = glutation-S-transferázy,
MT = metalothionein
Materiál a Metody
Buněčné linie
Neuroblastomové buněčné linie byly odvozeny od metastáz neuroblastomů do kostní dřeně u pacientů v relapsu onemocnění. Jednotlivé rezistentní linie byly připraveny kultivací ve zvyšující se koncentraci cisplatiny. Buňky byly kultivovány v IMDM médiu s 10% fetálního telecího séra při 37°C, chemorezistetní linie byly kultivovány v mediu s přídavkem cisplatiny [14].
Příprava vzorků pro elektroanalytické stanovení metalothioneinu
Ze získaných vzorků krevních sér bylo odebráno 100 µl a umístěno na 15 min. při 99°C do termobloku (Eppendorf 5430, USA). Poté byly vzorky ochlazeny na 4°C a centrifugovány při 4°C, 15 000 g po dobu 30 min. (Eppendorf 5402, USA). Metalothioneiny patří k termostabilním proteinům, které zůstávají přítomné v roztoku i po jeho tepelné denaturaci [15,16]. Takto připravené vzorky byly analyzovány námi upraveným postupem adsorptivní přenosové techniky (AdTS) s diferenční pulsní voltametrií (DPV) [17]. Množství analyzovaného vzorku bylo 5 µl.
Elektroanalytické stanovení metalothioneinu pomocí Brdičkovy reakce metodou AdTS DPV
Vzorky byly analyzovány na přístroji AUTOLAB Analyser (EcoChemie, Netherlands) ve spojení s VA-Stand 663 (Metrohm, Switzerland) v klasickém tříelektrodovém uspořádání. Pracovní elektrodou byla visící rtuťová kapková elektroda (HMDE) s plochou kapky 0,4 mm2 referenční elektrodou byla Ag/AgCl/3M KCl a pomocnou grafitová elektroda. Základní elektrolyt (1 mmol.dm-3 Co(NH3)6Cl3 a 1 mol.dm-3 amonný pufr NH3(aq) + NH4Cl (Sigma Aldrich, ACS), pH = 9,6) byl po každých 5 analýzách vyměněn [15]. AdTS DPV parametry byly následující: čas akumulace 120 s, počáteční potenciál -0,6 V, konečný potenciál -1,6 V, modulační čas 0,057 s, časový interval 0,2 s, potenciálový krok 1,05 mV/s, modulační amplituda 250 mV, Eads = 0 V, teplota 20°C [18].
Stanovení esterásové aktivity
Kultura byla ošetřena trypsinem po dobu 2 minut a následným protřepáním (60 ot/min) pro uvolnění přisedlých buněk. Buňky byly separovány centrifugací (50 g, 5 min) a 1x promyta PBS (pH 7,4). Lýze buněk byla provedena na ledové lázni přídavkem Tritonu X100 do výsledné koncentrace 0,1 % (v/v) po dobu 20 min. Mechanické nečistoty z lyzátu byly odstraněny centrifugací (10 000 g, 15 min, 4°C). Supernatant byl po skončení centrifugace ihned zpracován. Stanovení intracelulárních esteras bylo provedeno fluoresceindiacetátovým testem pode [20,21] s těmito modifikacemi: pro inkubaci reakční směsi byla zvolena teplota 37°C. Hodnota celkových proteinů byla stanovena podle Bradforda. Buněčná hustota (počet buněk na 1 ml suspenze) byla stanovena pomocí Fuchs-Rosenthalovy počítací komůrky.
Výsledky a diskuse
Naše práce se zaměřuje na studium úlohy metalothioneinu v procesu vzniku MDR rezistence vůči cytostatikům na bázi platiny. Byly použity buněčné linie rezistentní k cis-platině. V předešlé práci byly jednotlivé buněčné linie charakterizovány z hlediska chromozomálních aberací [14]. Nyní jsme charakterizovali buněčné linie v závislosti na aktivitě intracelulárních esterás [20]. V experimentu byla testována možnost uskutečnit detekci počtu živých buněk ve vzorcích neuroblastomových buněčných linií. Na základě známého počtu buněk, které byly homogenizovány v daném objemu, byly do reakční směsi pro stanovení intracelulárních esteras vnášeny ekvivalenty počtu buněk v rozmezí 0 až 7000. U senzitivních buněčných linií byla aktivita esterás výrazně vyšší v porovnání s kulturou rezistentní buněčné linie. Detekovaná aktivita intracelulárních esteras byla přímo úměrná počtu buněk a limit detekce byl asi kolem 600 buněk pro senzitivní neuroblastomové kultury a asi kolem 1000 buněk pro rezistentní buněčné kultury. Dále byla sledována změna hladiny metalohioneinu u těchto linií pomocí námi navrženého elektroanalytického stanovení [22]. Z našich předešlých experimentálních prací je zřejmé, že interakce mezi platinovým léčivem a metalothioneinem je poměrně silná [23-25]. Výsledky ukazují, že u linií rezistentních k cisplatině je obsah MT několikanásobně vyšší.
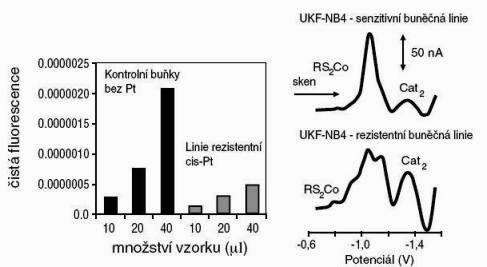
Obr. 2.:
Aktivita intracelulárních esteráz a hladina metalothioneinu u senzitivní a rezistentní neuroblastomové buněč né linie. Esterásová aktivita byla určena fluorimetricky a množství MT bylo analyzováno pomocí Brdičkovy reakce [15].
Závěr
Pro řešení vzniklého problému MDR rezistence související s hladinou MT bylo navrženo několik možných postupů. Jednou z možností je blokovat syntézu MT proteinu využitím antisense mRNA (protismyslné RNA). Tato molekula vytvoří s mRNA metalothioneinu komplex, který je z organismu velmi rychle odbouráván. Proto nestoupají hladiny MT v organismu a podané léčivo může intenzivněji působit v nádorové tkáni. Tento způsob byl již experimentálně ověřován. Zbylé způsoby jsou zatím jen možnou cestou kam se vydat při řešení tak složité otázky. Nabízí se vytvoření nefunkčního genu, který bude blokovat syntézu MT, případně reparační mechanismy buňky. Další možností je pokusit se vzniklý protein degradovat specifickou proteázou nebo se pokusit jej vyvazovat dalším kovem např. zinkem či mědí [7,26-28].
Poděkování
Příspěvek vznikl za podpory grantů RASO 8/2005, GAČR 525/04/P132 a MSMT č .0021620813. Dále autoři dě kují za pomoc při analýze esteráz Dr. Vítečkovi a Dr. Petřekovi.
Literatura
- Lindgren, M., Rosenthal-Aizman, K., Saar, K., Eiriksdottir, E.,
Jiang, Y., Sassian, M., Ostlund, P., Hallbrink, M., and Langel, U.
(2006). Overcoming methotrexate resistance in breast cancer tumour
cells by the use of a new cell-penetrating peptide. Biochemical
Pharmacology 71, 416-425.
- Logashenko, E.B., Vladimirova, A.V., Zenkov, A.N., Repkova,
M.N., Ven’yaminova, A.G., Chernolovskaya, E.L., and Vlassov, V.V.
(2005). Reversion of the multiple-drug resistance phenotype
mediated by short interfering RNAs. Russian Chemical Bulletin 54,
1298-1305.
- Rihova, B., Strohalm, J., Kovar, M., Mrkvan, T., Subr, V.,
Hovorka, O., Sirova, M., Rozprimova, L., Kubackova, K., and
Ulbrich, K. (2005). Induction of systemic antitumour resistance
with targeted polymers. Scandinavian Journal of Immunology 62,
100-105.
- Hoffmann, U., and Kroemer, H.K. (2004). The ABC transporters
MDR1 and MRP2: Multiple functions in disposition of xenobiotics and
drug resistance. Drug Metabolism Reviews 36, 669-701.
- Dollner, R., Granzow, C., Werner, J.A., and Dietz, A. (2004).
Is there a role for chemosensitivity tests in head and neck cancer?
Onkologie 27, 310-315.
- Skorski, T. (2002). Oncogenic tyrosine kinases and the
DNA-damage response. Nature Reviews Cancer 2, 351-360.
- Volm, M. (1998). Multidrug resistance and its reversal.
Anticancer Research 18, 2905-2917.
- Vendrik, C.P.J., Bergers, J.J., Dejong, W.H., and Steerenberg,
P.A. (1992). Resistance to Cytostatic Drugs at the Cellular-Level.
Cancer Chemotherapy and Pharmacology 29, 413-429.
- Cai, L., Li, X.K., Song, Y., and Cherian, M.G. (2005).
Essentiality, toxicology and chelation therapy of zinc and copper.
Current Medicinal Chemistry 12, 2753-2763.
- Goodman, V.L., Brewer, G.J., and Merajver, S.D. (2005). Control
of copper status for cancer therapy. Current Cancer Drug
Targets 5, 543-549. - Il’yasova, D., and Schwartz, G.G. (2005). Cadmium and renal
cancer. Toxicology and Applied Pharmacology 207,
179-186.
- Kizek, R., Vacek, J., Adam, V., and Vojtesek, B. (2004). Vztah
metalothioneinu k rakovine a protinadorove lecbe. Klin. Biochem.
Metab. 12, 72-78.
- Zelena, J., Potesil, D., Vacek, J., Adam, V., Hradecky, J.,
Prusa, R., Kizek, R., and Vojtesek, B. (2004). Metalothionein jako
prognosticky marker nadoroveho onemocneni. Klinická onkologie 17,
190-195.
- Bedrnicek, J., Vicha, A., Jarosova, M., Holzerova, M., Cinatl,
J., Michaelis, M., and Eckschlager, T. (2005). Characterization of
drug-resistant neuroblastoma cell lines by comparative genomic
hybridization. Neoplasma 52, 415-419.
- Petrlova, J., Potesil, D., Mikelova, R., Blastik, O., Adam, V.,
Trnkova, L., Jelen, F., Prusa, R., Kukacka, J., and Kizek, R.
(2006). Attomole voltammetric determination of metallothionein. Electrochim. Acta in press. - Prusa, R., Blastik, O., Kukacka, J., Kizek, R., and
Stuchlikova, H. (2005). Plasma metallothionein levels in lead
poisoned child. Toxicol. Lett. 158, S156-S157.
- Prusa, R., Blastik, O., Kukacka, J., Zehnalek, J., Adam, V.,
Petrlova, J., and Kizek, R. (2005). The influence of platinum-based
drugs on the amount of metallothionein. Toxicol. Lett. 158,
S66-S67.
- Petrlova, J., Blastik, O., Prusa, R., Kukacka, J., Mikelova,
R., Stiborova, M., Vojtesek, B., Adam, V., Zitka, O., Eckschlager,
T., and Kizek, R. (2006). Analýza obsahu metatothioneinu u pacientů
se zhoubným nádorem prsu, tlustého střeva a nebo melanomem. Klin.
Onkol. 19, in press.
- Kizek, R., Trnkova, L., and Palecek, E. (2001). Determination
of metallothionein at the femtomole level by constant current
stripping chronopotentiometry. Anal. Chem. 73,
4801-4807.
- Vitecek, J., Adam, V., Petrek, J., Babula, P., Novotna, P.,
Kizek, R., and Havel, L. (2005). Application of fluorimetric
determination of esterases in plant material. Chemicke Listy 99,
496-501.
- Vitecek, J., Adam, V., Petrek, J., Vacek, J., Kizek, R., and
Havel, L. (2004). Esterases as a marker for growth of BY-2 tobacco
cells and early somatic embryos of the Norway spruce. Plant Cell
Tissue and Organ Culture 79, 195-201.
- Petrlova, J., Blastik, O., Zitka, O., Adam, V., Potesil, D.,
Mikelova, R., Prusa, R., Stiborova, M., Trnkova, L., Zehnalek, J.,
and Kizek, R. (2005). An electrochemical study of metallothionein
as a potential tumour disease marker. Annals the Polisch Chemical
Society in press.
- Adam, V., Zehnalek, J., Petrlova, J., Potesil, D., Sures, B.,
Trnkova, L., Jelen, F., Vitecek, J., and Kizek, R. (2005).
Phytochelatin modified electrode surface as a sensitive heavy-metal
ion biosensor. Sensors 5, 70-84.
- Adam, V., Petrlova, J., Potesil, D., Lubal, P., Zehnalek, J.,
Sures, B., and Kizek, R. (2005). New electrochemical biosensor to
determine platinum cytostatics to DNA structure. Chemicke Listy 99,
353-393.
- Adam, V., Petrlova, J., Potesil, D., Zehnalek, J., Sures, B.,
Trnkova, L., Jelen, F., and Kizek, R. (2005). Study of
metallothionein modified electrode surface behavior in the presence
of heavy metal ions-biosensor. Electroanalysis 17,
1649-1657.
- Kennette, W., Collins, O.M., Zalups, R.K., and Koropatnick, J.
(2005). Basal and zinc-induced metallothionein in resistance to
cadmium, cisplatin, zinc, and tertButyl hydroperoxide: Studies
using MT knockout and antisense-downregulated MT in mammalian
cells. Toxicological Sciences 88, 602-613.
- Jason, T.L.H., Koropatnick, J., and Berg, R.W. (2004).
Toxicology of antisense therapeutics. Toxicology and Applied
Pharmacology 201, 66-83.
- Ling, W.H., Lin, Z.N., Lin, Y.C., Xu, G.N., Zhao, X.L., and Zhuang, Z.X. (2004). Effects of metallothionein antisense oligonucleotide on the inducible cytotoxicity in cadmium-treated human nasopharyngeal carcinoma CNE1 cell line. Toxicology and Applied Pharmacology 197, 238-238.
Datum přednesení příspěvku: 11. 5. 2006





