Konference: 2005 XXIX. Brněnské onkologické dny a XIX. Konference pro sestry a laboranty
Kategorie: Mnohočetný myelom
Téma: Nádorová imunologie a imunoterapie
Číslo abstraktu: 191
Autoři: Mgr. Darina Očadlíková; Mgr. Lucie Říhová, PhD.; prof. MUDr. Roman Hájek, CSc.; Prof. MUDr. Jaroslav Michálek, Ph.D.
1.1. Význam buněčné imunoterapie v léčbě mnohočetného myelomu
Mnohočetný myelom (MM) je onemocnění charakterizované neoplastickou klonální proliferací plazmatických buněk a jejich akumulací v kostní dřeni(1). Incidence MM činí přibližně 4 nemocní na 100 000 obyvatel s mediánem věku v době diagnózy nad 60 let(2,3). Medián celkového dlouhodobého přežití je 4-5 let, je-li pacient léčen vysokodávkovanou terapií a autologní transplantací(2). Autologní transplantace kmenových buněk kombinovaná s vysokodávkovaným melfalanem je v současné době považována za standardní terapii. Další možnost představuje také alogenní transplantace kmenových krvetvorných buněk označovaných jako reakce štěpu proti myelomu (graft-versus-myeloma; GVM)(4). V organismu však zůstává zbytkové nádorové onemocnění a relaps je zpravidla neodvratný. MM je považován za onemocnění nevyléčitelné ((1), a proto jsou hledány nové cesty, jak zlepšit jeho prognózu.
Jednu z nich představuje protinádorová imunoterapie, která zaznamenala značný úspěch u melanomu a renálního karcinomu(5,6). V posledním desetiletí byly rovněž podány experimentální důkazy o možnostech navození imunitní reaktivity i vůči méně imunogenním nádorům včetně MM(4,7,8). Imunitní systém může být aktivován specifickými nádorovými antigeny, zpravidla prostřednictvím dendritických buněk (DB). DB jsou naloženy specifickým nádorovým antigenem, který prezentují T-lymfocytům. Sehrávají tak klíčovou úlohu v indukci specifických protinádorových T-lymfocytů schopných cíleně zabíjet nádorové buňky(9). U MM byly využity DB ve spojení s myelom-specifickým antigenem, tzv. Id-proteinem nebo lyzátem z nádorových buněk(10,11). V současné době jsou testovány různé druhy potenciálních nádorových antigenů, mezi nimi i nádorově-specifické peptidy.
1.2. Katalytická podjednotka telomerázy hTERT jako nádorový antigen
Většina popsaných tumor-asociovaných antigenů (TAA) je exprimována u jednoho či několika málo typů nádorů, existují však tzv. univerzální TAA, které jsou exprimovány mnoha nádory. Jedním z nich je i katalytická podjednotka telomerázy (hTERT). hTERT je katalytická podjednotka enzymu telomerázy, jejímž úkolem je syntéza koncových úseků eukaryotických chromozómů-telomer(12,13). V naprosté většině normálních diferencovaných lidských buněk je telomerázová aktivita potlačena, a v důsledku toho je jejich replikační kapacita omezena. Naproti tomu nádorové buňky vykazují telomerázovou aktivitu, což je činí v podstatě nesmrtelnými. Existuje velmi úzká korelace mezi aktivitou telomerázy a maligním potenciálem nádorových buněk(14).
Bylo prokázáno, že hTERT, resp. HLA-I-specifický nonapeptid I540 odvozený od hTERT je exprimován u MM a je schopen indukovat antigen-specifickou odpověď CTL. Jeden z nich je také exprimován u MM a je schopen indukovat specifickou odpověď CD8+ cytotoxických T-lymfocytů (CTL)(15,16). Nedávno byly zahájeny klinické aplikace protinádorových vakcín využívajících hTERT jako nádorového antigenu (17). Po opakované stimulaci T-lymfocytů peptidem odvozeným od hTERT naloženým do DB dochází k jejich aktivaci, kterou lze standardně měřit pomocí produkce g)interferonu gama (IFN-γ. Cílem této studie byla identifikace specifických protinádorových T-lymfocytů, které lze separovat a expandovat in vitro.
2. Materiál a metoda
2.1. Buněčné kultury
Mononukleární buňky (MN) byly izolovány z nesrážlivé periferní krve (PK) zdravých dárců z transfuzní stanice ve FN Brno po podepsání informovaného souhlasu metodou gradientové centrifugace (Histopaque 1077, Sigma-Aldrich, Praha, Česká republika) a kultivovány v médiu obsahujícím X-VIVO 10 (BioWhittaker, Walkersville, MD, USA) s 80U/ml DNAsy (Boehringer, Mannheim, Německo) a 1mM L-glutaminu (Sigma-Aldrich, Praha, Česká republika) v 6-jamkových miskách při 37°C v atmosféře 5% CO2 a 4,5% O2. Iniciální buněčnost byla 3,3x106 buněk/ml tohoto média.
Po 2-hodinové kultivaci byla suspenze rozdělena na adherentní a neadherentní frakci. Byl odebrán supernatant s neadherentní frakcí bohatou na T-lymfocyty a tyto buňky byly kultivovány v kompletním médiu (KM) obsahujícím X-VIVO 15, 50mg/l gentamycin, 2mM L-glutamin, 25mM hepes pufr (BioWhittaker, Walkersville, MD, USA), 10% lidské AB-sérum (Sigma-Aldrich, Praha, Česká republika) a 10 IU/ml interleukinu 2 (IL-2) (Proleukin, Chiron, Amsterdam, Holandsko) po dobu 7 dnů při 37 °C v atmosféře 5% CO2.
Adherentní frakce bohatá na prekurzory DB byla dále kultivována v médiu pro DB: X-VIVO 10 (BioWhittaker, Walkersville, MD, USA) se 100 ng/ml interleukinu 4 (IL-4) (Sigma-Aldrich, Praha, Česká republika), 800 U/ml granulocyty a makrofágy stimulujícím faktorem (GM-CSF) (Schering Plough, New Yersey, USA) a 40 ng/ml tumor-nekrotizujícím faktorem alfa (TNF–α) (Bender Medsystems Diagnostics, Vídeň, Rakousko) po dobu 6 dnů při 37 °C v atmosféře 5% CO2 a 4,5% O2. Médium pro DB včetně IL-4, GM-CSF a TNF-α bylo měněno každé 2 dny(18,19).
2.2. Příprava antigenu
Jako antigen byl využit nonapeptid I540 odvozený od hTERT s aminokyselinovou sekvencí ILAKFLHWL (Clinalfa, Läufelfingen, Švýcarsko) a specificitou vůči HLA-A2 třídě. Pracovní roztok byl připraven rozpuštěním 274,4 g nonapeptidu hTERT v 1 ml sterilní vody pro tkáňové kultury. hTERT byla k DB přidávána ve formě takto připraveného pracovního roztoku. Jako negativní kontrola byl využit nonapeptid 476ILKEPVHGV484 odvozený od HIV-1 reverzní transkriptázy (HIV-1) (Clinalfa, Läufelfingen, Švýcarsko) vázající se rovněž na alelu HLA-A2 (20). Pracovní roztok byl připraven rozpuštěním 249,0 µg nonapeptidu HIV-1 v 1 ml sterilní vody pro tkáňové kultury a v této formě byl přidáván k DB.
2.3. Naložení DB nádorovým antigenem
7. den kultivace byly DB naloženy nonapeptidem hTERT či referenčním peptidem HIV-1 ve formě pracovního roztoku (viz 2.2.) (15) v množství 20 µg peptidu/200 000 DB(20).
2.4. Stimulace a restimulace T-lymfocytů
8. den kultivace byly naložené DB smíchány s T-lymfocyty v poměru 20:1 (T-lymfocyt:DB). Část DB byla zamražena a uchovávána při –80°C pro pozdější restimulaci. DB byly 2 hod před restimulací kultivovány v KM. Restimulace byla prováděna naloženými DB v restimulačním poměru 2:1 (T-lymfocyt:DB)(19).
2.5. Značení pomocí interferonu gama
Antigenem aktivované T-lymfocyty produkující IFNbyly zhodnoceny pomocí Secretion Assay Cell Enrichment And Detection Kit (MACS Reagens, Miltenyi Biotec, Bergisch Gladbach, Německo) podle pokynů výrobce (19,21).Stejným způsobem byly zpracovány i T-lymfocyty stimulované DB naloženými HIV-1 peptidem.
2.6. Průtoková cytometrie:
T-lymfocyty (1x106) po restimulaci naloženými DB byly inkubovány 15 minut s monoklonálními protilátkami anti-CD4 značenými fluoroisothiokyanátem (FITC), anti-CD8 FITC, anti-CD3 phycoerythrin-cyaninem (PE-Cy) (Immunotech, Marseille, Francie) a s anti-IFN-γ phycoerythrinem (PE) (Miltenyi Biotec, Bergisch Gladbach, Německo). T-lymfocyty byly analyzovány na průtokovém cytometru CytomicsTM FC 500 (Beckman Coulter, Miami, Florida, USA). Jako negativní kontrola byly využity nestimulované T-lymfocyty.
3. Výsledky a diskuse
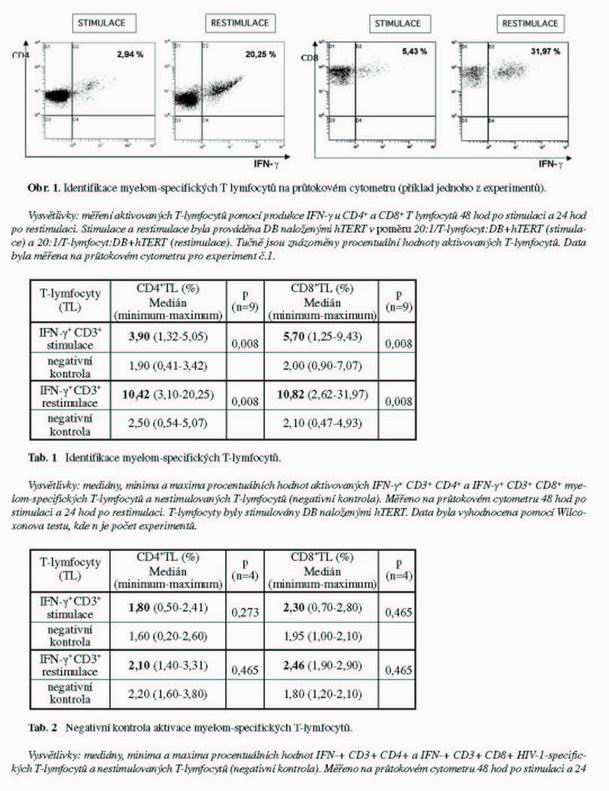
Na základě dříve publikovaných optimalizačních experimentů (19) byla provedena stimulace a restimulace T-lymfocytů DB naloženými nonapeptidem hTERT. 48 hod po stimulaci a 24 hod po restimulaci byla provedena identifikace protinádorových myelom-specifických T-lymfocytů(19) na průtokovém cytometru (obr.1).
Produkce IFN-γ aktivovanými T-lymfocyty byla 3,90% (medián) pro CD4+ T-lymfocyty a 5,70% pro CD8+ T-lymfocyty stimulované DB naloženými hTERT nonapeptidem, zatímco pro nestimulované T-lymfocyty byla 1,90% resp. 2,00% pro CD4+ resp. CD8+ T-lymfocyty. Statistická významnost aktivace stimulovaných T-lymfocytů vůči nestimulovaným je p=0,008 pro CD4+ i CD8+ T-lymfocyty. Po restimulaci došlo k výraznému zvýšení aktivace na 10,42% resp. 10,82% pro CD4+ resp. CD8+ T-lymfocyty restimulované DB naloženými hTERT nonapeptidem, zatímco pro nestimulované T-lymfocyty byla 2,50% pro CD4+ a 2,10% pro CD8+ T-lymfocyty. Statistická významnost aktivace restimulovaných T-lymfocytů vůči nestimulovaným je p=0,008 pro CD4+ i CD8+ T-lymfocyty (tab.1).
Pro důkaz specifické aktivace hTERT nonapeptidem bylo využito srovnání s HLA-A2 specifickým nestimulujícím peptidem HIV-1. Medián produkce IFN-γ pro CD4+ resp. CD8+ T-lymfocyty po stimulaci pomocí DB naložených HIV-1 peptidem byl 1,80% resp. 2,30% oproti mediánům produkce IFN-γ pro nestimulované T-lymfocyty: 1,60% a 1,95% (CD4+ a CD8+). Pro restimulované CD4+ a CD8+ T-lymfocyty byly hodnoty mediánů obdobné: 2,10% a 2,46% oproti mediánům produkce IFN-γ pro nestimulované T-lymfocyty: 2,20% a 1,80%. Statistická významnost aktivace CD4+ resp. CD8+ T-lymfocytů restimulovaných HIV-1 peptidem vůči T-lymfocytům nestimulovaným je p=0,273 resp. 0,465, pro restimulované T-lymfocyty je p=0,465 pro CD4+ i pro CD8+ (tab. 2).
Antigen hTERT je specifický pro HLA-A2 alelu a tedy aktivaci CD8+ T-lymfocytů(12). Výsledky ukázaly, že při stimulaci T-lymfocytů DB naloženými hTERT dochází k jejich významné aktivaci oproti nestimulovaným T-lymfocytům nebo T-lymfocytům stimulovaným DB naloženými HLA-A2 specifickým nestimulujícím referenčním peptidem HIV-1. Nejsilnější odpověď T-lymfocytů aktivovaných DB s hTERT byla zaznamenána u CD8+ T-lymfocytů po restimulaci: 10,35% (medián), což je dáno specificitou peptidu pro HLA-A2. Rovněž došlo k aktivaci CD4+ T-lymfocytů na 9,88% po restimulaci, což ukazuje na možnost zkřížené prezentace antigenu DB CD4+ T-lymfocytům.
Naměřené výsledky jsou v souladu s publikovanými pracemi(21,22), které rovněž ukázaly možnost identifikace protinádorových T-lymfocytů při využití proteinů jako TAA.
4. Závěr
MM je nevyléčitelné onemocnění. Jednou z možností jak zlepšit jeho prognózu je protinádorová imunoterapie založená na schopnostech DB účinně předkládat nádorový antigen T-lymfocytům a indukovat tak protinádorovou imunitní odpověď. Tato práce byla zaměřena na identifikaci myelom-specifických T-lymfocytů in vitro. Aktivace byla provedena nádorově specifickým nonapeptidem hTERT. Myelom-specifické aktivované T-lymfocyty byly identifikovány na základě sekrece IFN-γ na průtokovém cytometru. Využití hTERT jako nádorového antigenu pro aktivaci myelom-specifických T-lymfocytů a příprava protinádorové vakcíny by mohly být novým přínosem v léčbě MM.
Částečně podporováno z grantu IGA MZČR NR 7475-3
Literatura
- Adam Z., Hájek R., Ščudla V, a kol. Mnohočetný myelom a další
monoklonální gamapatie. Masarykova Univerzita Brno 1999;
1-260.
- Adam Z, Vorlíček J, Králová E, a kol. Terapie mnohočetného
myelomu (Therapy of multiple myeloma). Masaryk University Brno,
1993: 1-220.
- Kyle RA. Multiple myeloma: review of 869 cases. Mayo Clin Proc
1975; 50: 29-40.
- Barlogie B, Shaughnessy J, Tricot G, et al. Treatment of
multiple myeloma. Blood 2004; 1: 20-32.
- Thumer B, Haendle I, Roder C, et al. Vaccination with mage-3A1
peptide-pulsed mature, monocyte-derived dendritic cells expands
cytotoxic T cells and induces regression of some metastases in
advanced stage IV melanoma. J Exp Med 1999; 190:
1669-1678.
- Advances in immune-based therapies of renal cell carcinoma.
Expert Rev Anticancer Ther 2004; 4: 1081-1096.
- Greipp PR, Witzig T. Biology and treatment of myeloma. Curr.
Opin. Oncol.1996; 8: 20-27.
- Yi Q, Österborg A. Idiotype-specific T cells in multiple
myeloma:targets for an immunotherapeutic intervention?.
Med.Oncol
1996; 13: 1-7. - Bü chler T, Hajek R. Dendritic cell vaccines in the treatment
of multiple myeloma. Med Oncol 2002; 19: 213-308.
- Yi Q, Desikan R, Barlogie B, Munshi N. Optimizing dendritic
cells-based immunotherapy in multiple myeloma. Br J Hematol 2002;
117: 297-305.
- Wen YJ, Min R, Tricot G, et al. Tumor lysate-specific cytotoxic
T lymphocytes in multiple myeloma-promissing effector cells for
immunotherapy. Blood 2002; 99: 3280-3285.
- Minev B, Hipp J, Firat H, Schmidt JD, Demoyen PL, Zanetti M.
Cytotoxic T cell immunity against telomerase reverse transcriptase
in humans. PNAS 2000; 97: 4796-4801.
- Fajkus J. Jak začínají a končí chromozomy, rub a líc buněčné
nesmrtelnosti. Živa 2002; 6:245-248.
- Shay JW, Bacchetti S. A survey of telomerase activity in human
cancer. Eur J Cancer 1997; 33: 787-791.
- Vonderheide RH, Hahn WC, Schultze JL, Nadler LM. The telomerase
catalytic subunit is a widely expressed tumor-associated antigen
recognized by cytotoxic T lymphocytes. Immunity 1999; 10:
673-690.
- Xu D, Zheng C, Bergenbrant S, et al. Telomerase activity in
plasma cell dyscrasias. Br J Cancer 2001; 84: 621-625.
- Schultze JL, Maecker B, Von Bergvelt-Baildon MS, et al. Tumor
immunotherapy: new tools, new treatment modalities and new T-cell
antigens. Vox Saguinis 2001; 80: 81-89.
- Büchler T, Hájek R, Bourková L, a kol. Generation of
antigen-loaded dendritic cells in a serum-free medium using
different cytokine combinations. Vaccine 2003; 21:
877-882.
- Očadlíková D, Kovářová L, Vidláková P, a kol. Identifikace
myelom-specifických T-lymfocytů na základě produkce interferonu
gama. Edukační sborník XXVIII. Brněnské onkologické dny a XVIII.
Konference pro sestry a laboranty 26.-28. května 2004; 53:
113-116.
- Brossart P, Wirths S, Stuhler G, et al. Induction of cytotoxic
T-lymphocyte responses in vivo after vaccinations with
peptidepulsed dendritic cells. Blood 2000; 96:
3102-3108.
- Beckove H, Witzens M, Choi C, et al. MUC-1-reactive cytotoxic
memory T cells in bone marrow of multiple myeloma patients. The
44th Annual Meeting of the American Society of Hematology 2003;
Blood, abstract 5227.
- Yi Q, Qian J, Xie J, et al. Generation of tumor-specific cytotoxic T lymphocytes in multiple myeloma using dendritic cells pulsed with tumor-derived heat shock protein gp96. The 44th Annual Meeting of the American Society of Hematology 2004; Blood, abstract 2451.
Datum přednesení příspěvku: 26. 5. 2005





