Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Nádory dětského a adolescentního věku; Onkologická diagnostika; zhoubné nádory mozku a CNS
Téma: Nádory dětí a adolescentů
Číslo abstraktu: 083
Autoři: MUDr. Aleš Vícha; Markéta Cháňová; Prof. RNDr. Mgr. Marie Jarošová, CSc.; RNDr. Milena Holzerová, Ph.D.; MUDr. Pavel Procházka; prof. MUDr. Tomáš Eckschlager, CSc.
Na vzniku nádorů se významně podílí změny chromozomů a genů.
Řada chromozomálních aberací a genových mutací postihujících
nádorovou buňku je specifická pro určité nádory nebo jejich
varianty. Jejich průkaz se proto využívá v diagnostice a
klasifikaci některých nádorů. V současnosti je již postupem non
legee artis, pokud není provedeno cytogenetické a/nebo molekulárně
genetické vyšetření nádorových buněk leukemií a lymfomů a jejich
význam stoupá i u pacientů se solidními nádory. Průkaz specifických
aberací je v současné době již součástí rutinní diagnostiky u řady
zhoubných nádorů. Nejznámějším příkladem je stanovení amplifikace
genu erb-B2 u karcinomu prsu nebo amplifikace genu MYCN u
neuroblastomu. Do budoucna lze předpokládat, že se zaváděním nových
léčebných postupů (genová terapie, směrované léky, inhibitory
signálního přenosu, onkolytické viry aj.) výrazně vzroste význam
cytogenetického, a zvláště molekulárně genetického vyšetření, které
umožní vybrat pacienty vhodné k příslušné terapii.
K vyšetření chromozomálních aberací lze použít několik metod.
Jejich použitelnost uvádí tabulka č . 1. Vyšetření
karyotypu umožňuje prokázat numerické a hrubší
strukturální aberace chromozomů na základě jejich morfologické
změny v mitóze. Hlavní výhoda tohoto vyšetření je v tom, že na
rozdíl od většiny ostatních metod detekuje změny na všech
chromozomech při jednom vyšetření současně. Nedostatky jsou menší
citlivost a relativně častá neúspěšnost. I renomovaná pracoviště
dosahují pouze 40– 60% úspěšnosti klasického cytogenetického
vyšetření solidních nádorů (u akutních leukemií je úspěšnost
vyšší). Podmínkou úspěšného cytogenetického vyšetření jsou dělící
se nádorové buňky. Získat potřebné množství mitóz je obtížné.
Problémem je i to, že získané mitózy nemusí pocházet z nádorových
buněk. Proto se nález normálního karyotypu musí hodnotit obezřetně.
I v době molekulárně genetických metod zůstává cytogenetické
vyšetření základní metodou průkazu chromozomálních změn.
Fluorescenční in situ hybridizace (FISH), její
modifikace multicolor FISH a sky jsou založeny na
hybridizaci DNA sondy značené fluorochromem ke komplementárnímu
úseku DNA ve fixovaných buňkách a její detekci fluorescenčním
mikroskopem.
Sondy jsou různého typu: 1) centromerické –
hybridizují s repetitivními sekvencemi centromerických oblastí a
jsou vhodné ke zjišťování počtu kopií příslušného chromozomu; 2)
hybridizující se specifickými sekvencemi –
detekují amplifikace nebo delece určitých chromozomálních oblastí,
kombinaci dvou různě značených sond lze využít k diagnostice
translokací;3) malovací (painting), což je řada
sond hybridizujících vedle sebe po celé délce jednoho chromozomu
tyto sondy se, na rozdíl od předchozích, které lze využít na
interfazická jádra i na mitózy, aplikují pouze na mitózy. Umožňují
zjistit numerické i strukturální změny konkrétního chromozomu. V
kombinaci jsou malovací sondy vhodné k hodnocení translokací.
Hlavním využitím FISH je průkaz numerických odchylek chromozomů
nebo jejich částí, detekce amplifikací nebo delecí a při použití
dvou sond i translokací. Výhodou interfazické FISH je vyšetření i v
situaci, kdy nelze získat mitózy. Oproti většině molekulárně
biologických metod, které pracují s izolovanou DNA nebo RNA,
vyšetří FISH jednotlivá jádra nádorových buněk samostatně. Zavedení
nových fluorochromů umožnilo mnohobarevnou FISH (mFISH), která
hodnotí více chromozomů najednou – to je zvláště vhodné pro
posuzování komplexních translokací. Jako poslední byla vyvinuta
SKY (spectral karyotyping), která barevně
identifikuje všechny lidské chromozomy současně. Podstatou je
použití dvaceti čtyř malovacích sond proti všem chromozomům. Jinou
modifikací FISH je srovnávací genomová hybridizace
(CGH, comparative genomic hybridization). Normální =
kontrolní a vyšetřovaná DNA jsou každá označena jiným fluorochromem
(kontrolní červeně a nádorová zeleně) a jsou současně hybridizovány
na normální lidské chromozomy v metafázi. Fluorescence se snímá
kamerou a vyhodnocuje počítačem. Poměr intenzit fluorescencí podél
jednotlivých chromozomů určí místa s chyběním nebo nadbytkem DNA.
Tato metoda je ideální ke zjišťování ztráty nebo zmnožení
chromozomů či jejich částí, nelze jí využít k detekci balancovaných
translokací. Výhodou je, že k vyšetření nejsou nutné dělící se
buňky.
Detekce typické chromozomální aberace má význam pro potvrzení
diagnózy. V praxi se jejich cytogenetický nebo molekulární průkaz
využívá hlavně u atypických případů. Sami jsme verifikovali
diagnózu PNETu ledviny průkazem pro tuto skupinu nádorů specifické
translokace t(11;22). Postižení ledviny tímto typem nádoru je velmi
vzácné, jeho chování je agresivnější, než v jiných lokalizacích a v
literatuře bylo dosud popsáno jen několik desítek případů. U jiného
pacienta jsme upřesnili diagnózu nádoru mediastina. Histologické
vyšetření prokázalo rabdomyosarkom. Ovšem zvýšené hladiny AFP a
odpověď na terapii používanou k léčbě germinálních nádorů svědčily
pro germinální původ nádoru. Průkaz zmnožení materiálu krátkého
raménka 12. chromozomu metodou CGH v naší laboratoři nakonec
potvrdil diagnózu germinální nádoru s transformací do
rabdomyosarkomu (germinální složky nebyly v histologickém vzorku
zachyceny).
Prognóza některých nádorů je spojena s přítomností specifických
chromozomálních aberací. Zpřesnění prognózy umožňuje adresnou
terapii – u pacientů s lepší prognózou se užívá méně intenzivní
léčba s omezenými komplikacemi, ale zachovanou účinností. Naproti
tomu u nejrizikovějších pacientů jsou indikované velmi intenzivní
postupy. Jako příklad může posloužit velmi špatná prognóza dětí
nemocných neuroblastomem s amplifikací genu MYCN.
V současné době se zavádí terapie, cílená proti specifickým
buněčným molekulám. Nejznámější je inhibitor specifické bcr/abl
tyrozinkinázy, imatinib mesylát (Glivec), který potlačuje
proliferaci buněk s fúzním genem bcr/abl. Produkt genu erb-B2 je
exprimován nádory s amplifikací tohoto genu (karcinom prsu, ovaria
a kolorekta). Nádory s touto amplifikací špatně reagují na obvyklou
chemoterapii, ale je u nich popisovaná příznivá odpověď na vysoké
dávky antracyklinů. Jinou léčebnou možností u těchto nádorů je
trastuzumab. Průkaz uvedených aberací tedy umožní vyhledat
pacienty, u kterých je příslušná terapie indikovaná. Při zavádění
nových léčebných postupů (genová terapie, specifické inhibitory)
budou specifická, molekulárně biologická vyšetření nedílnou
součástí výběru léčebného postupu a bez nich nebude možné tuto
léčbu indikovat.
Mozkové nádory jsou nejčastějšími solidními nádory
dětí. Přesto je málo známo o prognostických molekulárně
biologických znacích – v současnosti je v praxi využíváno pouze
vyšetření MYCC u meduloblastomu, kdy je jeho amplifikace známkou
horší prognozy. My jsme se zaměřili na sledování amplifikace MYCN a
MYCC u jednotlivých mozkových nádorů pomocí FISH, DNA ploidie
metodou průtokové cytometrie a u vybraných nádorů vyšetření
CGH.
Výskyt amplifikace MYCC a MYCN u jednotlivých nádorů ukazuje
tabulka 2. DNA aneuploidní byly podstatně častěji gliální nádory
vysokého stupně malignity než low grade gliomy. Rovněž pomocí CGH
neprokazujeme u nízce maligních gliomů žádné chromozomální aberace.
Metodou CGH a CGH microarray jsme prokázali u supratentoriálního
PNETU dosud nepopsanou amplifikaci MYCN a NCOA3(AIB1).
Tato vyšetření mohou přispět při určení gradu některých mozkových
nádorů dětského věku.

Tabulka 1. Detekce chromosomálních aberací
cytogenetickými metodami.
– metodu nelze použít, ± metodu lze využít s omezením, + metoda je
vhodná k detekci,
*lze pouze prokázat morfologický podklad double minutes nebo
homogenně se barvící úseky (HSR), ale nelze zjistit který gen nebo
chromozomální oblast je amplifikována
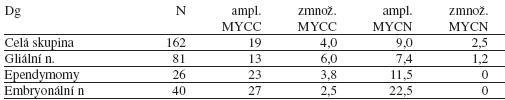
Tabulka 2.
Výskyt amplifikace (poměr počet kopií sledovaného genu a centromer
příslušného chromozomu je 4 nebo více)
a zmnožení (poměr počet kopií sledovaného genu a centromer
příslušného chromozomu je větší než 1 ale menší než 4) MYCC a MYCN
u mozkových nádorů. Kromě počtu pacientů v jednotlivých skupinách
jsou údaje v procentech.
Práce vznikla za finanč ní podpory VZ MSM 0021620813 a VZ MZO
00064203
Datum přednesení příspěvku: 12. 5. 2006





