Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: Nové nádorové markery a prediktory
Číslo abstraktu: 186p
Autoři: O. Blaštík; prof. MUDr. Marek Svoboda, Ph.D.; prof. MUDr. Elena Tóthová, CSc.; MUDr. Hana Binková, Ph.D.; MUDr. Zuzana Horáková; MUDr. Richard Salzman; Prof. MUDr. Richard Průša, CSc.; Ing. Jiří Kukačka; Mgr. David Potěšil; doc.RNDr. Vojtěch Adam, Ph.D.; Mgr. Jitka Petrlová, Ph.D.; doc.Ing. René Kizek, Ph.D.
Metalothionein krevní sérum; elektrochemické stanovení; nádorová onemocnění; změna hladiny metalothioneinu v průbě hu léčby
Úvod
Je známo, že dnes lze mnohá nádorová onemocnění velmi dobře léčit a moderní léčebné metody poskytují naději na dlouhodobou klidovou fázi nemoci s dobrou kvalitou života. K léčbě nádorových onemocnění existuje větší počet různých léčebných metod. Mezi základní léčebné metody je řazena chirurgická léčba, radioterapie a chemoterapie. Chirurgická léčba byla prakticky jedinou léčebnou metodou na počátku století. Její význam byl posílen zdokonalením operační techniky. Radioterapie nabyla na významu technickým pokrokem, který zavedením vysokoenergetických zdrojů záření umožnil dosáhnout lepších léčebných výsledků. Svým podílem k úspěchu přispěly i nové způsoby plánování léčby, využívající počítačové techniky, simulátorů a zpřesnění dozimetrie. Většinou se dnes ozařuje frakcionovaně, kdy se záření podává v jednotlivých dílčích dávkách, a to buď ve vyšších dávkách podaných méně často či naopak v malých dávkách aplikovaných několikrát denně. Chemoterapie pomocí cytostatik se v léčbě nádorových onemocnění začala více užívat v 50. letech a největšího rozvoje dosáhla v 70. letech. Z původně doplňkové metody se stala jednou z metod základních. U některých nádorových onemocnění je možné touto metodou dosáhnout i vyléčení [1-4]. Léčebné výsledky posílila i kombinace chemoterapie s dalšími léčebnými metodami, hlavně chirurgickými. Širšímu uplatnění chemoterapie u většího spektra nádorových onemocnění však bránila její značná toxicita, která neumožňovala aplikaci dostatečně vysokých dávek cytostatik potřebných ke zničení nádorových buněk. Jejich aplikace spolu např. s léky tlumícími zvracení (antiemetiky) nebo protijedy (antidoty), které omezují projevy orgánové toxicity cytostatik, umožnily zvyšovat dávky cytostatik a zefektivnit účinnost léčby. Moderní léčba nádorových onemocnění se zaměřuje na účinnější zásah do chorobných mechanismů nádorového růstu a metastazování na molekulárně biologické úrovni. Zkoumá se například účinek různých růstových a regulačních faktorů na buněčné bujení, diferenciaci a zánik buněk, studuje se možnost ovlivnění systému různých intracelulárních signalizačních molekul [5,7]. Navíc lze genetickou manipulací podpořit lokální i celkové mechanismy protinádorové imunity (tzv. genetická imunomodulace). Kromě různých variant genové terapie se intenzivně studuje možnost potlačení exprese řady proteinů spojených s nádorovým onemocněním [6,8-10]. Mezi proteiny, které mohou ovlivňovat průběh léčby je možné zařadit také metalothionein [11-16].
Materiál a Metody
Klinický materiál
V průběhu roku 2006 byly získány vzorky plné krve od pacientů léčených pro zhoubný nádor v oblasti hlavy a krku FN u Svaté Anny v Brně (Klinika ORL). Do prvotní studie byly vybráni čtyři pacienti (muži) s průměrným věkem 64,7 let.
Příprava vzorků pro elektroanalytické stanovení metalothioneinu
Ze získaných vzorků plné krve bylo odebráno 100 µl a umístěno na 15 min. při 99°C do termobloku (Eppendorf 5430, USA). Poté byly vzorky ochlazeny na 4°C a centrifugovány při 4°C, 15 000 g po dobu 30 min. (Eppendorf 5402, USA). Metalothioneiny patří k termostabilním proteinům, které zůstávají přítomné v roztoku i po jeho tepelné denaturaci [14,17-20]. Takto připravené vzorky byly analyzovány námi upraveným postupem adsorptivní přenosové techniky (AdTS) s diferenční pulsní voltametrií (DPV) [21]. Množství analyzovaného vzorku bylo 5 µl.
Elektroanalytické stanovení metalothioneinu pomocí Brdič kovy reakce metodou AdTS DPV
Vzorky byly analyzovány na přístroji AUTOLAB Analyser (EcoChemie, Netherlands) ve spojení s VA-Stand 663 (Metrohm, Switzerland) v klasickém tříelektrodovém uspořádání. Pracovní elektrodou byla visící rtuťová kapková elektroda (HMDE) s plochou kapky 0,4 mm2; referenční elektrodou byla Ag/AgCl/3M KCl a pomocnou grafitová elektroda. Základní elektrolyt (1 mmol.dm-3 Co(NH3)6Cl3 a 1 mol.dm-3amonný pufr; NH3(aq) + NH4Cl (Sigma Aldrich, ACS), pH = 9,6) byl po každých 5 analýzách vyměněn. AdTS DPV parametry byly následující: čas akumulace 120 s, počáteční potenciál -0,6 V, konečný potenciál - 1,6 V, modulační čas 0,057 s, časový interval 0,2 s, potenciálový krok 1,05 mV/s, modulační amplituda 250 mV, Eads = 0 V, teplota 0°C.
Výsledky a diskuse
V práci byly popsány pilotní experimentální výsledky stanovení obsahu metalothioneinu u pacientů se zhoubnými nádory v průběhu jejich protinádorové léčby.
Pacient 1 (muž, 65 let) byl k terapii přijat pro zhoubný nádor (ZN) hrtanu na konci prosince 2005. U pacienta nebyly pozorovány žádné metastázy do lokálních lymfatických uzlin ani vzdálené metastázy. Na základě histologické analýzy byl ZN diagnostikován jako dobře diferencovaný spinocelulární karcinom ve stádiu 3. Léčba byla zahájena chirurgickým odstraněním ZN a následnou radioterapií. Sledovali jsme změnu hladiny MT v krvi, která kolísala od 12,5 µg/ml do 10,9 µg/ml. Ve třináctém dni po diagnóze onemocnění byl proveden chirurgický zákrok, což se projevilo prudkým vzestupem hladiny MT na hodnotu 13,4 µg/ml ve čtrnáctém dni, respektive 16,9 µg/ml ve dni šestnáctém. Poté hladina MT v krvi klesala k hodnotě 14,5 µg/ml ve dvacátém dni léčby. Následná léčba primárního ZN byla složena z lokální radioterapie.
Pacient 2 (muž, 60 let) byl k léčbě přijat na začátku roku 2006 pro diagnózu ZN hypofaryngu. Histologicky byl ZN středně diferencovaný spinocelulární karcinom ve stádiu 3. U pacienta bylo pozorováno více metastáz do lokálních lymfatických uzlin, ale žádné vzdálené metastázy. Obsah MT v krvi při přijetí k terapii byl 13,5 µg/ml. Chirurgický zákrok byl proveden hned ve druhém dni a hladina MT po něm prudce klesla na hodnotu 7,33 µg/ml. Poté však opět prudce vzrostla na hodnotu 15,6 µg/ml ve čtvrtém dni léčby, ze které pozvolna klesala až k hodnotě velmi nízké hodnotě 2,5 µg/ml v dni desátém. Dvanáctý den došlo ke skokovému nárůstu hladiny MT v krvi na hodnotu 22,8 µg/ml. Pacient byl léčen chirurgickým odstraněním ZN a následnou chemoterapií.
Pacient 3 (muž, 65 let) byl k léčbě přijat na konci roku 2005 pro pokročilý ZN laryngu. Histologicky byl ZN středně diferencovaný spinocelulární karcinom ve stádiu 3. U pacienta nebyly pozorovány žádné vzdálené metastázy. Hladina MT v krvi byla při přijetí k léčbě 12,1 µg/ml. Operace byla provedena hned ve druhém dni a obsah MT v krvi po ní klesl na hodnotu 10,7 µg/ml. Po krátké čtyřdenní stagnaci na této hodnotě začala hladina MT pozvolna stoupat až k maximu 16.0 µg/ml v desátém dni léčby. Od tohoto dne započal pokles až k hladině 11,7 µg/ml ve čtrnáctém dni. Pacient byl léčen chirurgickým odstraněním ZN a následnou radioterapií.
Pacient 4 (muž, 65 let) byl k léčbě přijat v lednu 2006 pro velmi pokročilý ZN orofaryngu. Histologicky byl ZN středně diferencovaný spinocelulární karcinom ve stádiu 4a, navíc u pacienta byl prokázán ZN prostaty. Dále bylo u pacienta bylo pozorováno více metastáz do lokálních lymfatických uzlin, ale žádné vzdálené metastázy. Pacient byl léčen radioterapií a následnou radioterapií cisplatinou. Hladina MT v jeho krvi byla po první dávce radioterapie 12,3 µg/ml. Následně byla podána chemoterapie cisplatinou a pozorovaná hladina MT klesla k hodnotě 10,6 µg/ml. Ještě týž den večer však hladina MT skokově vzrostla na 15,1 µg/ml. Z této hodnoty započal pozvolný pokles obsahu MT v krvi, který se ve čtvrtém dni ustálil na hodnotě 9,5 µg/ml. Na získaném záznamu je velmi dobře patrný pokles MT po podání cisplatiny z důvodu jeho vazby na toto léčivo a následný výrazný skokový vzestup jako odpověď na přítomnost platinového kovu v krvi pacienta.
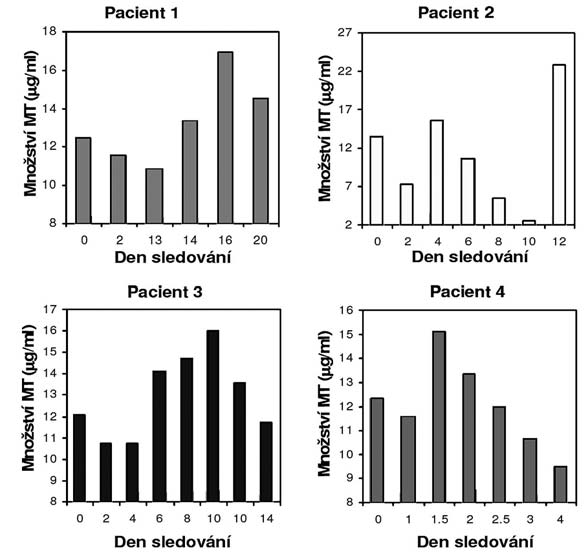
Obr. 1.
Změny obsahu MT v průběhu terapie u čtyř sledovaných pacientů se ZN v oblasti hlavy a krku
Závěr
Získané experimentální výsledky naznačují, že studium hladiny metalothioneinu u onkologických pacientů je nejen zajímavé z hlediska obecného poznání, ale přináší i nové poznatky pro pochopení léčebné odpovědi.
Poděkování
Příspěvek vznikl za podpory grantů RASO 8/2005 a GAČR 525/04/P132.
Literatura
- 1. Downward, J. (2003). Targeting ras signalling pathways in
cancer therapy. Nature Reviews Cancer 3, 11-22.
- Coussens, L.M., Fingleton, B., and Matrisian, L.M. (2002).
Cancer therapy – Matrix metalloproteinase inhibitors and cancer:
Trials and tribulations. Science 295, 2387-2392.
- Mendelsohn, J., and Baselga, J. (2000). The EGF receptor family
as targets for cancer therapy. Oncogene 19, 6550-6565.
- Osborne, C.K. (1998). Drug therapy – Tamoxifen in the treatment
of breast cancer. New England Journal of Medicine 339,
1609-1618. - Fisher, D.E. (1994). Apoptosis in Cancer-Therapy – Crossing the
Threshold. Cell 78, 539-542.
- Culver, K.W., and Blaese, R.M. (1994). Gene-Therapy for Cancer.
Trends in Genetics 10, 174-178.
- Kerr, J.F.R., Winterford, C.M., and Harmon, B.V. (1994).
Apoptosis – Its Significance in Cancer and Cancer-Therapy. Cancer
73, 2013-2026.
- Freeman, S.M., Whartenby, K.A., Freeman, J.L., Abboud, C.N.,
and Marrogi, A.J. (1996). In situ use of suicide genes for cancer
therapy. Seminars in Oncology 23, 31-45.
- Dranoff, G., and Mulligan, R.C. (1995). Gene-Transfer as
Cancer-Therapy. In Advances in Immunology, Vol 58, Volume 58. pp.
417-454.
- Gutierrez, A.A., Lemoine, N.R., and Sikora, K. (1992).
Gene-Therapy for Cancer. Lancet 339, 715-721.
- Prusa, R., Blastik, O., Potesil, D., Trnkova, L., Zehnalek, J.,
Adam, V., Petrlova, J., Jelen, F., and Kizek, R. (2005). Analytic
method for determination of metallothioneins as tumor markers.
Clin. Chem. 51, A56-A56.
- Prusa, R., Blastik, O., Kukacka, J., Kizek, R., and
Stuchlikova, H. (2005). Plasma metallothionein levels in lead
poisoned child. Toxicol. Lett. 158, S156-S157.
- Prusa, R., Blastik, O., Kukacka, J., Zehnalek, J., Adam, V.,
Petrlova, J., and Kizek, R. (2005). The influence of platinum-based
drugs on the amount of metallothionein. Toxicol. Lett. 158,
S66-S67.
- Petrlova, J., Blastik, O., Zitka, O., Adam, V., Potesil, D.,
Mikelova, R., Prusa, R., Stiborova, M., Trnkova, L., Zehnalek, J.,
and Kizek, R. (2005). An electrochemical study of metallothionein
as a potential tumour disease marker. Annals the Polisch Chemical
Society in press.
- Svoboda, M., Blastik, O., Prusa, R., Kukacka, J., Zitka, O.,
Adam, V., Petrlova, J., Zehnalek, J., and Kizek, R. (2006).
Changing of metallothionein content at patients with tumour
diseases. In X. Pracovni setkani biochemiku a molekularnich biologu
(M. Wimmerova and P. Benes, eds.). pp. 96-97, Masarykova
univerzita: Brno, Czech republic.
- Svoboda, M., Blastik, O., Prusa, R., Kukacka, J., Zitka, O.,
Adam, V., Petrlova, J., Zehnalek, J., and Kizek, R. (2005). Analyza
obsahu metalothioneinu u pacientu s nadorovym onemocnenim. In Dny
diagnosticke, prediktivni a experimentalni onkologie (M. Hajduch,
ed.). pp. 48, Solen: Olomouc, Czech republic.
- Petrlova, J., Blastik, O., Prusa, R., Kukacka, J., Potesil, D.,
Mikelova, R., Adam, V., Zehnalek, J., and Kizek, R. (2005). Using
of electrochemical methods for studying of metallothionein content
in the human blood serum of a patient poisoned by lead and treated
by platinum. Biomedical Papers 149, 485-488.
- Petrlova, J., Blastik, O., Adam, V., Mikelova, R., Potesil, D.,
Trnkova, L., Prusa, R., and Kizek, R. (2005). Detekce
zeptomolarnich hladin metalothioneinu chronopotenciometrickou
rozpousteci analyzou na rtutove elektrode. In XXIX. Brnenske
onkologicke dny (J. Zaloudik and R. Vyzula, eds.). pp. 111-113,
Masarykuv onkologicky ustav v Brne: Brno, Ceska
republika.
- Petrlova, J., Blastik, O., Prusa, R., Kukacka, J., Mikelova,
R., Stiborova, M., Vojtesek, B., Adam, V., Zitka, O., Eckschlager,
T., and Kizek, R. (2006). Analýza obsahu metatothioneinu u pacientů
se zhoubným nádorem prsu, tlustého střeva a nebo melanomem. Klin.
Onkol. 19, 58-62.
- Petrlova, J., Potesil, D., Mikelova, R., Blastik, O., Adam, V.,
Trnkova, L., Jelen, F., Prusa, R., Kukacka, J., and Kizek, R.
(2006). Attomole voltammetric determination of metallothionein. Electrochim. Acta in press. - Olafson, R.W., and Olsson, P.E. (1991). Electrochemical
detection of metallothionein. Methods in Enzymol. 205,
205-213.
- Kizek, R., Vacek, J., Trnkova, L., Klejdus, B., and Havel, L.
(2004). Application of catalytic reactions on a mercury electrode
for electrochemical detection of metallothioneins. Chem. Listy 98,
166-173.
- Blastik, O., Svoboda, M., Prusa, R., Kukacka, J., Stiborova,
M., Adam, V., Petrlova, J., Beklova, M., Zehnalek, J., and Kizek,
R. (2006). Evaluation of sensitivity of electrochemical
determination of metallothionein. In X. Pracovni setkani biochemiku
a molekularnich biologu (M. Wimmerova and P. Benes, eds.). pp.
58-59, Masarykova univerzita: Brno, Czech republic.
- Kizek, R., Vacek, J., Adam, V., and Vojtesek, B. (2004). Vztah
metalothioneinu k rakovine a protinadorove lecbe. Klin. Biochem.
Metab. 12, 72-78.
- Blastik, O., Svoboda, M., Prusa, R., Kukacka, J., Stiborova, M., Adam, V., Petrlova, J., Beklova, M., Zehnalek, J., and Kizek, R. (2005). Overeni senzitivity elektrochemickeho stanoveni metalothioneinu jako potencionalniho markeru nadorovych onemocneni. In Dny diagnosticke, prediktivni a experimentalni onkologie (M. Hajduch, ed.). pp. 35-36, Solen: Olomouc, Czech republic.
Datum přednesení příspěvku: 11. 5. 2006





