Konference: 2005 XXIX. Brněnské onkologické dny a XIX. Konference pro sestry a laboranty
Kategorie: Zhoubné gynekologické nádory
Téma: Novinky v protinádorové farmakoterapii
Číslo abstraktu: 195
Autoři: Ing. Viktor Horváth, Ph.D.; RNDr. Lenka Švihálková-Šindlerová, Ph.D.; Mgr. Olga Vondálová-Blanářová; Mgr. Karel Souček, Ph.D.; PharmDr. Petr Sova, Ph.D.; A. Kroutil; F. Žák; A. Mistr; prof. RNDr. Jiřina Hofmanová, CSc.; prof. RNDr. Alois Kozubík, CSc.
K základním přístupům v léčbě onkologických malignit patří vedle chirurgických zákroků, radioterapie neodmyslitelně také chemoterapie, která spočívá v aplikaci cytostatik – chemických sloučenin definované struktury přirozeného původu, jako i látek připravených synteticky. Právě mezi takové látky patří i deriváty platiny.
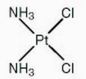
Cisplatina – cis-diamminedichloroplatinum(II) (cis-DDP) – je úspěšným platinovým derivátem, který je klinicky používán více než 30 let (od roku 1970) a stále mu patří klíčové postavení z pohledu nádorové chemoterapie. Cisplatina je v současné době jedním ze třech nejčastěji používaných chemoterapeutik v klinické praxi, přičemž v kombinaci s jinými cytostatiky (5-fluorouracil, paclitaxel) vykazuje vysokou účinnost při léčbě různých druhů nádorů, jako např. nádorů děložního čípku, močového měchýře, plic, hlavy a krku. Na druhé straně vykazuje cisplatina nízkou nebo téměř žádnou účinnost vůči některým běžným typům nádorů, jako jsou nádory tlustého střeva a prsu. Kombinovaná chemoterapie založená na aplikaci platinových komplexů je dnes považována za nejefektivnější variantu léčby pokročilých stadií nádorů vaječníků a varlat.
Za mechanismus působení cisplatiny je obecně považována její interakce s DNA, se kterou vytváří několik typů vnitrořetězcových a meziřetězcových aduktů, případně aduktů DNA – protein. Jak jednotlivé skupiny „crosslinků“ přispívají k modulaci buněčného cyklu a buněčné smrti po působení cisplatiny není detailně známo. Některé typy aduktů blokují syntézu DNA polymerázami, indukují apoptózu a modulují cytokinetiku. Na mnohých buněčných liniích in vitro se ukázalo, že poškození DNA cisplatinou způsobuje přechodnou akumulaci buněk v S fázi a v G2/M fázi buněčného cyklu, čímž je buňkám umožněno opravit poškozenou DNA (DNA repair). Je-li oprava nedostatečná, následuje buněčná smrt.
Vysoká protinádorová aktivita cisplatiny je provázena několika vážnými nežádoucími vedlejšími efekty, jako jsou toxicita pro gastrointestinální trakt, nefrotoxicita, neurotoxicita a zvracení. Právě tyto vedlejší účinky limitují finální dávku léčiva podávanou pacientovi. Dalším významným problémem léčby nádorů cisplatinou je vznik získané rezistence k této látce. Ta může být navozena více mechanismy, mezi jiným např. sníženou akumulací léku, posílením jeho detoxikace v cytoplazmě, v jádře může hrát důležitou roli snížená dostupnost DNA a posílení reparačních mechanismů.
Proto je třeba hledat nové látky (a jejich kombinace s jinými farmaky) schopné zvrátit nebo potlačit tento jev a zvýšit účinnost protinádorové terapie. Od roku 1970 byly vyvinuty, syntetizovány a otestovány tisíce nových platinových protinádorových derivátů, ale pouze méně než 30 z nich postoupilo do fáze klinického zkoušení. Ani jeden z nich však doposud významně nepřekonal účinnost cisplatiny při léčení ovariálních a testikulárních nádorů.
Platinové Pt(IV) komplexy – po dlouhé období od okamžiku zavedení cisplatiny do klinické praxe se další vývoj zaměřoval na planární dvojmocné, ve vodě slabě rozpustné platinové komplexy – Pt(II). V klinické praxi se tyto Pt(II) deriváty, jako je cisplatina, karboplatina a oxaliplatina, podávají intravenózními infuzemi. Proto je velmi žádoucí, aby byl syntetizován a charakterizován účinný platinový komplex, který bude možno efektivně podávat pacientovi perorálně, což zjednoduší dávkování a zvýší komfort pacienta.
Už od dob Rosenbergem publikovaných pilotních prací o cisplatině a platinových derivátech bylo známo, že i čtyřmocné
(oktahedrální) platinové komplexy Pt(IV) vykazují protinádorové vlastnosti. Dvě skutečnosti, a to v první řadě nezaznamenaná zkřížená rezistence některých Pt(IV) derivátů s cisplatinou a také úspěšný vývoj a klinické testování prvního perorálně podávaného derivátu JM216, pomohly společně zvýšit zájem o tento typ platinových komplexů. Pt(IV) komplexy vykazují několik farmakologických výhod v porovnání s cisplatinou. Ukazuje se, že během aktivačního procesu jsou Pt(IV) deriváty redukovány extracelulárními a intracelulárními agens na mnohem více reaktivní Pt(II) deriváty ještě před reakcí se samotnou DNA. Velmi důležitý je efekt tzv. „axial“ a „carrier“ ligandů navázaných na centrálním koordinačním platinovém atomu, např. polycyklického adamantanu, na in vivo redoxní procesy a všeobecně na celkovou biologickou aktivitu (cytotoxicitu) komplexu.
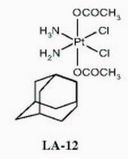
Na základě těchto skutečností syntetizovali a charakterizovali Žák a kolektiv originální homologní sérii nových Pt(IV) komplexů s objemnými hydrofobními ligandy – adamantylaminové Pt(IV) komplexy. Při testování jejich toxicity na třech ovariálních nádorových liniích se ukázalo, že nejvyšší biologický efekt má derivát [(OC-6-43)-bis(acetato)(1-adamantylamine amminedichloroplatinum) (IV)], označovaný jako LA-12 a jeho dvojmocný metabolit LA-9 [(1-adamantylamine amminedichloroplatinum) (II)]. LA-12 vykazuje významně vyšší účinnost u buněk citlivých k cisplatině a navíc překonává získanou rezistenci k cisplatině, zároveň je u použitých linií účinnější než klinicky testovaný komplex JM216 (naše nepublikované výsledky).
Epiteliální ovariální karcinom je časté nádorové onemocnění žen spojené s vysokou mortalitou, která je vyšší než u karcinomu endometria a děložního čípku dohromady. Např. v roce 2004 bylo v USA prognózováno diagnostikování 24 400 nových případů, ze kterých 14 300 mělo být smrtelných. Rozvoj tohoto onemocnění se neprojevuje specifickými symptomy, a proto jsou nové případy často diagnostikovány až v pokročilých stádiích onemocnění (FIGO Stage III) s metastázemi v intraperitoneálním prostoru. K vysoké mortalitě negativně přispívá pokročilý věk pacientek (medián 63 let) a menopauza. Kromě chirurgického zásahu tu hraje klíčovou roli zejména chemoterapie. Právě díky ní se v poslední době zvýšil podíl žen přežívajících pět let po terapii ze 30% (60. léta 20. století) na 50 % (posledních několik let).
Na základě těchto informací jsme se rozhodli zaměřit na studium ovariálního adenokarcinomu a pro tento účel jsme si vybrali jako modelový in vitro systém tři buněčné linie (cisplatin-senzitivní linii A2780, linii se získanou rezistencí k cisplatině A2780cis, a linii s přirozenou vnitřní rezistencí k cisplatině SK-OV-3).
Naše výsledky komparativní studie biologického hodnocení efektů LA-9 a LA-12 vůči efektům způsobeným referenční cisplatinou na třech ovariálních adenokarcinomálních buněčných liniích ukazují, že IC50 a IC90 koncentrace LA-9 a LA-12 byly 6-krát (A2780) resp. 18-krát (A2780cis) nižší než stejné koncentrace určené pro cisplatinu (MTT test).
U linie SK-OV-3 se neukázal žádný signifikantní rozdíl v zjištěných hodnotách koncentrací IC10, IC50 a IC90 mezi derivátem LA-9 a cisplatinou (MTT; DNA-proliferační test), zatímco Pt(IV) derivát LA-12 se ukázal být u této linie nejúčinnější z trojice testovaných platinových komplexů. LA-9 i LA-12 byly v těchto testech signifikantně účinnější než cisplatina (A2780, A2780cis; LA-12 i u SK-OV-3 linie) a navíc byly schopny překonat získanou rezistenci k cisplatině (A2780, A2780cis; LA-12 i tu přirozenou u linie SK-OV-3). Ekvitoxické koncentrace (IC50 a IC90 pro A2780 a A2780cis) resp. (IC10 a IC50 pro SK-OV-3) studovaných derivátů způsobovaly signifikantní, časověa koncentračně závislou inhibici proliferace a zvýšení počtu plovoucích buněk, která dobře korespondovala se snížením celkové buněčné viability. Zaznamenali jsme také různý typ a dynamiku modulace buněčného cyklu po ovlivnění LA-12 a cisplatinou u A2780 a A2780cis. Působení LA-12 (do 24 hod. chronického působení v koncentraci IC50) mělo za následek přechodnou akumulaci buněk v S-fázi buněčného cyklu (A2780, A2780cis), zatímco cisplatina způsobila nejdříve přechodnou akumulaci buněk A2780 v S-fázi (do 15 hod. chronického působení v koncentraci IC50), která se potom přesunula do G2/M bloku (24 hod. chronického působení v koncentraci IC50). U linie SK-OV-3 všechny tři studované deriváty způsobily změny v buněčném cyklu ve smyslu trvalého bloku v S-fázi. Testované koncentrace LA-9, LA-12 i cisplatiny ukázaly ve všech sledovaných časových intervalech relativně nízkou schopnost indukovat apoptotickou buněčnou smrt (hodnocení jaderné morfologie; tvorba „DNA ladder“; štěpení proteinu PARP), což nás opravňuje se domnívat, že apoptóza není dominantním typem buněčné smrti způsobovaným efekty hodnocených platinových komplexů. Nejzajímavější se ukazují výsledky detekce úrovně exprese tumor supresorového proteinu p53 metodou Western blotting. Ta přímo souvisí s poškozením DNA platinovými deriváty a molekula p53 rovněž přímo zasahuje do regulací signálních drah buněčného cyklu, které následně mohou vyústit v zástavu v cyklu a tím i průběhu reparačních mechanizmů takto poškozené DNA. Detekovali jsme časověa koncentračně závislý nárůst úrovně proteinové exprese p53, zároveň však ekvitoxické koncentrace LA-12 v porovnaní s ekvitoxickými koncentracemi cisplatiny způsobovali signifikantně nižší (denzitometrické hodnocení detekovaných spotů) hladinu exprese tohoto proteinu [28].
Závěrem lze konstatovat, že cisplatina patří mezi nejvýznamnější cytostatika používaná v terapii adenokarcinomů vaječníků. Častý výskyt získané rezistence a silné vedlejší účinky však snižují možnost jejího použití. Jedním ze způsobů, jak tyto překážky překonat, je syntéza a charakterizace nových účinných látek na bázi platiny. K takovým patří zejména adamantylaminový Pt(IV) komplex s označením LA-12, který vykazuje vysokou účinnost u širokého spektra buněčných nádorových linií in vitro, překonává získanou i vrozenou rezistenci k cisplatině a v současné době je ve fázi klinického výzkumu a testování. Studium doposud neobjasněných mechanismů účinku této látky může přinést informace důležité nejen pro klinickou praxi, ale také pro vývoj dalších platinových cytostatik.
Seznam literatury:
- Rosenberg, B. In Cisplatin-Chemistry and Biochemistry of a
Leading Anticancer Drug, B. Lippert, ed.; VHCA, WILEY-VCH: Zü rich,
Weinheim, 1999, pp. 3-30.
- Chu, G. J Biol Chem, 1994, 269, 787-90.
- Crul, M.; van Waardenburg, R. C.; Beijnen, J. H.; Schellens, J.
H. Cancer Treat Rev, 2002, 28, 291-303.
- O’Dwyer, P. J.; Stevenson, J. P.; Johnson, S. W. In
Cisplatin-Chemistry and Biochemistry of a Leading Anticancer Drug,
B. Lippert, ed.; VHCA, WILEY-VCH: Zü rich, Weinheim, 1999, pp.
31-72.
- Gordon, M.; Hollander, S. J Med, 1993, 24, 209-65.
- Weiss, R. B.; Christian, M. C. Drugs, 1993, 46,
360-77.
- Eastman, A.; Schulte, N.; Sheibani, N.; Sorenson, C. M. In
Platinum and other metal coordination compounds in cancer
chemotherapy, M. Nicolini, ed.; Martinus Nijhoff Publishing:
Boston, 1988, pp. 178-196.
- Schmitt, C. A.; Lowe, S. W. J Pathol, 1999, 187,
127-37.
- Vaisman, A.; Varchenko, M.; Said, I.; Chaney, S. G. Cytometry,
1997, 27, 54-64.
- Simonian, P. L.; Grillot, D. A.; Nunez, G. Blood, 1997, 90,
1208-16.
- Sorenson, C. M.; Eastman, A. Cancer Res, 1988, 48,
4484-8.
- Henkels, K. M.; Turchi, J. J. Cancer Res, 1999, 59,
3077-83.
- Hartmann, J. T.; Lipp, H. P. Expert Opin Pharmacother, 2003, 4,
889-901.
- Avendano, C.; Menendez, J. C. Curr Med Chem, 2002, 9,
159-93.
- Timmer-Bosscha, H.; de Vries, E. G.; Meijer, C.; Oosterhuis, J.
W.; Mulder, N. H. Cancer Chemother Pharmacol, 1998, 41,
469-76.
- Ho, Y. P.; Au-Yeung, S. C.; To, K. K. Med Res Rev, 2003, 23,
633-55.
- Ziegler, C. J.; Silverman, A. P.; Lippard, S. J. J Biol Inorg
Chem, 2000, 5, 774-83.
- Rosenberg, B.; Van Camp, L.; Grimley, E. B.; Thomson, A. J. J
Biol Chem, 1967, 242, 1347-52.
- McKeage, M. J.; Raynaud, F.; Ward, J.; Berry, C.; O’Dell, D.;
Kelland, L. R.; Murrer, B.; Santabarabara, P.; Harrap, K. R.;
Judson, I. R. J Clin Oncol, 1997, 15, 2691-700.
- O’Neill, C. F.; Ormerod, M. G.; Robertson, D.; Titley, J. C.;
Cumber-Walsweer, Y.; Kelland, L. R. Br J Cancer, 1996, 74,
1037-45.
- Perez, J. M.; Camazon, M.; Alvarez-Valdes, A.; Quiroga, A. G.;
Kelland, L. R.; Alonso, C.; Navarro-Ranninger, M. C. Chem
Biol Interact, 1999, 117, 99-115. - Pendyala, L.; Krishnan, B. S.; Walsh, J. R.; Arakali, A. V.;
Cowens, J. W.; Creaven, P. J. Cancer Chemother Pharmacol, 1989,25,
10-4.
- Blatter, E. E.; Vollano, J. F.; Krishnan, B. S.; Dabrowiak, J.
C. Biochemistry, 1984, 23, 4817-20.
- Kido, Y.; Khokhar, A. R.; Siddik, Z. H. Biochem Pharmacol,
1994, 47, 1635-42.
- Zak, F.; Turanek, J.; Kroutil, A.; Sova, P.; Mistr, A.;
Poulova, A.; Mikolin, P.; Zak, Z.; Kasna, A.; Zaluska, D.; Neca,
J.; Sindlerova, L.; Kozubik, A. J Med Chem, 2004, 47,
761-3.
- Turánek, J.; Kašná, A.; Neča, J.; Kvardová, V.; Knötigová, P.;
Záluská, D.; Horváth, V.; Šindlerová, L.; Kozubík, A.; Sova, P.;
Kroutil, A.; Žák, F.; Mistr, A. Anticancer Drugs, 2004, 15,
537-43.
- Jemal, A.; Murray, T.; Samuels, A.; Ghafoor, A.; Ward, E.;
Thun, M. J. CA Cancer J Clin, 2003, 53, 5-26.
- Kozubík, A.; Horváth, V.; Švihálková-Šindlerová, L.; Souček, K.; Hofmanová, J.; Sova, P.; Kroutil, A.; Žák, F.; Mistr, A.; Turánek, J. Biochem Pharmacol, 2005, 69, 373-383.
Tento projekt je podpořen grantem Ministerstva průmyslu a obchodu České Republiky, Contract No. PZ-Z2/29, „New Medicines for Cancer Therapy“ a grantem MŠMT ČR FRVŠ č. 2528/2005
Datum přednesení příspěvku: 26. 5. 2005





