Konference: 2012 17. ročník sympózia Onkologie v gynekologii a mammologii
Kategorie: Zhoubné nádory prsu
Téma: Diagnostika II
Číslo abstraktu: 07
Autoři: RNDr. Ing. Bc. Libor Staněk, PCTM; MUDr. Soňa Lísová; Daniel Tvrdík; MUDr. Zuzana Velenská; Prof. MUDr. Ctibor Povýšil, DrSc.
Karcinom prsu je jednou z nejčasnějších malignit žen ve světě, včetně ČR. Proto se nelze divit, že je na toto onemocnění zaměřená zvýšená pozornost nejen z hlediska terapie, ale i přesné, rychlé a dobře interpretovatelné diagnostiky. Současná onkologická léčba vychází z konceptu cílené biologické léčby „targeted therapy“, která vyžaduje přesnou histologickou a imunohistochemickou diagnostiku za souběžné molekulárně-biologické analýzy. Z pohledu patologa je tedy nezbytné stanovit správnou diagnózu, zhodnotit stupeň diferenciace a posoudit rozsah a pokročilost onemocnění. Nedílnou součásti vyšetření je posouzení infiltrace uzlin, včetně diagnostiky sentinelové uzliny a v poslední době také vztah nádoru k resekčním okrajům. Tato vyšetření se provádějí pomocí histologického barvení a imunohistochemie, jako je exprese hormonálních receptorů, proliferační aktivita (Ki67), diferenciace, rozsah apoptózy a exprese řady onkoproteinů (p53, HER-2/neu). S rozvojem cílené léčby a s důrazem na hereditární genetiku bylo ovšem nutno zavést řadu dalších diagnostických markerů, sahajících do nové oblasti molekulární patologie, která zahrnuje jak molekulárně-biologická, tak cytogenetická vyšetření.Histologické vyšetření zahrnuje celou škálu histologických barvení s převahou HaE. Toto barvení slouží k odlišení jednotlivých typů nádorů dle klasifikace WHO. Jedná se o karcinom duktální, lobulární, medulární a meplastický. V 73%, se jedná o karcinom duktální vycházející z buněk výstelky duktů, u 14% se jedná o karcinom lobulární, který vychází z buněk výstelky lobulů. Zbylých 13% případů tvoří méně obvyklé typy karcinomu. Určení typu nádoru je důležitý aspekt pro další vyšetření a volbu terapie.
Imunohistochemická klasifikace je založena na stupni exprese hormonálních receptorů - estrogenových receptorů (ER) a progesteronových receptorů (PR). Předpokladem hormonální dependence je zvýšená exprese těchto hormonálních receptorů (HR): ERpoz/PgR-poz; ER-poz/PgR-neg; ER-neg/PgR-poz). Hormonálně dependentní nádory tvoří cca 65–75 % všech invazivních karcinomů prsu. U nádorové buňky se estrogenní hormony váží na estrogenní receptory v cytoplasmě buněk, vzniklý komplex pak aktivuje některé geny v jádře buňky. Antiestrogeny jsou látky, které mají schopnost vyhledat estrogenní receptor a navázat se na něj - vytvořený komplex však není aktivní a buňku nestimuluje. Antiestrogen však brání estrogenu ve vazbě na receptor a tím stimulaci buňky. Dále se imunohistochemicky stanovuje proliferační marker Ki67. Antigen Ki-67 je nukleární protein s molekulovou hmotností 345 kDa, charakterizovaný reaktivitou s monoklonální protilátkou klonu specifického pro Ki Protein. Ki-67 je exprimován ve všech proliferujících buňkách během pozdní fáze G1 a fáze S, M a G2 buněčného cyklu, zatímco buňky ve fázi G0 (u nichž cyklus neprobíhá) konzistentně antigen Ki-67 postrádají. Nestimulované normální lidské buňky antigen Ki-67 neexprimují. Ki-67 pozitivní frakce buněk je proto označovaná jako růstová frakce. Stanovení proteinu Ki-67 je poměrně jednoduché, a proto se stalo základním ukazatelem proliferační aktivity buněk. Procento imunohistochemicky značených buněk z hodnocených 1 000 buněk se označuje jako skóre Ki-67. Z onkoproteinů se stanovuje jednak p53 a s ohledem na biologickou léčbu HER-2/neu. Protein p53 je transkripční faktor zabraňující vzniku nádorů. Jeho molekulová hmotnost je 53 kDa. Protein p53 reguluje expresi mnohých genů, které mohou kontrolovat růst buněk, apoptózu, opravu DNA, stárnutí buněčných populací a také angiogenezi. Gen pro tento protein nalézáme zmutovaný u téměř poloviny pacientů. p53 vyhledává na DNA poškozená místa a pokud takové najde, spustí transkripci genu p21, který zastaví dělení buňky, dokud není poškozené místo reparováno. Pokud to nelze, buňka apoptuje.
Dále zmíněný Her2, je produkt genu Her2/neu nacházejícího se na dlouhém raménku chromozomu 17 v oblasti q11.2-q12, jedná se o transmembránový receptor s tyrozin kinázovou aktivitou o hmotnosti 185 kDa, patřící do rodiny HER, homologů EGFR (Epidermal growth factor receptor) a má význam pro buněčný růst a transdukci signálu. Za normálních podmínek je zastoupení těchto receptorů v buňce prsní žlázy okolo 20 000 kopií, při overexpresi Her2 může jejich počet vzrůst na několik miliónů, což je ve většině případů přímý důsledek amplifikace genu Her2/neu (Obr. č. 1.). Pozitivita Her2 je prediktorem odpovědi na léčbu pomocí humanizované monoklonální protilátky proti tomuto receptoru Herceptinem (trastuzumab). Před zahájením této léčby je proto nutné provést molekulárně biologické vyšetření overexprese/amplifikace Her2/neu v nádorových buňkách. Stav receptoru HER-2 a hormonálních receptorů je základním parametrem pro použití biologické a hormonální léčby.
Obr. č. 1
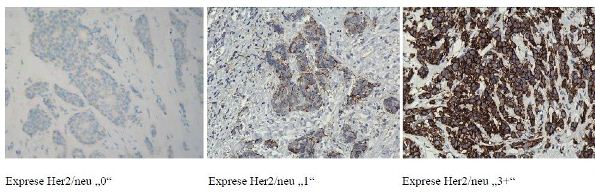
Jak již bylo řečeno, exprese tohoto proteinu je v důsledkem amplifikace příslušného genu Her2. V současnosti se převážně používají dvě metody umožňující průkaz amplifikace genu Her2/neu. Jedná se o cytogenetickou metodu hybridizace in situ ISH, která může být prováděna s fluorescenčním značením FISH (PathVysion HER-2 DNA Probe Kit Abbott), kterou lze kombinovat se značením stříbrem SISH (Obr. č. 2.).
Obr. č. 2.
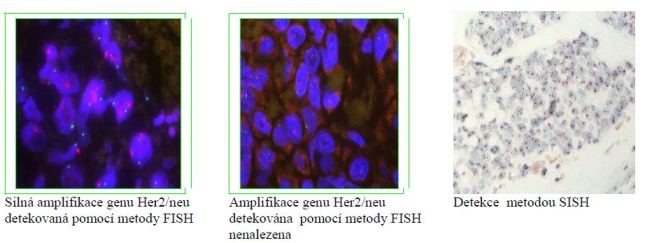
Metoda FISH je velice průkazná a dobře reprodukovatelná, odečítá se
ve fluorescenčním mikroskopu a je založena na principu značení genu
(Orange) a centromer (Green) k odlišení amplifikace od polyzomie. U
značení stříbrem SISH (Roche) se využívá stejná technika značení
genu a centromer, ale v tomto případě odečítáme signály ve
světelném mikroskopu. v důsledku akreditace laboratoří, bylo
potřeba zavedení i dalších alternativních metoda. Zde se osvědčila
molekulární metoda kvantifikace pomocí qRT- PCR (LIGHT Mix Her2;
TIB MOLBIOL) (Obr. č. 3.). Tato metoda nám přesně spočte
koncentraci amplifikovaného genu vůči referenčnímu genu. Další
možností je i metoda přímého sekvenování.
Obr. č. 3.
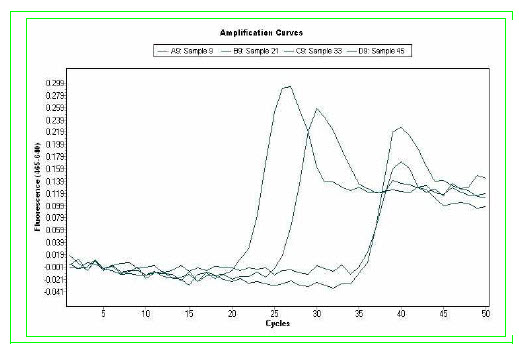
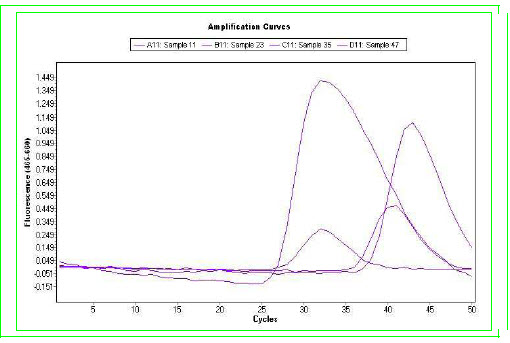

Referenční gen a gen pro Her2/neu
nelze analyzovat současně. Výsledek získáme jako poměr mezi Her2 ku
referenci.
Hodnoty nižší jak 2 hodnotíme jako negativní (-) a hodnoty nad 2
jako pozitivní (+).
Dalším molekulárním markerem, který
se v poslední době začíná sledovat je gen BRCA1 a BRCA2. Tento gen
je zodpovědný za hereditární karcinom prsu. V současné době jsou
známy dva hlavní geny BRCA1 a BRCA2, které v mutovaném stavu
způsobují predispozici ke vzniku nádoru prsu. Ztrátové mutace v
BRCA genech vykazují autozomálně dominantní dědičnost s odhadovaným
kumulativním rizikem pro vznik nádoru prsu 84% do věku 60-70 let.
BRCA1 a BRCA2 gen jsou sekvenčně nepříbuzné proteiny, které se
nacházejí společně v multiproteinových komplexech významných pro
udržení stability genomu. Jsou součástí komplexů řídících homologní
rekombinaci a reparační procesy indukované DNA
poškozením, účastní se aktivace transkripce, remodelace chromatinu
a regulace buněčného cyklu. Jejich poškození způsobuje hromadění
mutačních změn v buňce a může vyústit v její maligní zvrhnutí.
Mutace genu vede k nestabilitě geonomu a kumulaci řady genových
alterací. Vyšetření se rutinně provádí z periferní krve metodou
přímé sekvenace (Obr. č. 4.)
Obr. č. 4.
Závěrem lze konstatovat, že rutinně prováděná diagnostika dnes
zahrnuje celou řadu sofistikovaných analýz, s vysokou specifičností
a reprodukovatelností.
Datum přednesení příspěvku: 6. 1. 2012





