Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Chemoterapie
Téma: Novinky v protinádorové chemoterapii a v bioterapii
Číslo abstraktu: 038p
Autoři: MUDr. Vendula Foltinová, Ph.D.; RNDr. Lenka Švihálková-Šindlerová, Ph.D.; Ing. Viktor Horváth, Ph.D.; PharmDr. Petr Sova, Ph.D.; A. Kroutil; F. Žák; A. Mistr; prof. RNDr. Jiřina Hofmanová, CSc.; Prof. MUDr. Roman Janisch, DrSc.; prof. RNDr. Alois Kozubík, CSc.
Vývoj chemoterapeutik doznává v posledních 30 letech velký rozvoj. Vznikají nové nebo odvozené látky,u kterých je zkoumán mechanismus účinku za pomoci buněčných nádorových linií.
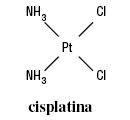
V naší práci se zabýváme platinovým derivátem LA-12. Jeho o mnoho let starším sourozencem je cisplatina (cis-diamminedichloroplatinum(II)),známá jako Peyronův chlorid (1864). Její protinádorová aktivita však byla studována až o mnoho let později,kdy byl zjištěn efekt na buněčný cyklus E.coli. Do klinického využití se dostala kolem r.1970 a od této doby se trvale usadila v léčebných režimech mnoha nádorových onemocnění – nádory varlat, vaječníků, močového měchýře, hlavy a krku atd. Její využití je bohužel limitováno dvěma zásadními faktory. Prvním jsou závažné nežádoucí účinky nefrotoxicita,kardiotoxicita,emesa,neurotoxicita),které mají za následek snižování dávky nebo přímo odstoupení od léčby touto látkou. Druhým limitem je rezistence,ať už primární (vrozená), jako např.u kolorektálního karcinomu, nemalobuněčného karcinomu plic apod., nebo sekundární (získaná).
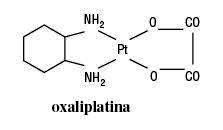
Dalším platinovým derivátem,který byl nasyntetizován koncem 70.let minulého století a do klinické praxe se poprvé dostal r.1996 ve Francii,je oxaliplatina (oxalato-1,2-diaminocyclohexane platinum(II)). Je účinná v jiném spektru maligních onemocnění a neobjevuje se u ní zkřížená rezistence s cisplatinou. Využívá se
hlavně v léčbě kolorektálního karcinomu,který,jak je výše uvedeno,je k účinku cisplatiny rezistentní. Oxaliplatina má synergistický účinek s 5--fluorouracilem a leukovorinem. V této kombinaci je možno dosáhnout lepších léčebných výsledků jak u kolorektálního karcinomu,tak u karcinomu prsu a mezoteliomu. Objevují se u ní nežádoucí účinky jako periferní senzorická neuropatie, emesa, hematologická suprese.
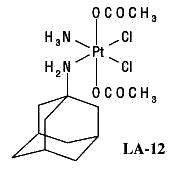
Nový preparát LA--12 [(OC-6-43)-bis(acetato)(1-adamantylammine)dichloroplatinum(IV)] byl poprvé popsán v r.2004,kdy byl studován účinek na mnoha nádorových liniích,jak k cisplatině citlivých,tak rezistentních,a kdy vykazuje vyšší účinnost než modelová látka cisplatina. Jedná se o čtyřmocný platinový preparát s objemným hydrofóbním ligandem adamantylaminem,který je zodpovědný za lepší vstup do buňky, je lépe rozpustný a je ho tudíž možno aplikovat perorálně. V současné době je za řazen do klinických studií fáze I. Dalším studiem byly potvrzeny nižší nežádoucí účinky (testování na myších)a překonání rezistence získané i vrozené u ovariálních linií A2780,A2780cis a SK-OV-3.
Mechanismus účinku je nejlépe prostudován u nejznámější látky této podskupiny Pt terapeutik – cisplatiny. Za hlavní je považována interakce Pt derivátu s DNA,nejdůležitější jsou vnitrořetězcové adukty,dále pak mezi řetězcové a adukty DNA – protein. Jakou úlohu hrají jednotlivé adukty v cytotoxicitě není dosud jednoznačně známo. Předpokládá se u nich vliv na syntézu DNA, transkripci,indukci apoptózy a také modulují cytokinetiku. U mnoha buněčných linií byla zjištěna akumulace buněk v S a G2/M fázi buněčného cyklu. Poté následuje oprava poškozených řetězců nebo při vysokém poškození či nedostatečné opravě buněčná smrt.
Kolorektální karcinom je v ČR jedním z nejčastějších nádorových onemocnění. Ve světových statistikách jsme byli první na světě v jeho incidenci r.1997. Jedná se o onemocnění cylindrického epitelu tlustého střeva a rekta. Včasnou diagnostiku komplikuje pomalý zdvojovací čas nádoru a nespecifické příznaky vyplývající z lokality vzniku. Prvotním zásahem je odstranění tumoru event.s odstraněním nepočetných metastáz. Chemoterapie má v léčbě tohoto onemocnění úlohu jak v adjuvantní,tak neoadjuvantí léčbě. Radioterapie se v indikovaných případech omezuje pouze na oblast rekta. Mezi nejčastěji používaná chemoterapeutika patří 5-fluorouracil , leukovorin ,irinotekan ,oxaliplatina ,gemcitabin, atd.
Námi testované látky cisplatina,oxaliplatina a LA-12 byly studovány na dobře popsaném modelu buněčné linie kolorektálního adenokarcinomu HT-29, získaném v roce 1964 z tumoru ženy (44 let). Jedná se o dobře diferencovaný karcinom grade I.
Cílem naší práce bylo zjistit, zda LA-12 bude vykazovat vyšší účinnost než cisplatina a oxaliplatina a zda je schopna překonat vrozenou rezistenci k cisplatině.
V první fázi byla stanovena toxicita sledovaných látek. K tomuto účelu byl použit test metabolické aktivity (MTT)založený na enzymatické redukci tetrazoliové soli na nerozpustný formazan. Porovnáním hodnot IC50 (koncentrace inhibující 50%aktivity mitochondriálních enzymů)se LA-12 ukázala být nejúčinnější ze všech 3 látek (4,42 x než cisplatina,1,56 x než oxaliplatina).
Dále byl sledován vliv na buněčnou populaci. Počet adherentních buněk klesal u v šech látek v závislosti na koncentraci a čase. Počet buněk plovoucích (tedy mrtvých)narůstal opět u všech látek, výrazně se však lišil účinek oxaliplatiny od zbývajících dvou derivátů,u nichž je statisticky významně vyšší. Viabilita hodnocená barvením eosinem výše uvedené výsledky potvrdila. Podíl apoptotických buněk (podle hodnocení morfologie buněčných jader barvených pomocí DAPI ve fluorescenčním mikroskopu) koreloval s počtem plovoucích buněk.Výskyt tohoto typu buněčné smrti byl potvrzen i štěpením proteinu PARP,které bylo detekováno pomocí westernového přenosu a následné imunodetekce. Buněčný cyklus byl analyzován průtokovou cytometrií ((barvení proidium jodidem)po působení všech látek v koncentracích odpovídajících IC20 a IC50 v časových intervalech 24,48 a 72 hod. Hlavním efektem byl nárůst podílu buněk v S fázi trvající po celou dobu experimentu. Jedinou výjimkou byla oxaliplatina v IC20, kde se s časem profil buněčného cyklu měnil směrem k postupné normalizaci.
Z výše popsaných výsledků je zřejmé, že LA-12 je nejúčinnější za všech studovaných látek. Oxaliplatina se výrazně liší v mechanismu účinku. Spolu s cisplatinou vykazuje LA-12 podobný efekt v ekvitoxických koncentracích v počtu plovoucích a přisedlých buněk, což koresponduje i se snižující se viabilitou. Tyto látky indukují apoptotickou smrt u buněk HT-29 a všechny testované látky vykazují zpoždění v S fázi buněčného cyklu s postupným přechodem do G2/M,jen u oxaliplatiny je toto zpoždění tranzientní.
Literatura
- Adam Z,Vorlíček J,Koptíková J and kol.(2003). Obecná onkologie
a podpůrná léčba, Grada Publishing As (ed.):Praha, pp
341.
- Adam Z,Vorlíček J,Vaníček J and kol.(2004). Diagnostické a
léčebné postupy u maligních chorob. Grada Publishing As
(ed.):Praha,pp 95.
- Eastman A.(1990). Cancer Cells,2,275-80.
- Horvath V,Blanarova O,Svihalkova-Sindlerova L,Soucek
K,Hofmanova J,Sova P,Kroutil A,Fedorocko P and Kozubik A. (2006).
Gynecologic Oncology.
- Kelland LR.(1993). Crit Rev Oncol
Hematol,15,191-219.
- Kozubik A,Horvath V,Svihalkova-Sindlerova L,Soucek K,Hofmanova
J,Sova P,Kroutil A,Zak F,Mistr A and Turanek J. (2005). Biochem
Pharmacol,69,373-83.
- Levi F,Metzger G,Massari C and Milano G.(2000).Clin
Pharmacokinet,38,1-21
- Misset JL,Bleiberg H,Sutherland W,Bekradda M and Cvitkovic
E.(2000). Crit Rev Oncol Hematol,35,75-93.
- Sekiguchi I,Suzuki M,Tamada T,Shinomiya N,Tsuru S and Murata
M.(1996). Oncology,53,19 – 26.
- Sorenson CM,Barry MA and Eastman A. (1990). J Natl Cancer
Inst,82,749-55.
- Sova P,Mistr A,Kroutil A,Zak F,Pouckova P and Zadinova M.
(2005). Anticancer Drugs,16,653-7
- Zak F,Turanek J,Kroutil A,Sova P,Mistr A,Poulova A,Mikolin
P,Zak Z,Kasna A,Zaluska D,Neca J,Sindlerova L and
Kozubik A. (2004). J Med Chem,47,761-3
Datum přednesení příspěvku: 11. 5. 2005





